A STUDY OF THE POSSIBILITY OF USING PAPAIN AND BETA-GLUCANASE TO PRODUCE YEAST HYDROLYSATE
A STUDY OF THE POSSIBILITY OF USING PAPAIN AND BETA-GLUCANASE TO PRODUCE YEAST HYDROLYSATE
Abstract
The article focuses on the production of microbial proteins (Single-Cell Proteins, SCP) using the yeast Saccharomyces cerevisiae. This approach has a great promise in food fortification and animal protein replacement. The advantage of SCP is the minimal use of water and land resources and reduced waste generation.
An enzymatic method of yeast cell wall degradation for the production of protein isolates is proposed. The enzymes papain and bromelain were found to increase the dry matter yield of yeast hydrolysate. From a given set of enzymes, the highest protein yield could be observed in the combination of papain at a dosage of 1% and beta-glucanase at a dosage of 0.03%. The protein yield in this sample was 1.51%, which is 3.5 times higher than the protein yield in samples using the combination of pepsin and beta-glucanase enzymes. The yield of hydrolysed protein, relative to the original protein, ranged from 9.8 to 37.5%.
1. Введение
Начиная с 2020 года, на фоне пандемии вопрос глобального дефицита белка в человеческом рационе стал снова актуальным. Продовольственная и сельскохозяйственная организация Объединенных Наций в своем докладе сообщила об ожидаемой нехватке богатой белком пищи на рынке . К счастью, продовольственного кризиса удалось избежать, однако, учитывая растущее население нашей планеты, необходимо развивать альтернативные пути получения высококачественного и пригодного для употребления белка.
Одним с таких способ является производство одноклеточных белков или Single-cell Proteins (SCP) – экстрактов биомассы чистых или смешанных культур водорослей, грибков или дрожжей. Полученный таким способом белок может быть использован как ингредиент для обогащения пищевых продуктов или замены животного белка. Выгодным отличием от традиционных способов получения богатых белком продуктов, например животноводства, являются отсутствие потребности в интенсивном использовании водно-земельных ресурсов, и значительно меньшее количество отходов .
Дрожжи Saccharomyces cerevisiae благодаря своей доступности и химическому составу (рис. 1) являются подходящим вариантом для получения белкового изолята.

Рисунок 1 - Приблизительное процентное содержание веществ в дрожжевой клетке
Таблица 1 - Содержание аминокислот
Аминокислоты | Дрожжи Sacch. cerevisiae | Творог, мг/100 г продукта | Телятина 1-й категории, мг/100 г продукта |
Незаменимые, мг/100 г продукта | 4802 | 7680 | 7626 |
Валин, мг/100 г продукта | 698 | 990 | 1156 |
Изолейцин, мг/100 г продукта | 741 | 1000 | 998 |
Лейцин, мг/100 г продукта | 903 | 1850 | 1484 |
Лизин, мг/100 г продукта | 913 | 1450 | 1683 |
Метионин, мг/100 г продукта | 233 | 480 | 414 |
Треонин, мг/100 г продукта | 644 | 800 | 855 |
Триптофан, мг/100 г продукта | 174 | 180 | 245 |
Фенилаланин, мг/100 г продукта | 496 | 930 | 791 |
Заменимые, мг/100 г продукта | 5785 | 10270 | 12333 |
Алин, мг/100 г продукта | 366 | 440 | 1124 |
Аргинин, мг/100 г продукта | 528 | 810 | 1278 |
Аспарагиновая кислота, мг/100 г продукта | 684 | 1000 | 1844 |
Гистидин, мг/100 г продукта | 302 | 560 | 739 |
Глицин, мг/100 г продукта | 465 | 260 | 948 |
Глутаминовая кислота, мг/100 г продукта | 1570 | 3300 | 3329 |
Пролин, мг/100 г продукта | 490 | 2000 | 1333 |
Серин, мг/100 г продукта | 583 | 820 | 813 |
Тирозин, мг/100 г продукта | 676 | 930 | 689 |
Цистин, мг/100 г продукта | 121 | 150 | 236 |
Принципиальная схема получения белкового изолята включает в себя следующие обязательные этапы: экстрагирование белков; осаждение белка в изоэлектрической точке рН; центрифугирование; концентрация и очистка белка, промывка и сушка . Экстрагирование белков из биомассы возможно только после разрушения клеточной стенки. Разрушение может быть осуществлено физическим, химическим и ферментативным способом. В рамках данного исследования внимание было сосредоточено на получении белковых изолятов с использованием ферментативного способа разрушения клеточных стенок.
Процесс естественного автолиза дрожжевых клеток, продолжительность которого может составлять от двух суток до 2 месяцев, обусловлен активностью собственных ферментов, включая протеолитические, гидролитические и оксиредуктазы . В контексте этого процесса, дополнительное внедрение внешних ферментов, таких как папаин, получаемый из плодов папайи, и бромелаин, извлекаемый из стеблей и плодов ананаса, может дополнительно ускорить ферментативный гидролиз клеточных структур дрожжей. Папаин, как протеолитический фермент, эффективно разрушает белковые связи, в то время как бромелаин, содержащий смесь протеаз, амилаз и липаз, дополнительно активен в гидролизе белковых компонентов . Этот интегрированный подход может оптимизировать выход белка и улучшить процесс ферментативного гидролиза, способствуя получению дрожжевого изолята с желаемыми свойствами.
Клеточная стенка дрожжей состоит примерно на 40% из маннанопротеинов, на 60% из глюканов и на 2% из хитина (таблица 2) .
Таблица 2 - Компоненты клеточной стенки дрожжей Saccharomyces cerevisiae
Компоненты клеточной стенки | Количество, % от КС | Основной тип связи | Степень полимеризации | Mr, кДа | Число молекул х106 на клетку |
Маннанопротеины | 40 | α1,6 + α1,3 + α1,2 | - | От <10 до >450 | 2,6 |
Глюкан: | - | β1,3 | - | - | - |
щелочерастворимый | 20 | β1,3 | 1500 | 243 | 2,5 |
щелоче/кислотонерастворимый | 35 | β1,3 | 1500 | 243 | 4,3 |
щелоченерастворимый, кислоторастворимый | 5 | β1,6 | 140 | 23 | 6,6 |
Хитин | 2 | β1,4 | - | - | - |
В реакции гидролиза есть одна, важная для понимания процесса, деталь – при расщеплении пептидной связи, добавляется одна молекула воды. Это значительно сказывается на составе сухого вещества конечного продукта, поскольку он зависит от степени гидролиза. Если белковый изолят, с содержанием белка 90% в сухом веществе, гидролизуют с DH = 25%, то на каждые четыре аминокислоты приходится одна молекула воды, что соответствует 18/(4*128) = 3,5% воды будет добавлено в смесь. Конечная смесь в таком случае будет содержать 86,5% белка в пересчете на сухое вещество. Это может привести к противоречию с определениями изолятов, которые обычно определяются как содержащие не менее 90% белка в пересчете на сухое вещество .
2. Методы и принципы исследования
В ходе эксперимента использовались прессованные хлебопекарные дрожжи «Люкс Экстра» (ООО «Саф-Нева», Россия), сухие ферменты пепсин, трипсин, папаин, бромелаин и жидкая бета-глюканаза. Протеолитические ферменты пепсин, трипсин, папаин и бромелаин на первом этапе, с последующим внесением бета-глюканазы во все образцы.
Пепсин (код фермента 3.4.23.1) – эндопептидаза, протеолитический фермент, принадлежит к классу гидролаз. Трипсин (код фермента 3.4.21.1) – фермент группы сериновых протеаз, способный расщеплять пептиды и белки, а также сложные эфиры. Папаин (код фермента 3.4.22.2) фермент является монотиоловой цистеиновой эндопротеазой, по своему действию схож с пепсином, однако действует как в кислых, так и в щелочных средах (рН 3-12) и проявляет амидазную/трансамидазную а также эстеразную/трансэстеразную активность. Бромелаин (код фермента 3.4.22.32) – цистеиновые протеиназы (эндопептидазы), растворим в воде. Бета-глюканаза (код фермента 3.2.1.6) – фермент способен расщеплять 1,3 и 1,4 гликозидые связи β-глюканов и других полисахаридов , , , . Характеристика ферментов представлена в таблице 3.
Таблица 3 - Характеристика выбранных ферментов
Название | Оптимум рН | Оптимальная t, °С | t инактивации, °С |
Пепсин | 1,5-2,0 | 25-30 | 60 |
Трипсин | 7,8-8,0 | 45-50 | 50 |
Папаин | 5,0-7,0 | 60 | 80 |
Бромелаин | 5,0-8,0 | 50-60 | 80 |
Бета-глюканаза | 4,5-5,5 | 50-55 | 80 |
Измерения сухих веществ (СВ) производились рефрактометрическим методом на автоматическом рефрактометре модели PTR 46X (Index Instruments Ltd., Великобритания) в конце каждой инкубации и после конечного центрифугирования. Измерение рН проводилось потенциометрическим методом на автоматическом титраторе 848 Titrino Plus (Metrohm, Швейцария). Содержание белка в конечном продукте измерялось по методу Кьельдаля .
В рамках эксперимента готовилась 10% дрожжевая суспензия прессованных хлебопекарных дрожжей, из которой формировалось 12 образцов с различными дозировками каждого из протеолитических ферментов. Для каждого фермента были выбраны три дозировки – минимальная, средняя и максимальная (таблица 4), итого получили 12 вариаций (таблица 5).
Таблица 4 - Дозировки внесения протеолитических ферментов
Фермент | Минимальная дозировка, % | Средняя дозировка, % | Максимальная дозировка, % |
Папаин | 0,01 | 0,5 | 1 |
Трипсин | |||
Пепсин | |||
Бромелаин |
После этого образцы инкубировались на водяной бане в течение 120 минут при оптимальной температуре и уровне рН (таблица 3), затем инактивировались при 80°С в течение 15 минут. Далее вносился фермент бета-глюканаза в дозировке 0,03% и инкубировался в течение 120 минут при температуре 55°С с последующей инактивацией при 80°С в течение 15 минут. Затем раствор центрифугировался при 6000 об/с в течение 10 минут. Из жидкой фазы белок осаждался в изоэлектрической точке рН 4,5 и осадок высушивался при температуре 40-50°С в течение 120 минут.
Параллельно готовился контрольный образец по способу экстракции этанолом. В 10% дрожжевую суспензию добавлялся 96% этанол в количестве 1,5%. Этот раствор в дальнейшем инкубировался при температуре 70°С и рН 5,5 в течение 255 минут, что равняется времени инкубации образцов с ферментами, затем подвергался кипячению в течение 15 минут. Далее образец центрифугировался при 6000 об/с в течение 10 минут. Из жидкой фазы белок осаждался в изоэлектрической точке рН 4,5 и осадок высушивался при температуре 40-50°С в течение 120 минут.
Конечные образцы были проанализированы по методу Кьельдаля для выявления содержания сырого протеина.
Математическая обработка данных производилась с использованием программы Microsoft Excel.
3. Основные результаты
Результаты показателей сухих веществ и рН в образцах дрожжевого гидролизата после ферментативной обработки представлены в таблице 5 и на рисунке 2.
Таблица 5 - Динамика изменения показателей в образцах дрожжевого гидролизата
Фермент | Дозировка, % | Начальный рН раствора | СВ после первой инкубации, % | СВ после второй инкубации, % | СВ после центрифугирова-ния, % | Конечный рН раствора |
Папаин | 0,01 | 5,2 | 0,5 | 1,3 | 2,2 | 6,4 |
Папаин | 0,50 | 5,2 | 1,7 | 3 | 3,5 | 6,1 |
Папаин | 1,00 | 5,2 | 2,2 | 3,3 | 4,2 | 5,8 |
Бромелаин | 0,01 | 5,2 | 0,2 | 0,5 | 1,4 | 6,4 |
Бромелаин | 0,50 | 5,2 | 0,7 | 1,2 | 2,6 | 6,5 |
Бромелаин | 1,00 | 5,2 | 1,3 | 1,6 | 2,9 | 6,6 |
Пепсин | 0,01 | 2 | 0,2 | 0,5 | 1,4 | 4,3 |
Пепсин | 0,50 | 2 | 0,5 | 1 | 1,8 | 4,2 |
Пепсин | 1,00 | 2 | 1,4 | 1,5 | 2,2 | 4,3 |
Трипсин | 0,01 | 8 | 0,6 | 1 | 1,6 | 6,5 |
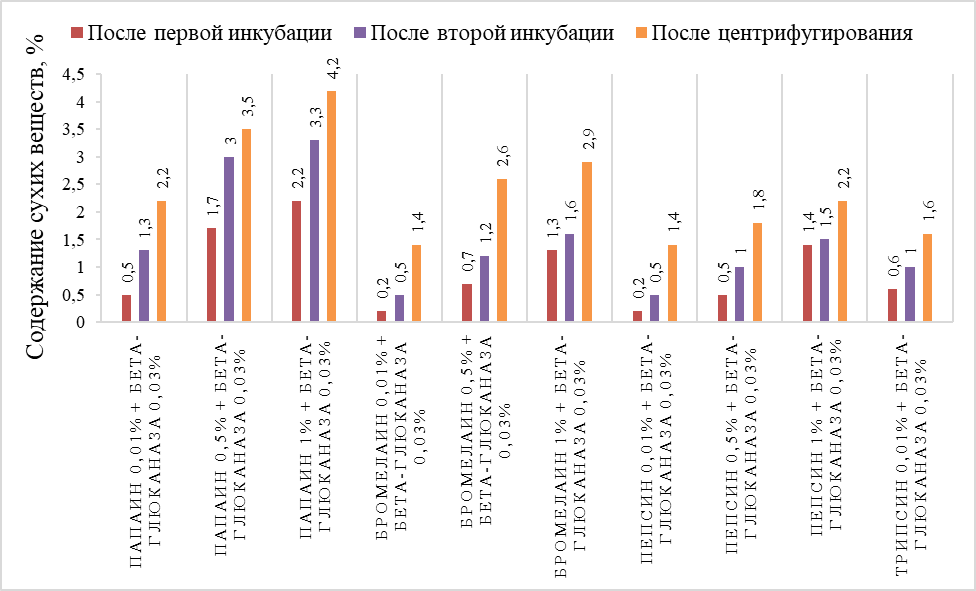
Рисунок 2 - Динамика изменения массовой доли сухих веществ
Показатели сухих веществ и рН образца по способу экстракции этанолом представлены в таблице 6.
Таблица 6 - Динамика изменения показателей в образце с этанолом
Реагент | Дозировка, % | СВ после инкубации, % | СВ после центрифугирования, % | Конечный рН раствора |
Этанол | 1,5 | 0,6 | 1,8 | 6,2 |
Данные в таблице показывают, что контрольный образец без добавления ферментов имеет более низкие показатели сухих веществ после инкубации и центрифугирования.
Результаты измерения содержания сырого протеина в образцах гидролизата представлены в таблице 7 и на рисунке 3.
Таблица 7 - Содержание сырого протеина в образцах
Наименование образца | Количество образца, мл | Титранта, мл | Азот (N), мг | Азот (N)/ 100 г, мг | Азот (N), % | Белок, % |
Папаин 1% | 25,0000 | 43,944 | 61,552 | 246,207 | 0,246 | 1,539 |
Папаин 1% | 25,0000 | 44,688 | 62,595 | 250,379 | 0,250 | 1,565 |
Пепсин 1% | 25,0000 | 12,548 | 17,576 | 70,303 | 0,070 | 0,439 |
Пепсин 1% | 25,0000 | 11,947 | 16,734 | 66,936 | 0,067 | 0,418 |
Этанол 1,5% | 25,0000 | 11,529 | 16,149 | 64,596 | 0,065 | 0,404 |
Этанол 1,5% | 25,0000 | 10,739 | 15,041 | 60,166 | 0,060 | 0,376 |
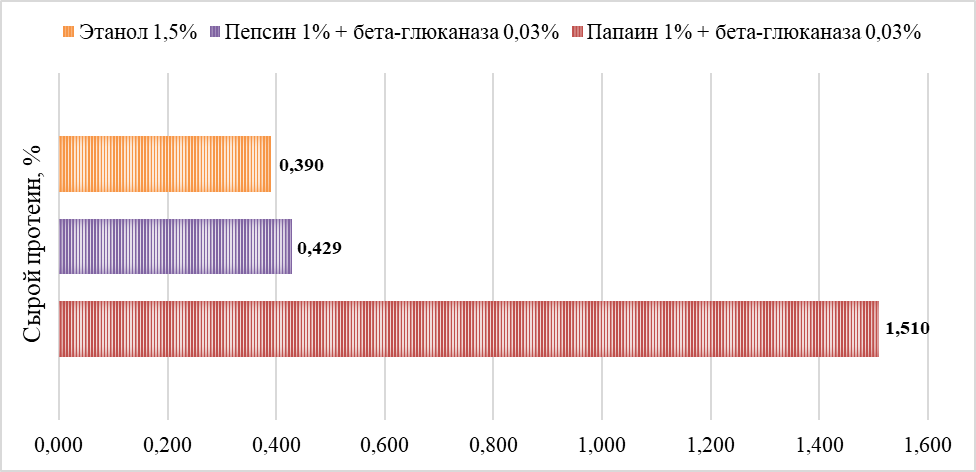
Рисунок 3 - Содержание сырого протеина в гидролизатах
– При экстракции этанолом 4,88%;
– При экстракции с использованием пепсина 5,36%;
– При экстракции с использованием папаина 18,75%.
При учете того, что усреднённое содержание белка, в пересчёте на абсолютно сухое вещество, составляет 50%, то мы имеем следующий выход очищенного микробного белка, относительно исходного негидролизованного:
– При экстракции этанолом 9,8%;
– При экстракции с использованием пепсина 10,7%;
– При экстракции с использованием папаина 37,5%.
Целевым показателем содержания микробного белка после гидролиза, на данный момент, по мнению исследователей является 50% , . В связи с этим полученный результат можно охарактеризовать, как вызывающий умеренный оптимизм.
4. Заключение
В результате экспериментов выявлено, что использование протеолитических ферментов папаина и бромелаина увеличивает выход сухих веществ в дрожжевом гидролизате. Из заданного набора ферментов наибольший выход белка можно наблюдать в комбинации ферментов папаина в дозировке 1% и бета-глюканазы в дозировке 0,03%. Выход сырого протеина в этом образце составил 1,51%, что в 3,5 раз больше, чем выход белка в образцах с использованием комбинации ферментов пепсина и бета-глюканазы. Также стоит отметить, что рН раствора после всех манипуляций повышается в среднем на 1,45 пункта, за исключением использования фермента трипсина.
Выход гидролизованного белка, относительно исходного варьируется от 9,8 до 37,5%, что, при целевом показателе 50%, можно считать приемлемым.
Исходя из имеющихся результатов, в дальнейшем планируется:
а) изучить существующие протеолитические ферменты с оптимальным уровнем рН и температурой близким к оптимальным для естественного автолиза дрожжей, с целью подобрать комбинацию ферментов способных ускорить процесс естественного гидролизата и повысить выход питательных веществ;
б) подобрать наилучший температурный режим для такой комбинации ферментов;
в) подобрать подходящий способ очистки белка в полученном дрожжевом экстракте для получения белкового изолята с содержанием белка 80%.
Исследование подтверждает, что дрожжи Saccharomyces cerevisiae, благодаря их химическому составу и доступности, представляют собой перспективный источник белкового изолята. Этот подход может быть ключевым элементом в разработке эффективных и устойчивых методов получения белка, отвечающих растущим потребностям нашего общества.
