STANDARDIZATION OF SEMI-PRODUCTS (FILAMENTS) FOR TABLET PRODUCTION BY 3D PRINTING METHOD
STANDARDIZATION OF SEMI-PRODUCTS (FILAMENTS) FOR TABLET PRODUCTION BY 3D PRINTING METHOD
Abstract
Objective. To develop methods for quality evaluation of the intermediates of printed indapamide tablets – filaments obtained by melt extrusion and quantitative determination of indapamide in them.
Materials and Methods. Indapamide filaments were prepared by melt extrusion on a Haake™ miniCTW twin-screw laboratory extruder (Thermo Fisher Scientific, Germany). Indapamide release from Arifon® filaments and tablets was studied using an Erweka DT 626/1000 HH dissolution tester (ERWEKA GmbH, Germany). Indapamide content in filaments, dosing uniformity, as well as the amount of the substance transferred into the dissolution medium were determined spectrophotometrically (spectrophotometer SF-2000, LLC "OKB Spektr", Russia).
Results. The compatibility of indapamide with polymers Kollidon® VA 64 and Soluplus® was studied. The methodology was developed and conditions of ‘Dissolution’ test for filaments as a semi-product of printed indapamide tablets soluble in stomach were justified: apparatus "Paddle stirrer", rotation speed – 100 rpm, dissolution medium – solution of 0.1 M hydrochloric acid, volume of dissolution medium – 500 ml. In 15 min, at least 85% of indapamide from the declared content should be released.
Conclusion. Methods have been developed to evaluate the quality of filaments containing indapamide: a technique for quantitative determination of indapamide in filaments, "Dosing uniformity" test and "Dissolution" test. An alternative apparatus to study the release of indapamide from filaments, due to its low percentage content, could be the "Flow Cell" apparatus. Similarly, techniques for quantification of other substances in filaments can be adapted.
1. Введение
Последние десятилетия в системе здравоохранения наметились изменения, характеризующиеся появившейся и активно развивающейся тенденцией перехода от массовой к персонализированной медицине , . Персонализация заключается в подборе оптимальной лекарственной формы (ЛФ) конкретного фармакологически активного вещества в дозировке, определенной на основании фармакокинетических и фармакогеномных данных пациента , , . Это особенно важно для таких групп населения как новорожденные, пациенты детского и пожилого возраста и др. , . Применение индивидуально подобранных лекарственных средств (ЛС) поможет повысить не только эффективность терапии, но и приверженность пациента предписанному врачом лечению , .
Точная доза активной фармацевтической субстанции (АФС) для достижения оптимального терапевтического эффекта необходима при лечении многих заболеваний, среди которых можно выделить сердечно-сосудистые патологии, и особенно артериальную гипертензию (АГ). Для лечения АГ широко используются диуретические ЛС, оказывающие выраженный антигипертензивный эффект , . Одним из представителей данной группы препаратов является индапамид, широко используемый в монотерапии АГ, а также совместно с другими антигипертензивными ЛС .
Таблетки как лекарственная форма широко представлены на фармацевтическом рынке. Однако появление новых технологий, в частности, трёхмерной печати, позволило из ранее известных ЛС, используя аддитивные технологии, получать лекарственные препараты (ЛП) принципиально новым способом , , . Таблетки могут быть напечатаны в соответствии с нуждами и требованиями пациента на любых этапах лечения, включая профилактику и диагностику , , .
Одним из видов аддитивного производства является печать послойным наплавлением (Fused Deposition Modeling, или FDM-печать) , . Данный вид печати заключается в расплавлении материала, содержащего действующее вещество, и осаждении его слоями с целью получения твердого объекта определенной геометрической формы .
Для производства твердых дозированных ЛФ по технологии FDM-печати необходим полупродукт в виде нити – филамента. К филаментам предъявляется ряд требований :
- постоянный диаметр по всей длине филамента;
- пластичность;
- температура плавления филамента не должна превышать допустимых температур нагрева печатающей головки.
Материал филамента также должен обеспечивать адгезию первого слоя с рабочей поверхностью принтера, а АФС должна быть распределена равномерно по всему объему филамента.
В связи с интеграцией технологии трехмерной печати в фармацевтическую разработку персонализированных ЛС становится актуальной разработка показателей качества и методик их определения для филаментов, как полупродукта, от которого зависит качество готового ЛП.
2. Методы и принципы исследования
2.1. Субстанция
Субстанция: индапамид (АО «Активный компонент», Россия, серия 10220); вспомогательные вещества: сополимер поливинилпирролидона и винилацетата Kollidon® VA64 (BASF, Германия), ПЭГ 6000-винилкапролактам-винилацетат Soluplus® (BASF, Германия), стеарат магния («Peter Greven Nederland C.V.», Нидерланды); Арифон® таблетки, покрытые пленочной оболочкой, 2,5 мг (производства «Лаборатории Сервье Индастри», Франция, серия 6006406); реактивы: вода очищенная, кислота хлористоводородная, ос.ч. (АО «ВЕКТОН», Россия), этанол 96%.
2.2. Оборудование
Двухшнековый лабораторный экструдер Haake™ miniCTW, Thermo FisherScientific (Германия); штангенциркуль электронный Matrix; тестер растворения Erweka DT626/1000 HH (Германия), спектрофотометр СФ-2000 (ООО «ОКБ Спектр», Россия); весы лабораторные СЕ 224-С (Сартогосм, Россия).
2.3. Приготовление филамента, содержащего индапамид
Индапамид и Kollidon® VA 64 смешивали вручную, используя ступку и пестик. Содержание индапамида в филаментах составляло 2; 4 и 6%. Полученную смесь загружали в питатель экструдера и экструдировали при постоянной температуре 135 °С через сопло диаметром 0,5 мм при скорости вращения шнеков 20 об/мин.
Филаменты, содержащие 2% индапамида и Soluplus®, получали аналогичным образом при температуре 125 °С через сопло диаметром 0,5 мм при скорости вращения шнеков 20 об/мин.
2.4. Оценка совместимости полимеров с индапамидом
Готовили растворы индапамида и физических смесей полимеров Kollidon® VA 64 и Soluplus® с индапамидом в 0,1 М растворе хлористоводородной кислоты. Снимали их ультрафиолетовые (УФ) спектры поглощения.
2.5. Количественное определение индапамида в филаментах
Навеску филаментов, содержащих индапамид, отбирали путем отламывания частей одинаковой длины от исходного филамента. Отрезки имели длину (10 ± 2) мм и массу около 50, 25 и 20 мг для филаментов с содержанием индапамида 2; 4 и 6%, соответственно (рисунок 1).

Рисунок 1 - Внешний вид навесок филамента для проведения испытаний
Приготовление раствора рабочего стандартного образца (РСО) индапамида: около 25 мг (точная навеска) РСО индапамида помещали в мерную колбу вместимостью 25 мл, растворяли в этаноле 96 %, и доводили объем раствора тем же растворителем до метки (раствор А). В мерную колбу вместимостью 200 мл помещали 1,0 мл раствора А и доводили объем 0,1 М раствором кислоты хлористоводородной до метки.
Количественное содержание индапамида определяли спектрофотометрически в кювете из кварцевого стекла с толщиной поглощающего слоя 10 мм в интервале длин волн от 220 нм до 350 нм.
2.6. Определение однородности дозирования
Условия для испытания подбирались в соответствии с требованиями ОФС.1.4.2.0008 «Однородность дозирования» Государственной Фармакопеи (ГФ) Российской Федерации (РФ) XV издания.
Для определения однородности дозирования индапамида в филаментах на основе полимера Kollidon® VA 64 использовался метод спектрофотомерии в УФ-области спектра. Навеску филаментов, содержащих индапамид, отбирали путем отламывания частей одинаковой длины из разных точек исходного филамента. Приготовление испытуемого раствора и раствора РСО проводилось аналогично методике количественного определения.
2.7. Изучение высвобождения индапамида из филаментов
За основу была взята методика количественного определения индапамида в таблетках и адаптирована для филаментов, содержащих индапамид . Испытание «Растворение» для филаментов проводили также по адаптированной методике, предлагаемой для таблеток Арифон® («Лаборатории Сервье Индастри», Франция). В качестве среды растворения использовали 0,1 М раствор кислоты хлористоводородной объемом 500 мл. Температура среды находилась в диапазоне (37 ± 0,5) °C. Испытание проводили в аппарате «Лопастная мешалка» со скоростью вращения 100 об/мин. Для построения профиля высвобождения отбирали пробы через 10, 15, 20, 30, 45 и 60 мин.
Навески для испытания «Растворение» представляли собой отрезки филамента длиной (10 ± 2) мм, аналогично определению количественного содержания индапамида.
3. Основные результаты
Исследование включало несколько этапов: оценку совместимости полимеров с индапамидом; разработку методик количественного определения индапамида в филаментах; разработку методики для проведения испытания «Однородность дозирования» и разработку методики теста «Растворение» для филаментов с индапамидом.
3.1. Оценка совместимости полимеров с индапамидом
Филаменты получали путем смешивания и дальнейшей экструзии смеси индапамида и полимера-носителя, поэтому первоначально необходимо было установить совместимость исходных компонентов. Для этого были сняты ультрафиолетовые спектры поглощения субстанции индапамида и 0,05 % растворов физических смесей полимеров Kollidon® VA 64 и Soluplus® с индапамидом в 0,1 М растворе хлористоводородной кислоты (рисунки 2 и 3, соответственно). В качестве среды растворения была выбрана кислота хлористоводородная как имитация кислой среды желудка, в которой заявлено растворение будущей ЛФ.
Установлено, что УФ спектр физической смеси полимера Kollidon® VA 64 с индапамидом имеет максимум при 242 нм и плечи при 279 и 287 нм, характерные для субстанции индапамида (рисунок 2). Стоит отметить, что полимер способен поглощать излучение в том же диапазоне длин волн, что и индапамид; впоследствии этот факт учитывался при расчетах количественного содержания индапамида в образцах.
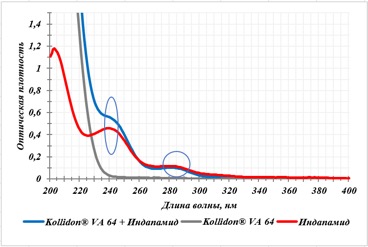
Рисунок 2 - Спектры поглощения субстанции индапамида, полимера Kollidon® VA 64 и их физической смеси
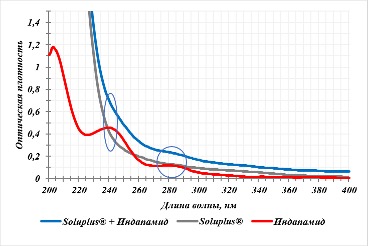
Рисунок 3 - Спектры поглощения субстанции индапамида, полимера Soluplus® и их физической смеси
3.2. Количественное определение индапамида в филаментах
Далее необходимо было разработать методику количественного определения индапамида в филаментах. За основу была взята методика определения индапамида в таблетках, валидированная со следующими характеристиками: RSD = 0,13%, R2=0,975.
Содержание индапамида в филаментах составило (1,90 ± 0,04)%; (3,77 ± 0,08)% и (5,70 ± 0,13)%, что соответствовало 95,1%; 94,2% и 95,0% от заявленного количества для филаментов с индапамидом 2; 4 и 6%. Данный показатель необходимо учитывать при разработке спецификации качества на препарат.
3.3. Однородность дозирования
Поскольку филамент – это полупродукт для производства дозированной ЛФ – таблетки, на следующем этапе исследования проводилась разработка методики для проведения испытания «Однородность дозирования». Условия для испытания подбирались в соответствии с требованиями ОФС.1.4.2.0008.18 «Однородность дозирования» ГФ РФ XIV издания.
Для определения однородности дозирования индапамида в филаментах на основе полимера Kollidon® VA 64 использовался метод спектрофотомерии в УФ-области спектра. Взятие навески филамента, приготовление испытуемого раствора и раствора РСО проводилось аналогично методике количественного определения, описанной выше.
Результаты испытания, полученные на 10 навесках филаментов каждой концентрации, приведены в таблице 1. Из представленных данных следует, что образцы филаментов, изготовленные на основе полимера Kollidon® VA 64 и содержащие 2; 4 и 6% индапамида, однородны.
Таблица 1 - Результаты проведения испытания «Однородность дозирования» для филаментов, изготовленных на основе полимера Kollidon® VA 64
Наименование показателя | Содержание индапамида в филаменте, % | ||
2 | 4 | 6 | |
Содержание АФС в 1 навеске (в % от номинального значения), | x1 = 94,50 x2 = 98,00 x3 = 94,00 x4 = 94,00 x5 = 92,50 x6 = 93,00 x7 = 96,50 x8 = 94,50 x9 = 97,50 x10 = 96,50 | x1 = 93,50 x2 = 97,25 x3 = 92,75 x4 = 93,25 x5 = 96,00 x6 = 96,25 x7 = 95,25 x8 = 90,50 x9 = 92,25 x10 = 95,25 | x1 = 92,50 x2 = 97,17 x3 = 94,00 x4 = 97,50 x5 = 92,50 x6 = 97,50 x7 = 94,33 x8 = 92,67 x9 = 94,83 x10 = 97,17 |
Среднее арифметическое значений (%), = | 95,10 | 94,23 | 95,02 |
Константа приемлемости, k | 2,4 | ||
Стандартное отклонение, s s = | 1,90 | 2,11 | 2,14 |
Эталонное значение дозы (% от номинального значения), M | 98,5 | ||
Первый показатель приемлемости (%), AV AV = | 7,95 | 9,33 | 8,62 |
Максимально допустимое значение АV(%), L1 | 15,0 | ||
Интерпретация результата | AV ≤ L1 Филамент однороден | ||
Примечание: АФС – активная фармацевтическая субстанция
3.4. Разработка методики теста «Растворение» для филаментов с индапамидом
В настоящее время индапамид представлен на фармацевтическом рынке РФ в виде таблеток, для которых имеется тест «Растворение». Методику данного испытания было решено использовать и для филаментов.
Было проанализировано по 12 образцов навесок филаментов, изготовленных на основе полимера Kollidon® VA 64, и содержащих 2; 4 и 6% индапамида. Профили высвобождения индапамида из филаментов на основе полимера Kollidon® VA 64 представлены на рисунке 4.
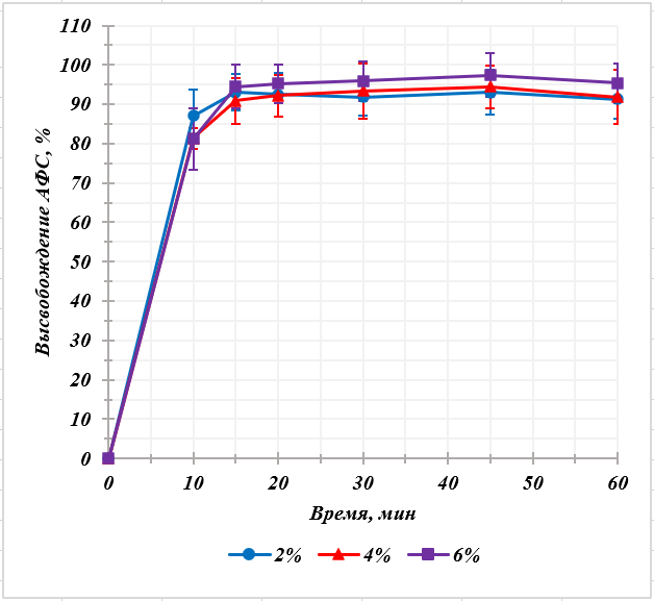
Рисунок 4 - Профили высвобождения индапамида из филаментов с различным содержанием АФС
4. Заключение
Разработаны методики оценки качества филаментов, содержащих индапамид. Определение количественного содержания индапамида в филаментах, а также испытание «Однородность дозирования» рекомендовано проводить методом спектрофотометрии при длинах волн от 220 до 350 нм в среде 0,1 М кислоты хлористоводородной. Сделан вывод, что отбор пробы филаментов для анализа необходимо осуществлять путем получения отрезка филамента определённой длины.
Разработана методика и обоснованы условия проведения теста «Растворение» для филаментов как полупродукта печатных таблеток индапамида, растворимых в желудке: аппарат «Лопастная мешалка», скорость вращения – 100 об/мин, среда растворения – раствор 0,1 М кислоты хлористоводородной, объем среды растворения – 500 мл. За 15 мин должно высвободиться не менее 85 % индапамида от заявленного содержания.
Подходы к разработке методик определения количественного содержания индапамида в филаментах можно перенести на разработку методик определения других АФС, схожих по свойствам.
Так как на данный момент нет нормативных документов, регламентирующих требования к контролю качества филаментов и напечатанных ЛФ, необходимо продолжить исследования на напечатанных ЛФ и филаментах, содержащих другие АФС.
