ПЕПТИДНО-БЕЛКОВЫЙ КОМПЛЕКС ИЗ МОЗГА КРУПНОГО РОГАТОГО СКОТА: БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ И СТРУКТУРА
ПЕПТИДНО-БЕЛКОВЫЙ КОМПЛЕКС ИЗ МОЗГА КРУПНОГО РОГАТОГО СКОТА: БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ И СТРУКТУРА
Аннотация
Исследован пептидно-белковый комплекс из мозга быка (ПБК-М). Показано, что в его состав входит белок с молекулярной массой 66666 Да с частичной N-концевой аминокислотной последовательностью DTHKSEIAHRFKDLG–, гомологичной зрелой молекуле бычьего сывороточного альбумина, и полипептиды с молекулярными массами 2180-7755 Да. С помощью КД-спектроскопии изучено влияние температуры и различных рН на пространственную организацию ПБК-М. Методом динамического светорассеяния обнаружено, что ПБК-М в водных растворах образует рН- и термостабильные наночастицы и ингибирует агрегацию модельных белков, индуцированную дитиотриетолом. На модели экспериментального гемморрагического инсульта у крыс in vivo показано, что ежедневное введение интраназально раствора ПБК-М в ультранизкой концентрации способствует развитию в ткани мозга процессов восстановления и регенерации, выражающееся в образовании клеток нейроэпителия (эпендимных клеток), сосудистых сплетений, пирамидальных нейронов в зоне поражения и быстрого зарастания раневого канала.
1. Введение
Поиск новых физиологических активных веществ, установление закономерностей их действия в живых системах и создание на их основе фармакологических препаратов являются актуальными задачами нашего времени. В этом аспекте интерес вызывают мембранотропные гомеостатические тканеспецифические биорегуляторы (МГТБ), обнаруженные в различных тканях позвоночных животных, растений и грибов. Они представляют собой внеклеточно локализованные пептидно-белковые комплексы, образующие в растворах наноразмерные частицы. МГБТ влияют на адгезию, дифференцировку, апоптоз, миграцию и пролиферацию клеток. Важным свойством биорегуляторов данной группы является их способность к стимуляции процессов восстановления в травмированных и патологически измененных тканях. Биологическая активность МГБТ характеризуется тканевой специфичностью, но отсутствием видовой , .
Установлено, что МГТБ имеют сложный состав: было показано присутствие не только пептидно-белковой, но также, углеводной и липидной компонент. Характерным и в то же время, уникальным свойством, МГТБ является их способность оказывать влияние на состояние воды биологических жидкостей . Наиболее полноценно изучена компонента, представляющая собой пептидно-белковый комплекс (ПБК), который состоит из пептидов с молекулярными массами 1000–10000 Да и белка-модулятора , . Было установлено, что белки, входящие в состав МГТБ, выделенных из тканей животных, являются сывороточными альбуминами. В тканях млекопитающих они представлены его изоформами — членами семейства сывороточного альбумина .
Ранее в составе МГТБ, выделенного из ткани головного мозга крыс, был обнаружен ряд пептидов с молекулярными массами в диапазоне 2000 – 6000 Да, в том числе, пептиды с молекулярными массами 2451, 2820, 2904, 3315, 3481, 3549, 3663, 3874, 4300, 4331, 4403, 4671, 4749, 4801, 4970, 6016 Да , . Методами протеомных исследований была установлена первичная последовательность пептида с молекулярной массой 4749 Да.
Полученная структура — N-миристоил-G-пальмитоил-S-CTLSAEERAALERSKAIEKNLKEDGISAAKDVKLLLLGAG – показала, что этот пептид представляет собой N-концевой фрагмент гуанин-нуклеотидсвязывающего Go-белка, преобладающего в головном мозге млекопитающих . Ранее было показано, что ПБК-М восстанавливал снижение скорости проведения и амплитуды потенциала действия, при ритмическом возбуждении в демиелинизированном нервном волокне лягушки. То есть, проникая в разрушенные области миелина, биорегулятор вызывал не только изменение состояния воды и объема мезаксона и насечек, но и перераспределение связанного Са2+ (увеличение его связывания в миелине, а не на плазматической мембране аксонов) и заряда фосфолипидов, что увеличивало плотность миелина и соответственно скорость проведения потенциала действия по нервному волокну и его амплитуду .
Целью данной работы было исследование структуры, биологического действия и влияния на ткани мозга млекопитающих (крыс) МГТБ, выделенного из мозга молодых бычков.
2. Методы и принципы исследования
2.1. Выделение и очистка
ПБК-М был выделен из головного мозга молодых быков, полученных на мясоперерабатывающих заводах г. Москвы и Московской области. Ткань нарезали на фрагменты, размером 1.5-2.0 см2 и помещали на 3 часа при 4°C в экстрагирующий раствор состава: 1.0 мМ СаСl2, 0.15 M NaCl, 1.0 мМ HEPES, pH 7.0-7.2. Тканевой экстракт фильтровали через четыре слоя марли и центрифугировали при 3000 g в течение 15 мин. Надосадочную жидкость собирали и осаждали белки сернокислым аммонием условиях насыщенного раствора соли. Образовавшуюся суспензию белков оставляли на 96 часов при 4ºC, потом разделяли на супернатант и осадок центрифугированием 45 мин при 15000 g. Фракцию, содержащую осадок, растворяли в воде, наносили на колонку Superdex™ 75 (10×300 мм) GL «GE Helthcare» (Швеция), уравновешенную водой и разделяли методом гельфильтрации на хроматографе Bio-Rad NGC Chromatography System Quest Plus (США). Скорость элюции — 0.5 мл/мин. Детекцию проводили спектрофотометрически при 210 и 280 нм. Фракцию после гельфильтрации наносили на колонку Kromasil C4 (4.6×250 мм) (AkzoNobel, Швеция), уравновешенную водным раствором 0.1%-ной трифторуксусной кислотой с рН 2.2, и разделяли методом обращенно-фазовой ВЭЖХ на жидкостном хроматографе высокого давления Agilent 1260 (Agilent, США). Связавшиеся с сорбентом компоненты элюировали градиентом концентрации ацетонитрила 0-60% в 0.1%-ной ТФУ, рН 2.2, в течение 60 мин. Скорость элюции — 1.0 мл/мин. Детекцию проводили спектрофотометрически при 210 нм.
2.2. Содержание белка
Определение белка проводили по методу Варбурга и Кристиана с использованием спектрофотометра Jasco V-780 (Jasco, Япония).
2.3. Метод оценки мембранотропной активности
Исследование проводили на мышах F1 C57BL/CBA (самцы массой 18–20 г), содержащихся в стандартных условиях вивария. Мембранотропную активность во фракциях, полученных на каждой стадии очистки, исследовали методом, разработанным ранее для идентификации МГТБ . Метод основан на определении вязкоупругих свойств ткани печени в условиях деформации сдвига после органотипического культивирования. Статическую обработку результатов проводили с использованием критерия Стьюдента.
2.4. Электрофорез в полиакриламидном геле (ПААГ)
Электрофорез по методике Лэммли проводили с использованием пластин ПААГ толщиной 1 мм; 12.5% и 4.0% составляли концентрирующий и разделяющий гели, соответственно. Для определения молекулярной массы использовали набор маркерных белков 2000-250000 Да (BioRad, США). Электрофоретическое разделение проводили при постоянном токе 20-30 мА в течение 1 часа с последующей стандартной фиксацией раствором изопропанол/уксусная кислота и окрашиванием красителем Кумасси R250.
2.5. Масс-спектрометрический анализ
Анализ фракций осуществляли на времяпролетном MALDI-TOF-масс-спектрометре (Bruker Daltonics, Германия), оснащенным азотным лазером (337 нм) с частотой импульса до 20 Гц. Все измерения проводили в линейном и рефлекторном режиме, определяя положительные ионы. Для накопления масс-спектров мощность лазерного излучения устанавливали на уровне минимального порогового значения, достаточного для десорбции-ионизации образца. Внешнюю калибровку проводили с использованием точных значений молекулярных масс известных белков. Образец наносили на три ячейки планшета, для каждой из которых записывали спектр, полученный в результате суммирования 10 серий спектров по 50 импульсов лазера для каждой. Для записи, обработки и анализа масс-спектров использовали программное обеспечение flexControl 2.4 (Build 38) и flexAnalysis 2.4 (Build 11) (Bruker Daltonics, Германия). Точность измерения масс составляла ±2 Да. В качестве матрицы использовали насыщенный раствор α-циано-4-гидроксикоричной кислоты в смеси 70%-ного ацетонитрила и 0.1%-ной трифторуксусной кислоты.
2.6. Определение N-концевой аминокислотной последовательности
Аминокислотную последовательность определяли на автоматическом секвенаторе белков Shimadzu PPSQ‑33A (“Shimadzu”, Япония) по методу Эдмана с использованием программы производителя.
2.7. Триптический гидролиз белка в полиакриламидном геле in situ
Полученные в результате электрофореза в ПААГ белковые полосы вырезали из геля (площадью 3 мм2), промывали 100 мкл 50%-ного метанола и дегидратировали в 400 мкл ацетонитрила. Восстановление дисульфидных связей белка проводили 100 мкл 10 мМ ДТТ с последующим алкилированием тиольных групп 100 мкл 55 мМ йодацетамидом. Затем модифицированный белок подвергали гидролизу в геле, добавляя 20 мкл (1.0 мг/мл) раствора трипсина в 25 мМ бикарбоната аммония и инкубировали в течение ночи при 37ºС. Полученные пептиды экстрагировали из геля добавлением 10 мкл 50%-ного ацетонитрила в 1%-ной трифторуксусной кислоте. После экстаркции 1 мкл супернатанта смешивали на стальной мишени с 0.5 мкл (20 мг/мл) раствором α-циано-4-гидроксикоричной в смеси 70%-ного ацетонитрила и 0.1%-ной трифторуксусной кислоты и подвергали масс-спектрометрическому анализу.
2.8. Идентификация белков по базам данных
Значения молекулярных ионов продуктов гидролиза белкового компонента ПБК-М идентифицировали с помощью программного пакета Mascot. Поиск проводили по данным масс-спектров в базе данных Swiss-Prot и NCBI (Национальный центр США по биотехнологической информации) среди белков всех организмов и, в частности белков, обнаруженных у быка Bos taurus, с указанием типа гидролиза — трипсин.
2.9. Метод лазерного динамического рассеяния света (фотонная корреляционная спектроскопия)
Для определения гидродинамического радиуса частиц ПБК-М, использовали его водный раствор в концентрации 100 мкг/мл. Измерение проводили на анализаторе Photoсor Compact-Z (Photoсor, Россия), оснащенным термостабилизированным AlGaInP диодным лазером с длиной волны λ=637.4 нм и мощностью 30 мВт, со встроенным многоканальным коррелятором «Photoсor-FС», получая корреляционную функцию флуктуаций интенсивности рассеянного света и интегральной интенсивности рассеяния. Обработку корреляционной функции проводили при помощи программного обеспечения DynaLS (Alango Ltd, Израиль) , . Диапазон допустимых измеряемых размеров наночастиц находился в пределах от долей нм до 5–10 мкм. Измерения проводили при величине угла рассеивания в 90º в диапазоне температур от 20ºС до 100ºС. Для определения гидродинамического радиуса частиц при различных рН навески ПБК-М растворяли до конечной концентрации 100 мкг/мл в буферных растворах: 10 мМ глицин-HCl (рН 2.2); 10 мМ ацетат натрия (рН 4.09); 10 мМ Трис-глицин (pH 5.96); 10 мМ, тетраборат натрия (рН 9.05); 10 мМ фосфат натрия (рН 11.95). Все растворы ПБК-М предварительно очищали от пыли фильтрованием через мембраны Durapore (Milipore, США) с диаметром пор 0.45 мкм.
2.10. Измерение дзета-потенциала
Дзета-потенциал белковых частиц ПБК-М измеряли с помощью анализатора Photoсor Compact-Z (Photoсor, Россия) в буферных растворах в диапазоне рН 2-12. В качестве источника света использовали лазер с длиной волны 637.4 нм. Измерения проводили при значении напряжения электрического поля 5 В/см и 20˚С в цилиндрических стеклянных виалах с одноразовыми золотыми электродами. Расстояние между электродами составляло 0.4 см. Рассеянный свет собирали под углом 20º, время накопления автокорреляционной функции допплеровского сигнала составляло 40-80 с. Изоэлектрическую точку (рI) получали расчетным путем после построения графика зависимости значения дзета-потенциала от различных значений рН. pI определяли при рН, где дзета-потенциал равен нулю. Навески ПБК-М предварительно растворяли до конечной концентрации 100 мкг/мл в буферных растворах: 10 мМ глицин-HCl (рН 2.2); 10 мМ ацетат натрия (рН 4.09); 10 мМ Трис-глицин (pH 5.96); 10 мМ, тетраборат натрия (рН 9.05); 10 мМ фосфат натрия (рН 11.95). И очищали от пыли фильтрованием через мембраны Durapore (Milipore, США) с диаметром пор 0.45 мкм.
2.11. Метод кругового дихроизма
Спектры в УФ-области (200-260 нм) регистрировали на КД-спектрометре Jasco 1500 (Jasco, Япония) при 20ºС в кварцевых кюветах с длиной оптического пути 0.1 см. При изучении пространственной организации и конформационной стабильности кювету с раствором ПБК-М (100 мкг/мл) в 10 мМ натрий-фосфатном буферном растворе рН 7.2 предварительно термостатировали при температурах 20, 30, 40, 50, 60, 70, 80, 90, 100ºС в течение 15 минут. Для снятия КД-спектра при различных рН навески ПБК-М растворяли до конечной концентрации 100 мкг/мл в буферных растворах: 10 мМ глицин-HCl (рН 2.2); 10 мМ ацетат натрия (рН 4.09); 10 мМ Трис-глицин (pH 5.96); 10 мМ, тетраборат натрия (рН 9.05). Скорость сканирования составляла 50 нм/мин, шаг 1 нм, накопление каждого шага 2 сек. Итоговый спектр получали по результатам усреднения данных трех сканирований и вычитания спектра базовой линии (контроль) . Содержание элементов вторичной структуры оценивали с помощью программы производителя CD Multivariate SSE (Jasco, Япония).
2.12. Ингибирование ДТТ-индуцированной агрегации БСА и лизоцима
ДТТ-индуцированную агрегацию БСА изучали в воде при 50ºС, а лизоцима в 1 мМ боратном буфере рН 9.0 при 50ºС. Буфер помещали в цилиндрическиую пробирку с внутренним диаметром 6.3 мм и предварительно инкубировали в течение 5 мин при 50ºС. Пробирки закрывали пробками для предотвращения испарения. Процесс агрегации инициировали добавлением 10 мМ ДТТ к раствору БСА и 0.5 мМ ДТТ к раствору лизоцима до конечного объема 0.5 мл. Для изучения влияния ПБК-М на ДТТ-индуцированную агрегацию БСА и лизоцима, добавляли ПБК-М в диапазоне концентраций 0.01-0.15 мкг/мл к раствору БСА и 0.2–1.0 мкг/мл к раствору лизоцима, к предварительно прогретым растворам модельных белков перед внесением ДТТ. Измерения проводили на анализаторе Photoсor Compact-Z (Photoсor, Россия), оснащенным термостабилизированным AlGaInP диодным лазером с длиной волны λ=637.4 нм и мощностью 30 мВт, со встроенным многоканальным коррелятором «Photoсor-FС», получая корреляционную функцию флуктуаций интенсивности рассеянного света и интегральной интенсивности рассеяния. Обработку корреляционной функции проводили при помощи программного обеспечения DynaLS (Alango Ltd, Израиль) , . Диапазон допустимых измеряемых размеров наночастиц находится в пределах от долей нм до 5-10 мкм. Измерения проводили при величине угла рассеивания в 90º.
Влияние ПБК-М на вторичную структуру БСА и лизоцима изучали с помощью КД-спектроскопии в длинноволновой УФ-области (190-260 нм) на КД-спектрометре Jasco 1500 (Jasco, Япония). Образцы готовили как описано выше, после инкубации при 50°С в течение 75 мин измерение проводили в кварцевых кюветах с длиной оптического пути 0,1 см. Спектры снимали от 3-х до 10-ти раз, усредняли и вычитали спектр буфера.
2.13. Модель экспериментального гемаррогического инсульта (ЭГИ) in vivo
Исследования проводили на 20 животных (крысы Wistar, самцы, 2.5 месяца, около 190 г) на модели экспериментального геморрагического инсульта (ЭГИ) in vivo. Было сформировано две группы животных:
1. контрольная группа №1 — крысы с моделью ЭГИ; интраназально вводили физиологический раствор по 20 мкл в каждый носовой проход, ежедневно 1 раз в сутки;
2. опытная группа №2 — крысы с моделью ЭГИ; интраназальное введение раствора ПБК-М (10-12мг белка в 1 мл) по 20 мкл в каждый носовой проход, ежедневно 1 раз в сутки. Интраназальное введение растворов осуществлялось автоматической пипеткой в одно и то же время дня.
Интрацеребральную геморрагию воспроизводили наркотизированным крысам по А.Н. Макаренко . В качестве общей анестезии использовали уретан (1.3 г/кг, внутрибрюшинно). Зубным бором высверливали симметричные отверстия слева и справа в проекции внутренней капсулы (H=4.0 мм, L=3.0 мм, А=1.5 мм от брегмы), потом прокалывали твердую мозговую оболочку с помощью заточенной иглы-канюли и погружали ее с помощью стереотаксического прибора до требуемой глубины (4.0 мм). Затем мандрен-нож выдвигали до упора, который обеспечивается верхним фиксатором, и производили три поворота влево и вправо, подсекая сосуды. Мандрен-нож извлекали, а в иглу-канюлю через 2-3 мин гамильтоновским шприцем вводили аутокровь 0.15 мл в область механической деструкции мозговой ткани у конца инъекционной иглы с деформацией и разрушением подкорковых структур в области ядер таламуса, реже — в подкорковом белом веществе. После операции рану обеззараживали и зашивали, крыс помещали в клетки и наблюдали их состояние и процесс заживления в течение 28 суток. На 7-ые, 14-ые и 28-ые сутки животных выводили из эксперимента (по 5 шт из каждой группы) эфирным наркозом, доставали головной мозг и фиксировали его в растворе формалина. Далее приготавливали гистологические препараты, окраску осуществляли толуидиновым синим и гематоксилин-эозином.
3. Основные результаты
3.1. Выделение и физико-химические свойства ПБК-М
Для выделения ПБК-Мбыла применена методика, ранее разработанная для исследования биорегуляторов данной группы из различных тканей млекопитающих . Осадок белков, полученный после добавления к экстракту ткани мозга сульфата аммония, разделяли хроматографией среднего давления и получали три фракции, из которых далее изучали 1-ую фракцию, поскольку она обладала мембранотропной активностью и содержала белки с молекулярными массами 66000, 55000, 37000, 25000-20000 Да. (Рис. 1). Количество суммарного белка в данной фракции 30,53 мг.
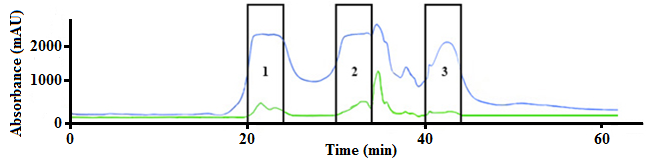
Рисунок 1 - Гельфильтрация осадка мозга крупного рогатого скота на колонке Superdex™ 75 (10×300 мм), детекция – при 210 нм (синяя линия) и 280 нм (зеленая линия)
Примечание: элюция водой, скорость – 0,5 мл/мин
После разделения фракции 1 методом обращённо-фазовой ВЭЖХ были идентифицированы четыре фракции (Рис. 2). Далее изучали фракцию 3Н как наиболее количественно представленную и обладающую мембранотропной активностью. Количество суммарного белка в данной фракции 1.42 мг.
Методом MALDI-TOF-масс-спектрометрии было установлено, что во фракции 3Н содержится полипептиды с молекулярными массами 2180-7755 Да и белок с молекулярной массой 66666.4 ± 2 Да. (Рис. 3). При секвенировании данного белка по методу Эдмана была получена его частичная N-концевая аминокислотная последовательность (15 а.о.): DTHKSEIAHRFKDLG–, которая была идентичная N-концевой аминокислотной последовательности зрелой молекулы бычьего сывороточного альбумина, изоформы которого, как было показано ранее, входят в состав МГТБ .
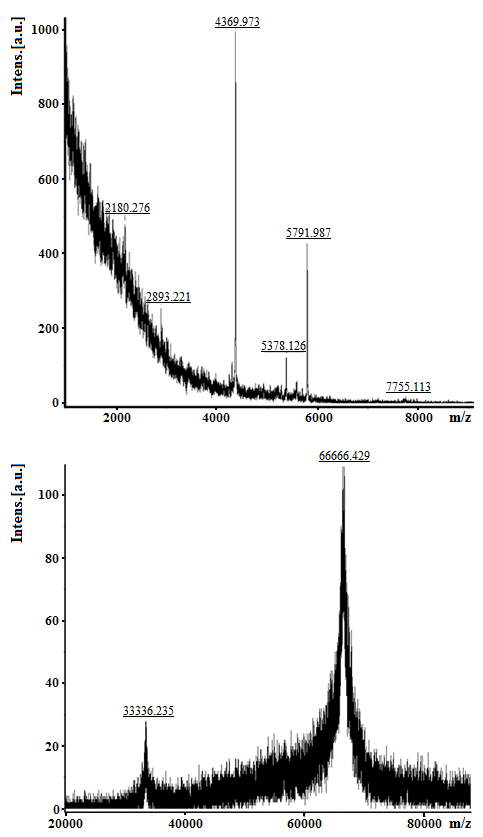
Рисунок 2 - MALDI-TOF-масс-спектр фракции 3Н после разделения методом обращённо-фазовой высокоэффективной жидкостной хроматографии (Рис. 2)
Таким образом, полученные результаты показывают, что фракция 3Н (Рис. 2) содержит в своем составе полипептиды с молекулярными массами 2180-7755 Да и изоформу альбумина под номером giǀ1351907 в базе данных Uniptrot является пептидно-белковым комплексом, выделенным из мозга КРС (ПБК-М).
3.2. Исследование пространственной структуры ПБК-М методами оптической спектроскопии
Изучение пространственной структуры ПБК-М проводили, используя раствор фракции3Н, полученной после обращенно-фазовой хроматографии, в концентрации 100 мкг/мл. С помощью метода динамического лазерного светорассеяния было показано, что в водном растворе ПБК-М присутствуют частицы, усредненное значение гидродинамического радиуса (Rh) которых составляло 156.4±3.2 нм. Полученные данные полностью коррелировали с результатами исследования величины гидродинамического радиуса частиц в водном растворе других биорегуляторов данной группы .
Также методом динамического светорассеяния был получен дзета-потенциал белковых частиц ПБК-М. Измерение дзета-потенциала проводили в диапазоне рН 2-12. Изоэлектрическая точка ПБК-М была определена как рН 4.4, — значение, при котором дзета-потенциал был равен нулю (Рис. 4). Известно, что значение изоэлектрической точки чистого БСА составляет pH 4.8-5.6 , . Таким образом, наличие в комплексе пептидов не только влияет на вторичную структуру аналогичных комплексов, как это было показано ранее , но вносит свой вклад в значение изоэлектрической точки комплекса.
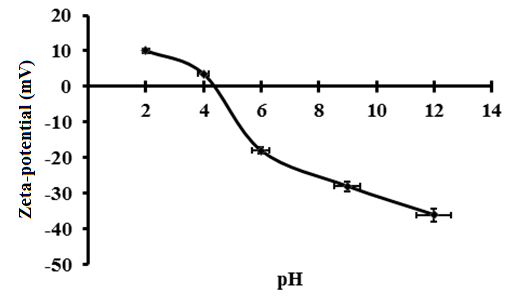
Рисунок 3 - Измерение дзета-потенциала ПБК-М в диапазоне рН 2-12
3.4. Сравнительный анализ пространственной структуры ПБК-М методами оптической спектроскопии
Исследование вторичной структуры ПБК-М производили с помощью метода кругового дихроизма в дальней УФ-области (200–260 нм) (Рис. 5). Его КД-спектр в дальней УФ-области (200–260 нм), характеризуется присутствием выраженного экстремума при 210 нм и сглаженного экстремума при 222 нм (Рис. 8), что идентифицирует молекулярную структуру комплекса с равновесным наличием α-структуры и статистического клубка . Это подтверждается расчетными данными, согласно которым ПБК-М содержит 39.4±0.7% α-спиралей, 11.8±0.2% β-складок, 10.4±0.2% β-изгибов и 38.4±0.7% неупорядоченной структуры.
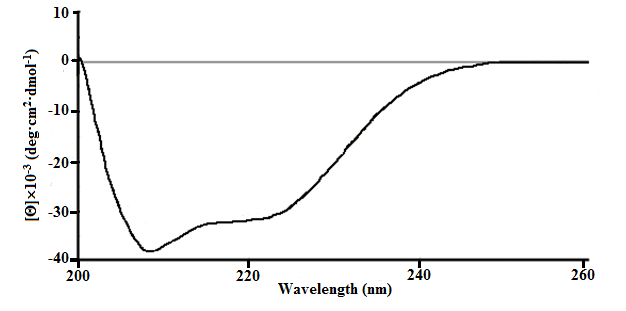
Рисунок 4 - КД-спектры ПБК-М в 10 мМ натрий-фосфатном буферном растворе рН 7.2 в дальней УФ-области
Ранее при исследовании МГТБ, выделенных из различных тканей млекопитающих, было установлено, что после воздействия ряда физико-химических факторов, таких как pH и нагревание, биологическая активность биорегуляторов оставалась неизменной , поэтому далее изучали конформационную структуру ПБК-М из мозга при различных значениях pH и температуры.
При нагревании ПБК-М от 20ºС до 40ºС эллиптичность отрицательных полос в КД-спектрах в области 210–222 нм остается неизменной; конформационные изменения на уровне вторичной структуры начинаются только при температуре 50°С. Повышение температуры раствора ПБК-М до 70ºС приводит к постепенному уменьшению эллиптичности области 210–222 нм (Рис. 6). Таким образом, полученные данные свидетельствуют о том, что до 50ºС конформация изучаемого биорегулятора стабильна на уровне вторичной структуры, при температуре между 50ºС и 70ºС происходит конформационный переход молекулы комплекса, а при 80ºС и выше приобретает денатурированное конформационное состояние.
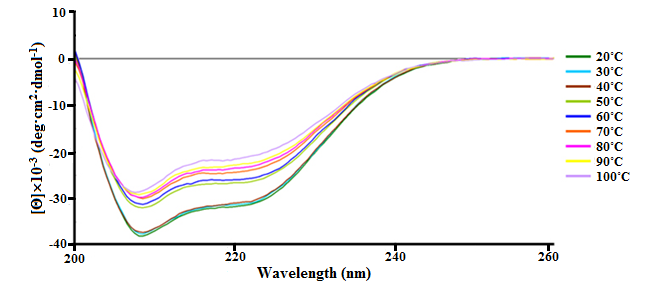
Рисунок 5 - КД-спектры ПБК-М в 10 мМ натрий-фосфатном буферном растворе после термической обработки в дальней УФ-области
Таблица 1 - Содержание элементов вторичной структуры ПБК-М при различных температурах
T, °C | α-спираль, % | β-складчатый слой, % | β-изгиб, % | Неупорядоченная структура, % |
20 | 39.4±0.7 | 11.8±0.2 | 10.4±0.2 | 38.4±0.7 |
30 | 41.9±0.7 | 11.0±0.2 | 9.6±0.1 | 37.5±0.7 |
40 | 44.0±0.8 | 11.1±0.2 | 9.1±0.1 | 35.8±0.6 |
50 | 44.6±0.8 | 13.7±0.2 | 8.2±0.1 | 33.5±0.6 |
60 | 46.6±0.8 | 13.6±0.2 | 7.2±0.1 | 32.6±0.6 |
70 | 45.7±0.8 | 13.7±0.2 | 7.3±0.1 | 33.3±0.6 |
80 | 44.0±0.8 | 14.9±0.3 | 8.1±0.1 | 33.0±0.6 |
90 | 43.4±0.8 | 15.0±0.3 | 8.9±0.1 | 32.7±0.6 |
100 | 42.1±0.8 | 15.3±0.3 | 9.9±0.1 | 32.7±0.6 |
Для оценки термостабильности ПБК-М точка конформационного перехода на уровне вторичной структуры была определена из графика зависимости эллиптичности при 222 нм от температуры. Изменение эллиптичности при данной длине волны используется как мера упорядоченности вторичной структуры белка при изучении его денатурации. Зависимость эллиптичности от температуры показывает ее двухступенчатое сигмоидальное увеличение, с уменьшением содержания α-структуры и увеличения β-структуры (Таблица 1), Эти изменения соответствуют концепции так называемого N-F перехода с последующим гидратационным расширением и разворачиванием молекулы альбумина . При нагревании раствора ПБК-М, наблюдали двухступенчатый термопереход, который указывает на возможность, с одной стороны, изменения упаковки ассоциатов ПБК-М в наноразмерных частицах, а с другой, — последовательного разворачивания конформации ПБК-М с образованием промежуточного состояния при 50–60ºС, которое характеризуется увеличением участков с α-структурой по сравнению с нативным состоянием (Таблица 1). Таким образом, было установлено, что точки температурного перехода для ПБК-М, выделенного из головного мозга КРС, составили 45.5ºС и 65.5ºС (Рис. 7).
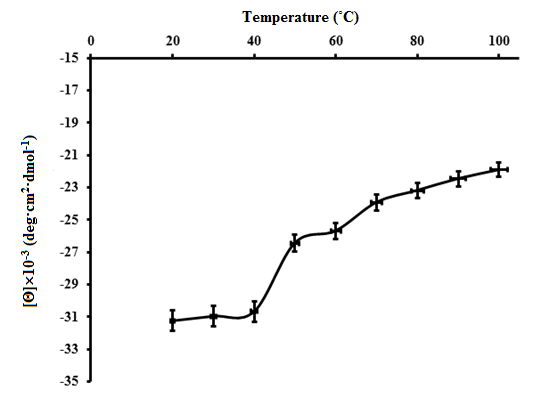
Рисунок 6 - Зависимость эллиптичности ПБК-М от температуры при 222 нм
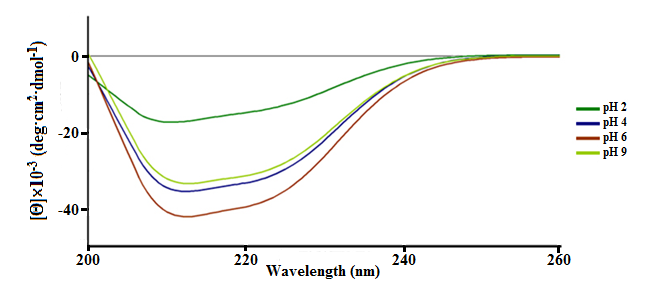
Рисунок 7 - КД-спектры ПБК-М при различных рН среды в дальней УФ-области
Для изучаемого ПБК-М были рассчитаны элементы вторичной структуры в зависимости от величины pH раствора (Таблица 2). При рН 2 вторичная структура ПБК-М отличается от структуры нативного ПБК-М при рН 7 (Таблица 1) большим содержанием β-структуры (в два раза) и меньшим содержанием α-спирали (на 33%). Из данных таблицы 2 следует, что вторичная структура ПБК-М при рН 4, 6 и 9 отличается от нативного ПБК-М при рН 7 (Таблица 1) большим содержанием α-спиралей и β-листов, а содержание неупорядоченной структуры и β-изгибов отличается незначительно.
Таблица 2 - Содержание элементов вторичной структуры ПБК-М при различных pH
pH | α-спираль, % | β-складчатый слой, % | β-изгиб, % | Неупорядоченная структура, % |
2 | 26.2±0.5 | 23.8±0.5 | 11.8±0.2 | 38.2±0.7 |
4 | 41.2±0.7 | 10.8±0.2 | 10.0±0.2 | 38.0±0.7 |
6 | 47.5±0.8 | 6.0±0.1 | 9.5±0.1 | 37.0±0.7 |
9 | 40.9±0.7 | 12.9±0.2 | 10.0±0.2 | 36.2±0.7 |
Ранее было показано, что МГТБ выделенные из различных тканей млекопитающих состоят из пептидов и изоформ альбумина . Можно предположить, что при изучаемых значениях рН происходит образование прочных водородных связей между альбумином и пептидами, вызывающих стабилизацию α-спирали и увеличение ее доли во вторичной структуре молекулы.
Наряду с конформационной стабильностью ПБК-М, была изучена его межмолекулярная ассоциация с помощью метода динамического светорассеяния. Была проанализирована агрегация в интервале температур от 20ºС до 100ºС и под влиянием рН среды. Установлено, что при повышении температуры и при различных значениях рН среды значение гидродинамического радиуса наноразмерных частиц изменялось, но не значительно, оставаясь в диапазоне стандартного отклонения. Полученные данные доказывают, что ПБК-М относится к группе МГТБ, наночастицы которых демонстрируют стабильность при воздействии различных физико-химических факторов, таких как температура, ионная сила и рН раствора, действие органических растворителей, ультразвуковая обработка, многократное замораживание-оттаивание , .
3.5. Воздействие ПБК-М на агрегацию БСА инициированную ДТТ
Одним из фундаментальных направлений современной биологии и биотехнологии является исследование ассоциации и агрегации белков. Широко используемым в качестве модельного белка является БСА. Для изучения влияния ПБК-М на агрегацию БСА in vitro была выбрана модель на основе агрегации БСА при 50ºС в водном растворе 10 мМ ДТТ. Были получены и проанализированы зависимости интенсивности светорассеяния (Рис. 9) и гидродинамического радиуса (Rh) от времени агрегации БСА в присутствии ПБК-М в диапазоне концентраций от 0.01 до 0.15 мкг/мл. (Рис. 10).
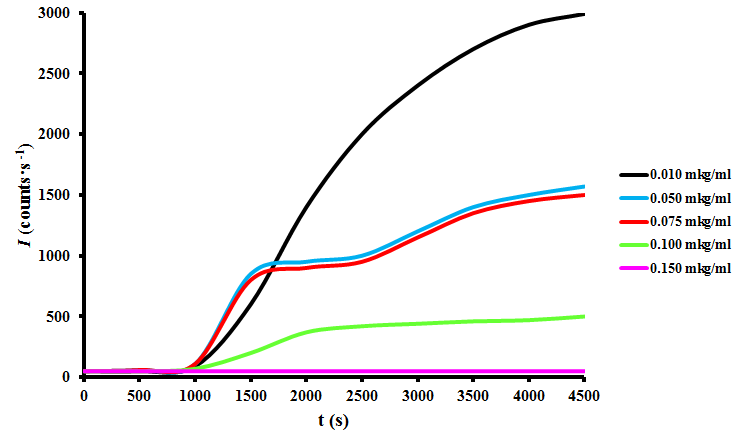
Рисунок 8 - Зависимость интенсивности светорассеяния от времени инкубации БСА, индуцированного ДТТ, с растворами ПБК-М различных концентраций
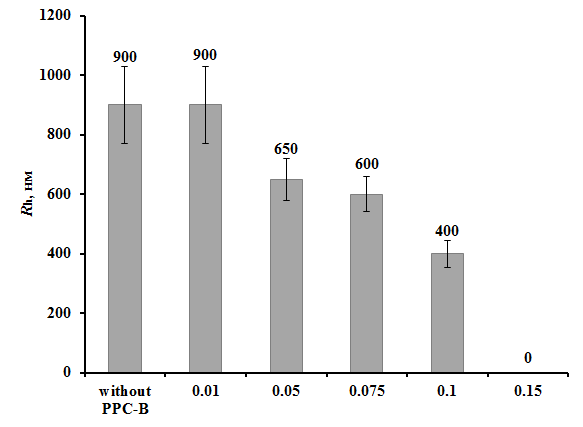
Рисунок 9 - Зависимость гидродинамического радиуса (Rh) БСА (100 мкг/мл) в присутствии 10 мМ ДТТ от концентрации ПБК-М (мг/мл)
Влияние ПБК-М на термическую агрегацию БСА, индуцированную ДТТ, также была изучена методом КД-спектроскопии. На рисунке 11 представлен КД-спектры в УФ-области (200–260 нм) БСА (темно-синяя линия) и БСА с 10 мМ ДТТ (коричневая линия) после нагревания при 50°С в течение 75 мин. После инкубирования раствора без ДТТ КД-спектр БСА характеризуется наличием двух экстремумов при 208 и 222 нм (Рис. 11, темно-синяя линия) и является характерным КД-спектром для α-белков в нативном состоянии . После нагревания в присутствии ДТТ КД-спектр БСА характеризуется наличием одного экстремума при 228 нм и незначительным максимумом при 216 нм (Рис. 11, коричневая линия), что характерно для β-структурированных белков и подтверждается расчетами элементов вторичной структуры агрегированной и неагрегированной молекулы БСА (Таблица 3). Добавление к раствору БСА с 10 мМ ДТТ – 0.01 мкг/мл ПБК-М оказывает незначительное влияние на вторичную структуру агрегированной молекулы БСА, а именно на КД-спектре можно отметить два слабовыраженных минимума в районе 206 и 222нм (Рис. 11, голубая линия). Увеличение концентрации ПБК-М до 0.05 мкг/мл (Рис. 11, синяя линия), а тем более до 0.075 мкг/мл (Рис. 11, салатовая линия) приводит к росту эллиптичности и формированию более ярко выраженных экстремумов при 206 нм. В КД-спектре БСА в присутствии 0.1 мкг/мл ПБК-М (Рис. 11, оранжевая линия) помимо экстремума при 206 нм появляется экстремум при 222 нм, эллиптичность которого увеличивается при увеличении концентрации ПБК-М до 0.15 мкг/мл (Рис. 11, зеленая линия). Увеличение концентрации также приводит к смещению экстремума от 206 нм до 208 нм, что соответствует КД-спектру нативной молекулы БСА, при этом эллиптичноть полностью не восстанавливается, свидетельствуя о частичном разворачивании α-спиральной структуры на начальной стадии белковой денатурации. Эти спектры представляют переходное состояние между доминирующей α-спиралью и полностью развернутой конформацией белковой молекулы. Данное предположение подтверждают расчеты элементов вторичной структуры (Таблица 3).
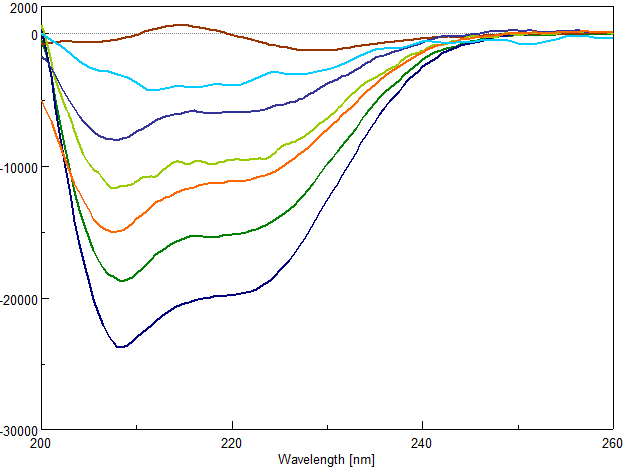
Рисунок 10 - Влияние ПБК-М на вторичную структуру БСА:
КД-спектр БСА (100 мкг/мл) (темно-синяя линия), инкубированного с 10 мМ ДТТ (коричневая линия), с 0.01 мкг/мл ПБК-М и 10 мМ ДТТ (голубая линия), с 0.05 мкг/мл ПБК-М и 10 мМ ДТТ (синяя линия), с 0.075 мкг/мл ПБК-М и 10 мМ ДТТ (салатовая линия), 0.1 мкг/мл ПБК-М и 10 мМ ДТТ (оранжевая линия), 0.15 мкг/мл ПБК-М и 10 мМ ДТТ (зеленая линия)
Таблица 3 - Содержание элементов вторичной структуры раствора БСА, инкубированного с/без добавления ПБК-М и 10 мМ ДТТ при 50°C в течение 75 минут
Образец | α-спираль, % | β-листы, % | β-изгиб, % | Статический клубок, % |
БСА | 49.2±0.5 | 9.3±0.1 | 11.1±0.2 | 30.4±0.6 |
БСА+ДТТ | 19.0±0.2 | 30.0±0.5 | 12.7±0.2 | 38.3±0.6 |
БСА+ДТТ+ 0.01 мкг/мл ПБК-М | 19.4±0.2 | 31.0±0.4 | 12.2±0.2 | 37.4±0.4 |
БСА+ДТТ+ 0.05 мкг/мл ПБК-М | 28.0±0.3 | 24.1±0.6 | 12.3±0.2 | 35.6±0.5 |
БСА+ДТТ+ 0.075 мкг/мл ПБК-М | 37.0±0.3 | 18.4±0.5 | 11.9±0.2 | 32.7±0.6 |
БСА+ДТТ+ 0.1 мкг/мл ПБК-М | 36.6±0.4 | 14.9±0.5 | 12.0±0.2 | 36.5±0.6 |
БСА+ДТТ+ 0.15 мкг/мл ПБК-М | 45.1±0.6 | 14.7±0.2 | 12.5±0.2 | 27.7±0.5 |
Таким образом, нами было показано, что ПБК-М проявляет свойства шаперона — ингибитора ДТТ-индуцированной агрегации БСА. Для более подробного изучения действия биорегулятора в качестве ингибитора агрегации был использован другой модельный белок — лизоцим.
3.5. Воздействие ПБК-М на агрегацию лизоцима, инициированную ДТТ
Большое количество информации, полученное при ингибировании агрегации лизоцима в различных условиях in vitro, делает его идеальным модельным белком для исследования механизмов агрегации и фибриллообразования , а также для испытания новых фармакологических препаратов для борьбы с амилоидозами . При изучении влияния рН и температуры на фибриллогенез лизоцима было показано, что для образования фибрилл лизоцима человека и куриного яйца необходимо повышение температуры до 55–65ºC и снижение рН до 2.0–2.5 . Однако в данном исследовании оптимальная агрегация лизоцима была нами достигнута в концентрации 100 мкг/мл белка при 0.5 мМ ДТТ в боратном буфере рН 9.0 при 50ºС в течение 75 мин. При инкубации лизоцима в данных условиях образуются мономодальные частицы с размером 56.0±15.9 нм.
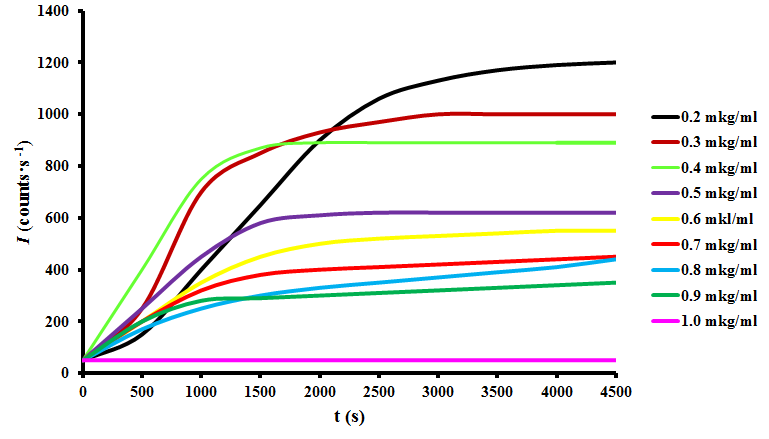
Рисунок 11 - Зависимость интенсивности светорассеяния от времени инкубации куриного лизоцима, индуцированного ДТТ, с растворами ПБК-М различных концентраций
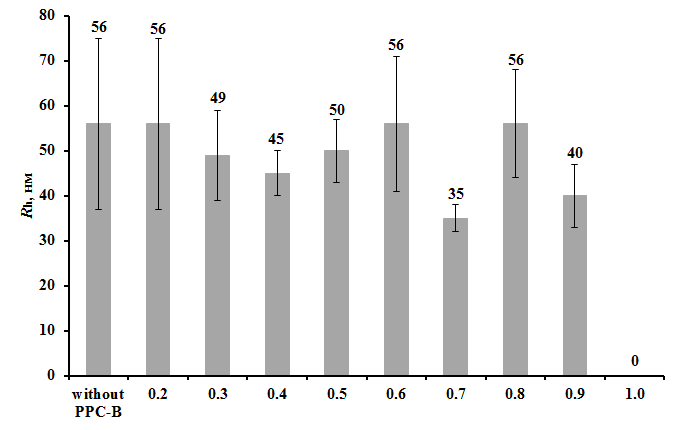
Рисунок 12 - Зависимость гидродинамического радиуса (Rh) лизоцима (100 мкг/мл) в присутствии 0.5 мМ ДТТ от концентрации ПБК-М (мг/мл)
Также влияние ПБК-М на тепловую агрегацию лизоцима, индуцированную ДТТ, было изучено методом КД-спектроскопии. Исследовали изменения вторичной структуры лизоцима в отсутствии или в присутствии ПБК-М. Спектр лизоцима после инкубации в боратном буфере рН 9.0 при 50°С в течение 75 мин характеризуется наличием отрицательных экстремумов в области 208–222 нм и максимума в области 190–195 нм (Рис. 14 голубая линия).
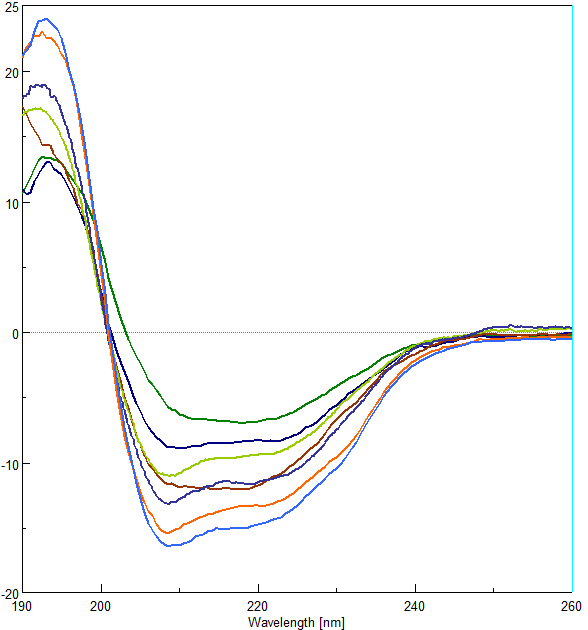
Рисунок 13 - Влияние ПБК-М на вторичную структуру лизоцима:
КД-спектр лизоцима (100 мкг/мл) (голубая линия), инкубированного с 0.5 мМ ДТТ (темно-зеленая линия), с 0.2 мкг/мл ПБК-М и 0.5 мМ ДТТ (темно-синяя линия), с 0.4 мкг/мл ПБК-М и 0.5 мМ ДТТ (салатовая линия), с 0.6 мкг/мл ПБК-М и 0.5 мМ ДТТ (коричневая линия), с 0.8 мкг/мл ПБК-М и 0.5 мМ ДТТ (синяя линия), с 1.0 мкг/мл ПБК-М и 0.5 мМ ДТТ (оранжевая линия)
Нагревание лизоцима в присутствии 0.5 мМ ДТТ в боратном буфере рН 9.0 приводит к уменьшению в полтора раза показателей отрицательной эллиптичности в области 208-222 нм и в два раза – в области 190-195 нм (Рис. 14 зеленая линия). В КД-спектре проинкубированного лизоцима с 0.5 мМ ДТТ в присутствии 0.2 мкг/мл ПБК-М в боратном буфере рН 9.0 (Рис. 14 темносиняя линия) наблюдаются незначительные изменения во вторичной структуре, вызванные действием ПБК-М. Увеличение концентрации ПБК-М до 0.4 мкг/мл приводит к росту эллиптичности при 208 и 222нм (Рис. 14 салатовая линия). В КД-спектре проинкубированного лизоцима с 0.5 мМ ДТТ в присутствии 0.6 мкг/мл ПБК-М в боратном буфере рН 9.0 наблюдается сглаживание структуры спектра в области 208-222 нм и смещению экстреммума от 222 до 218 нм (Рис. 14 коричневая линия). Но, увеличение концентрации ПБК-М до 0,8, а тем более до 1 мкг/мл приводит к восстановлению ярко выраженных экстремумов при 208 и 222нм и увеличению эллиптичности. Расчеты элементов вторичной структуры (Таблица 4) показывают, что ни создание ДТТ-инициированного агрегирования лизоцима, ни ингибирование агрегации лизоцима с помощью ПБК-М, не приводит к каким-либо существенным изменениям в содержание элементов вторичной структуры молекулы лизоцима.
Таблица 4 - Содержание элементов вторичной структуры раствора лизоцима, инкубированного с/без ПБК-М и 0,5 мМ ДТТ в боратном буфере рН 9,0 при 50°C в течение 75 минут
Образец | α-спираль. % | β-листы. % | β-изгиб. % | Статический клубок. % |
лизоцим | 19.1±0.2 | 32.3±0.5 | 12.1±0.3 | 36.5±0.5 |
лизоцим+ДТТ | 14.9±0.4 | 33.7±0.6 | 13.9±0.2 | 37.5±0.6 |
лизоцим+ДТТ+ 0.2 мкг/мл ПБК-М | 16.0±0.2 | 34.0±0.4 | 13.6±0.2 | 36.4±0.4 |
лизоцим+ДТТ+ 0.4 мкг/мл ПБК-М | 16.2±0.4 | 33.6±0.6 | 13.3±0.2 | 36.9±0.6 |
лизоцим+ДТТ+ 0.6 мкг/мл ПБК-М | 16.7±0.4 | 35.7±0.6 | 11.5±0.2 | 36.1±0.6 |
лизоцим+ДТТ+ 0.8 мкг/мл ПБК-М | 17.1±0.4 | 34.0±0.6 | 12.9±0.2 | 36.0±0.6 |
лизоцим+ДТТ+ 1.0 мкг/мл ПБК-М | 18.0±0.2 | 33.2±0.4 | 13.2±0.2 | 35.6±0.4 |
Таким образом, ПБК-М сохраняет нативную структуру модельных белков и предотвращает их ассоциацию при термической ДТТ-индуцированной агрегации. Можно предположить, что обладая свойствами ингибитора агрегации белков, ПБК-М может участвовать в восстановлении в травмированных и патологически измененных тканях в качестве шаперонов.
3.6. Влияние ПБК-М из ткани головного мозга быка на процессы восстановления в головном мозге у крыс
Влияние ПБК-М на процессы восстановления в головном мозге исследовали на модели экспериментального геморрагического инсульта (ЭГИ) у крыс in vivo.
Геморрагический инсульт сопровождается генерализованным повышением тонуса сосудов мозга и как следствие — значительным снижением уровня кровоснабжения мозга. При инсульте в области кровоизлияния повреждаются нервные и глиальные клетки, а если кровоизлияние произошло в области желудочков мозга, то повреждаются дополнительно клетки эпендимы желудочков, а также сосудистые сплетения (СС). CC — специфические структуры, которые участвуют в производстве цереброспинальной жидкости (ликвор), являются важным компонентом системы биологических барьеров, разделяющих различные компартменты мозга . Они состоят из ядра, выполненного капиллярами и рыхлой соединительной ткани, и окруженного слоем эпителиальных клеток, связанных с эпендимальным слоем клеток, выстилающим желудочки мозга . Вокруг каждого капилляра в СС формируется множество ворсинок, которые вместе с щеточной каймой микроворсинок (ресничками) на поверхности эпителиальных клеток увеличивают площадь поверхности СС, через которые плазма крови фильтруется в ликвор. В настоящее время рассматривается роль ликвора не только в обеспечении клеток питательными веществами и транспорте метаболитов, но и в поддержании пролиферации нервных стволовых клеток и направленной миграции нейробластов . В этом аспекте очень важна роль микроворсинок эпителиальных клеток СС в продукции и движении ликвора, и соответственно, — в регенерации нервной ткани.
В литературе описано, что под эпендимальными клетками в субвентрикулярной зоне расположена ниша стволовых клеток, которая образована различными типами клеток, включающих в себя астроциты, сами эпендимальные клетки, нейробласты и клетки-предшественники. Эпендимальные клетки обеспечивают трофическую и, возможно, метаболическую поддержку клеток-предшественников . Следует отметить, что в области ниши стволовых клеток представлены СС.
Предполагается, что дедифференцировка реснитчатых клеток эпендимы (например, при церебральной ишемии) может способствовать образованию новых мультипотентных субэпендимальных стволовых клеток, способных генерировать нейроны. Эти предположения привели к исследованию эпендимы как модулятора популяции стволовых клеток .
Многие неврологические заболевания приводят к дисфункции гематоэнцефалического барьера, в том числе, инсульты . При геморрагическом инсульте (ГИ) в области кровоизлияния все процессы, определяющие работу гематоликворного барьера, нарушаются: изменяется кровоток в СС, возникает перемещение СС в областях, близких к желудочковой системе, происходит массовая гибель нейронов .
Есть доказательства СС-индуцированной нейропротекции за счет экспрессии факторов роста, например, экспрессия VEGF при ряде нейропатологий, в том числе, при инсультах и черепно-мозговой травме .
На 7 сутки после операции в контрольной группе не происходило полного восстановления клеток эпендимы по краю раны (показано стрелками), что предполагает нарушение ниши стволовых нейральных клеток, которая находится под клетками эпендимы (обычно в субвентрикулярной зоне) . В области раны видны остатки крови, которую вводили во время операции. В сосудистых сплетениях отмечено присутствие большого количества клеток крови, что указывает на продолжение воспалительного процесса (Рис. 15).
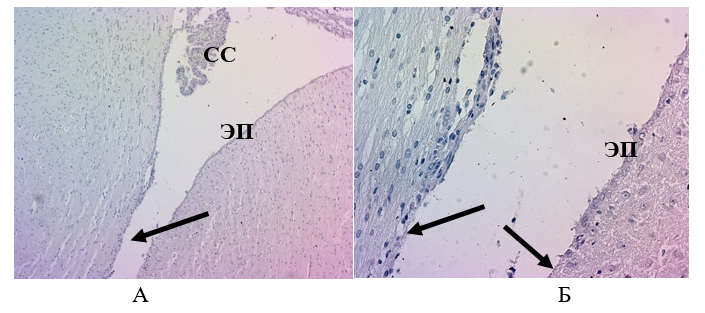
Рисунок 14 - Ткань мозга крысы из контрольной группы через 7 суток:
А – Ув.´100; Б – Ув.´400
Примечание: окраска гематоксилином-эозином; СС – сосудистые сплетения; ЭП – клетки эпендимы; стрелками показано нарушение клеток эпендимы в области повреждения
Через 14 дней после операции у животных из контрольной группы видны клетки крови в раневом канале. Выстилка клеток эпендимы по краям раны неполная. Отмечается продолжение воспалительного процесса (Рис. 17).
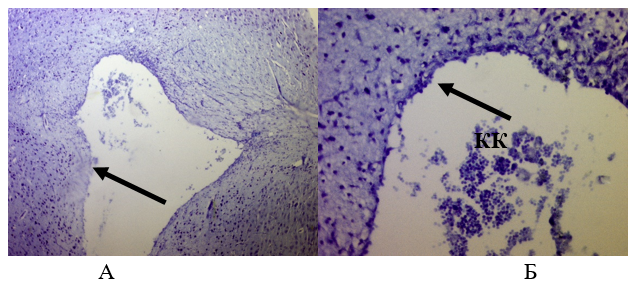
Рисунок 15 - Ткань мозга крысы из контрольной группы через 14 суток:
А – Ув.´100; Б – Ув.´400
Примечание: окраска толуидиновым синим; стрелками показано отсутствие клеток эпендимы по краю раны; КК – клетки крови
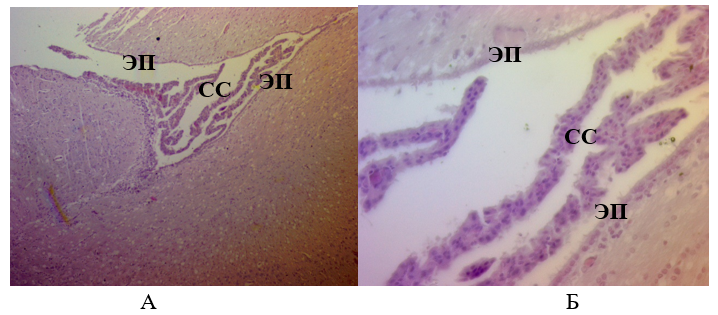
Рисунок 16 - Ткань мозга крысы из опытной группы через 14 суток:
А – Ув.´100; Б – Ув.´400
Примечание: окраска гематоксилином эозином; СС – сосудистые сплетения; ЭП – эпендимальные клетки
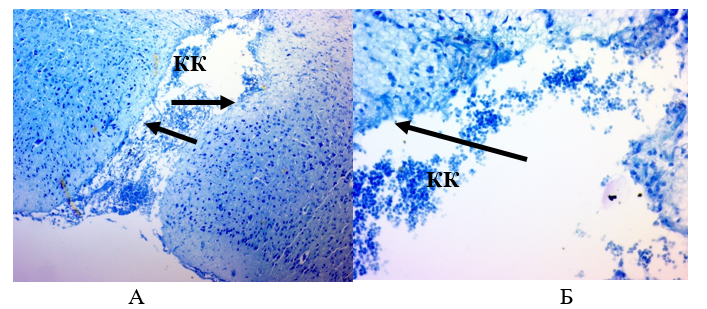
Рисунок 17 - Ткань мозга крысы из контрольной группы через 28 суток:
А – Ув.´100; Б – Ув.´400
Примечание: окраска толуидиновым синим; КК – клетки крови; стрелками показано отсутствие клеток эпендимы
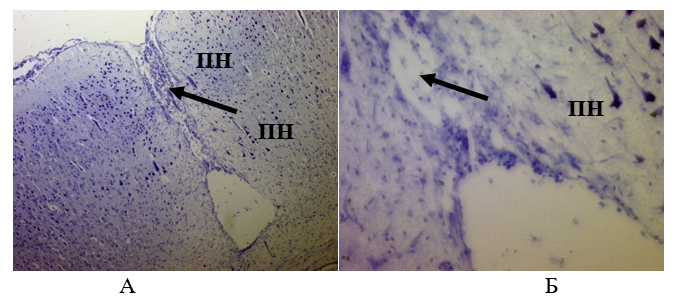
Рисунок 18 - Ткань мозга крысы из опытной группы через 28 суток:
А – Ув.´100; Б – Ув.´400
Примечание: ПН – пирамидальные нейроны; стрелкой указано зарастание раневого канала; окраска толуидиновым синим
4. Заключение
В ткани головного мозга быка присутствует ранее не изученный биорегулятор, основу которого составляет ПБК-М, содержащий полипептиды с молекулярными массами 2180-7715 Да и изоформу сывороточного альбумина B. taurus, под номером giǀ1351907 в базе данных Uniptrot. Пространственная структура ПБК-М характеризуется наличием α-спирализованной вторичной структуры с двумя точками конформационного термоперехода в 45.5 и 65.5ºС. Установлено, что ПБК-М в водных растворах образует термо- и рН-стабильные наноразмерные частицы. Это предполагает, что альбумин, входящий в состав комплекса образует биологически активные наноразмерные частицы, в то время как взаимодействующие с альбумином пептиды стабилизируют конформацию его молекулы, сохраняя способность к формированию подвижных ассоциатов. Данное свойство характерно для молекулярных шаперонов, так как лабильность шаперонных олигомеров важна для идентификации и связывания субстратов. Результаты исследования показывают, что ПБК-М проявляет шапероноподобные свойства — ингибитора ДТТ-индуцированной агрегации БСА и лизоцима куриного яйца. Следует отметить, что определенные константы полумаксимального ингибирования IC50 для агрегации БСА в 7 раз меньше IC50 для агрегации лизоцима. Объясняется это тем, что стабилизация трехмерной структуры БСА достигается быстрее за счет сродства со структурой альбумина, входящего в состав ПБК-М, в результате взаимодействия с гидрофобными участками на поверхности развернутых молекул БСА. Так как механизм действия молекулярных шаперонов основан на их взаимодействии с гидрофобными участками ненативных белков и тем самым препятствует связыванию этих белков между собой, сохраняя их фолдинг-компетентное состояние . Можно предположить, что при нормальных условиях субстрат-связывающие участки ПБК-М спрятаны внутрь мультимера, а повышение температуры вызывает смещение равновесия конформации молекулы комплекса, увеличивая доступность гидрофобных участков комплекса-шаперона и связывание с субстратом, в результате чего изучаемый ПБК-М ингибирует субъединичный обмен между олигомерами агрегирующего белка, проявляя шапероноподобные свойства.
Исходя из динамики восстановления раневого канала на протяжении четырех недель после ЭГИ, можно сделать вывод об эффективном воздействии ПБК-М на восстановление нервной ткани, которое выражается в образовании клеток нейроэпителия (эпендимных клеток), а также СС. Эти процессы регенерации, отмеченные на клеточном уровне, должны способствовать полному восстановлению структуры и функции нервной ткани в области ГИ. Таким образом, можно заключить, что исследуемый ПБК-М может иметь клинический потенциал и перспективны для его использования в качестве средств для терапии при инсульте у человека.
Соблюдение этических стандартов
Исследования проведены в соответствии с нормами и принципами Директивы Совета ЕС по вопросам защиты позвоночных животных, используемых для экспериментальных и других научных целей.
