PATHOMORPHOLOGICAL CHANGES IN LIVER TISSUE OF PATIENTS DECEASED FROM HIV INFECTION
PATHOMORPHOLOGICAL CHANGES IN LIVER TISSUE OF PATIENTS DECEASED FROM HIV INFECTION
Abstract
HIV infection (AIDS) is a common cause of death at a young age, but the mechanisms of pathogenesis are not entirely understood. At the present stage, comprehensive data on viral damage to cellular targets is limited, which hinders the development of targeted therapy. The aim of the study was to examine the pathomorphological traits of changes in liver tissue in patients who died from HIV infection. A pathomorphological analysis of specimens from 44 patients deceased as a result of HIV infection between 2014 and 2024, who had concomitant diseases, including hepatitis C, identified numerous destructive changes in liver tissue, which were compared with data presented in 17 foreign literature sources on this issue. Analysis of our own and literature data made it possible to expand the understanding of the pathogenetic mechanisms of morphological changes in the body of HIV-infected patients with hepatitis C. It has been established that the pathogenesis of AIDS and its progression are associated with a violation of haemoglobin metabolism in erythrocytes, which, when destroyed, enters the lumen of the blood vessels of the liver. Free haemoglobin is unable to participate in cellular respiration, leading to hypoxia of the structural elements of the liver. The inability of cells to utilise free oxygen leads to increased hypoxia, followed by anoxia and intoxication as a result of massive haemoglobin breakdown and the emergence of transferrin in the plasma, which is captured by macrophages. Haemoglobin released from erythrocytes enters the vascular bed, leading to cell death as a result of toxic effects on liver tissue cells, and the resulting ischaemia impairs oxygen supply to all structures. The resulting products of haemoglobin breakdown, including iron, bilirubin and porphyrin, contribute to the development of jaundice or acute porphyria, accompanied by a cascade of hepatocyte death, manifested by the development of cirrhosis or cancer. Thus, one of the pathogenetic links in AIDS, along with the known disruption of Th lymphocyte pool differentiation, is erythrocytes.
1. Введение
Известно, что ВИЧ-ассоциированный СПИД является одной из частых причин летальности в молодом возрасте. Коинфекция вируса гепатита С (ВГС) с вирусом иммунодефицита человека (ВИЧ) растёт из-за схожих путей передачи, при этом хроническая инфекция ВГС является наиболее частым осложнением среди ВИЧ инфицированных
, . Многие авторы считают гепатит С на фоне ВИЧ-инфекции и хронические гепатиты провоцирующим фактором для поражения структур печени и развития в последующем цирроза . Kaspar M.B., Sterling R.K. (2016) считают, что в связи с применением антивирусных препаратов развивается гемолиз и повышается билирубинемия , причем авторы исследовали результаты лечения ВИЧ на фоне гепатита С у 344 инфицированных пациентов и выявили значительное увеличение гипербилирубинемии после начала применения препаратов. В целом, по данным многих авторов, эффективность стандартного противовирусного лечения не превышает 50-80%. Однако, несмотря на появление значительного количества лекарственных препаратов для лечения ВИЧ-инфекции, вопросы патогенеза ВИЧ-инфекции полностью не раскрыты и патогенетически обоснованное лечение на современном этапе не является достаточным . Контроль и прогнозирование ВИЧ на основе современной стратегии лечения обеспечили возможность реального увеличения медианы выживаемости пациентов, однако агрессивное лечение сопровождают новые проблемы. Среди ВИЧ инфицированных пациентов увеличилось количество заболевших раком . Патоморфологический анализ аутопсийного материала погибших больных с подтверждённым диагнозом ВИЧ-инфекции не даёт полного ответа на вопросы патогенетических процессов, ведущих к смертельному исходу . Развивающаяся стойкая анемия характерна для большинства больных СПИД на фоне гепатита С, которая еще более усугубляется из-за приёма токсических антиретровирусных препаратов , . Исчерпывающее патофизиологическое обоснование анемии на современном этапе отсутствует, как и понимание механизмов снижения гемоглобина в крови больных гепатитом С и ВИЧ инфицированных. Поддерживается концепция многофакторной природы анемии , , . Отсутствием правильных представлений о патогенезе СПИД можно объяснить неудачи в попытках эмпирического использования эритропоэтина в лечебных целях для пациентов с гепатитом С и ВИЧ инфицированных , , .Актуальность изучения патоморфологических проявлений ВИЧ-инфекции на фоне гепатита С связана с необходимостью решения вопросов своевременной диагностики и стратегии патогенетически обоснованного лечения, с прогнозированием исходов и выполнения реабилитации с профилактикой раннего присоединения оппортунистических инфекций, поражающих различные органы и системы больных
, . Для полного представления о механизмах патогенеза при развитии ВИЧ/СПИД-инфекции необходимы более глубокие патоморфологические исследования, оценка и анализ появления новых данных о морфологических особенностях диагностируемого материала.Цель исследования: изучение патоморфологических особенностей изменений в тканях печени у умерших от ВИЧ-инфекции больных.
2. Методы и принципы исследования
В работе использованы материалы аутопсии инфицированных ВИЧ 9 детей в возрасте от 4-х месяцев до 12 лет и 35 взрослых больных от 30 до 38 лет, умерших от СПИД, осложнённого присоединившимися оппортунистическими инфекциями. Пациенты с ВИЧ-инфекцией и сопутствующим гепатитом С составили группу 15 человек, и 13 человек вошли в группу пациентов с гепатитом С. Данные получены с разрешения этического комитета ФГАОУ ВО «Дальневосточный федеральный университет» с использованием положений Хельсинской декларации (2013). Группу контроля составил аутопсийный материал 17 пациентов мужского пола, погибших в результате травм, несовместимых с жизнью в возрасте от 3 мес. до 38 лет (табл. 1).
Таблица 1 - Распределение аутопсийного материала ВИЧ-инфицированных пациентов
№ п/п | Возрастные группы (мужской пол) | Контроль (мужской пол) | Патология | Материал | ||
Печень, почки, легкие | ||||||
Гепатит С | Гепатит С + ВИЧ инфекция | ВИЧ инфекция | ||||
1 | 3 мес. – 12 лет | 3 |
| 3 | 6 | 9 |
2 | 30-33 года | 3 | 7 | 4 | 3 | 14 |
3 | 34-35 лет | 3 | 3 | 3 | 3 | 9 |
4 | 36-38 лет | 8 | 3 | 5 | 4 | 12 |
ИТОГО | 17 | 13 | 15 | 16 | 44 | |
Примечание: в таблице указаны абсолютные числа; составлена авторами по результатам данного исследования
Фиксация материала проводилась в 10% формалине, затем после удаления фиксатора и промывки биоптатов, осуществляли заливку в смесь ксилола и парафина с нарастающим преобладанием парафина. Окончательная заливка проведена в чистую порцию парафина, из застывшего блока изготовлены срезы с последующим депарафинированием в нескольких порциях ксилола. Окрашивание гистологических срезов биоптатов печени выполнили с помощью классического протокола для использования гематоксилина и эозина. Анализ материала для получения оценки патоморфологической характеристики особенностей вирусного повреждения структурных элементов органов выполнен на микроскопе Olympus – Bx82, оснащённым цифровой камерой CDх82 с фирменным IT- программным обеспечением при увеличении х200, х400.
3. Результаты исследования и их обсуждение
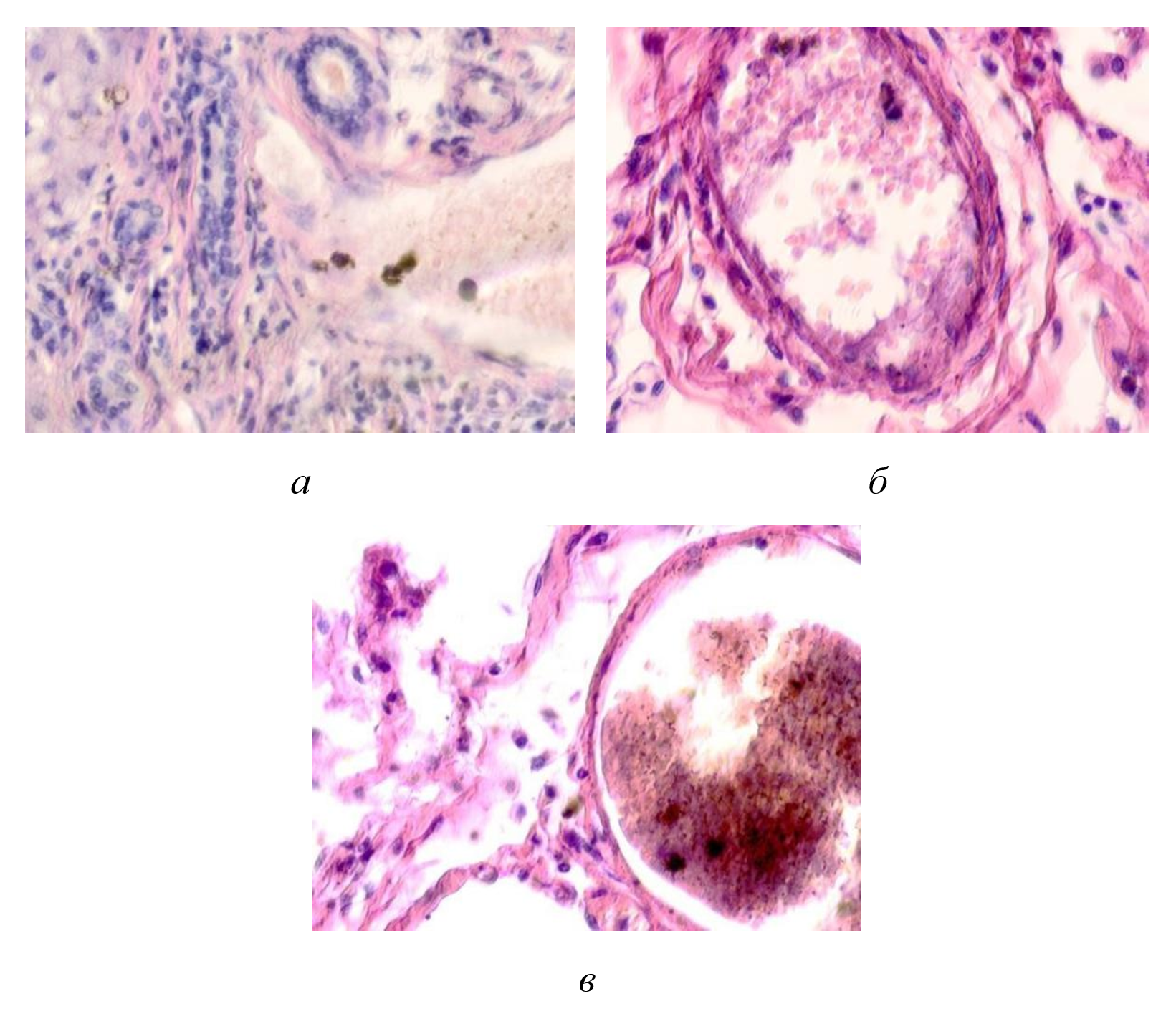
Рисунок 1 - Паренхимные структуры печени человека у ВИЧ инфицированных пациентов:
а - макрофагальные клетки с внедрением в цитоплазму пигмента в проеме сосуда; б - пигмент в цитоплазме макрофагальных клеток и диффузно расположенный в проеме сосуда; в - пигмент в проеме сосуда
Примечание: окраска гематоксилином и эозином; микрофото; ув. х 200; составлен авторами по результатам данного исследования
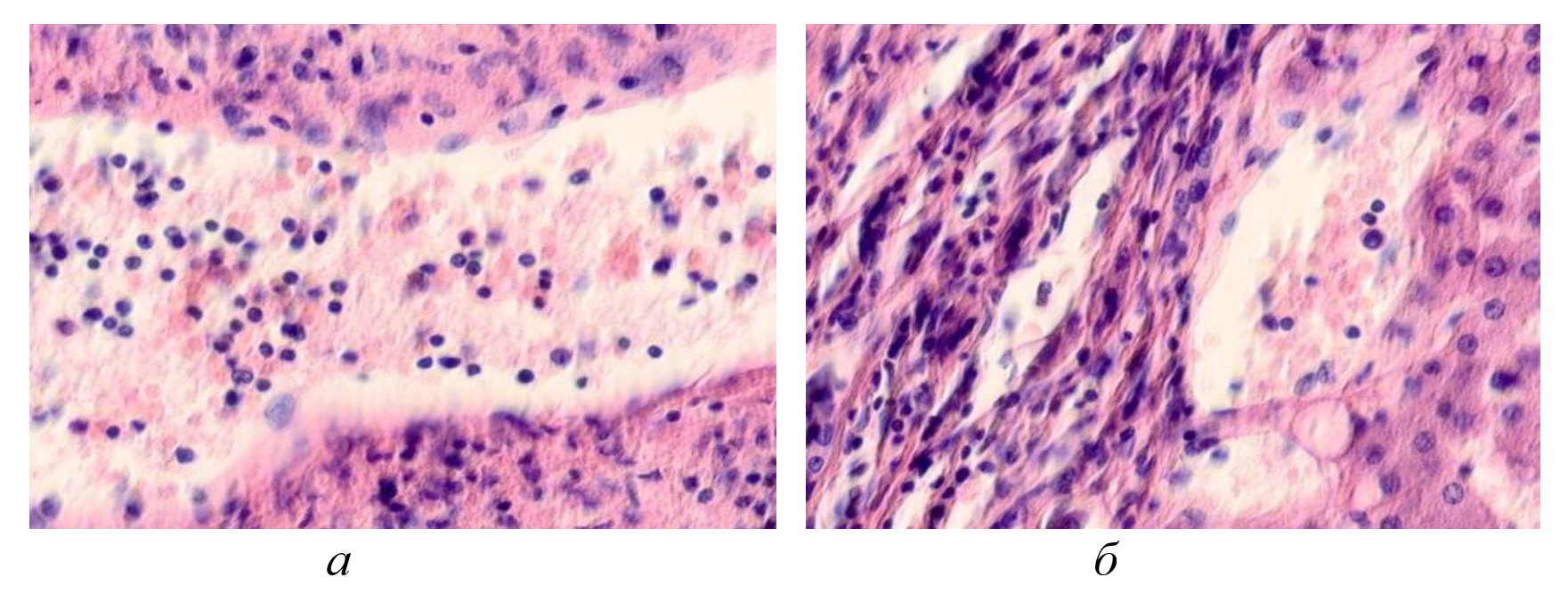
Рисунок 2 - Паренхимная структура печени у ВИЧ инфицированных пациентов на фоне гепатита С, псевдодолька печени:
а, б - лейкоциты в проеме выносящего сосуда
Примечание: окраска гематоксилином и эозином; микрофото; ув. х 200; составлен авторами по результатам данного исследования
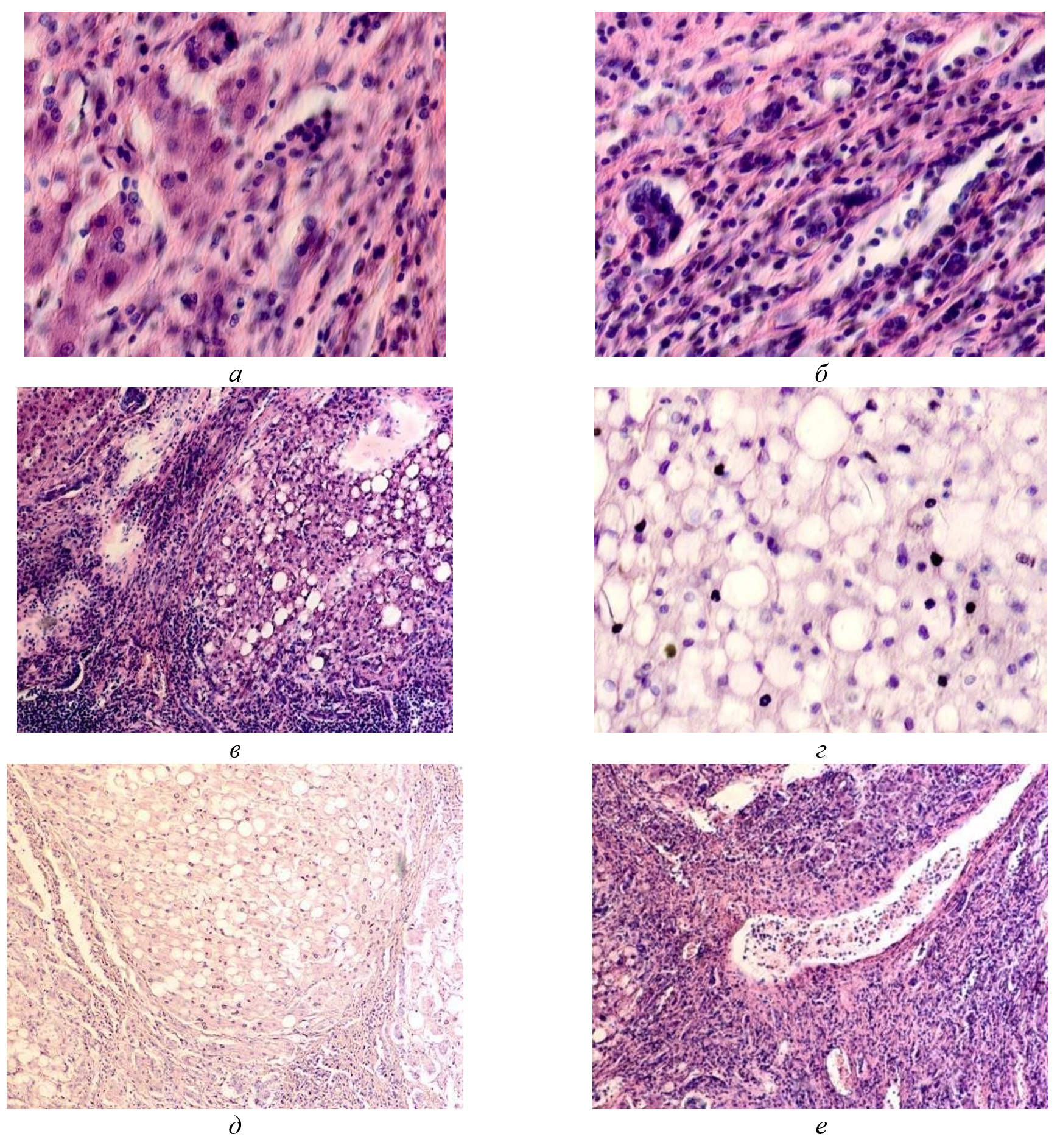
Рисунок 3 - Паренхимная структура печени больных с гепатитом С у ВИЧ инфицированных пациентов, псевдодолька печени:
а, б - лейкоцитарная диффузия междольковых структур; в, г - жировой гепатоз; д, е - цирроз
Примечание: окраска гематоксилином и эозином; микрофото; ув. х 200; составлен авторами по результатам данного исследования
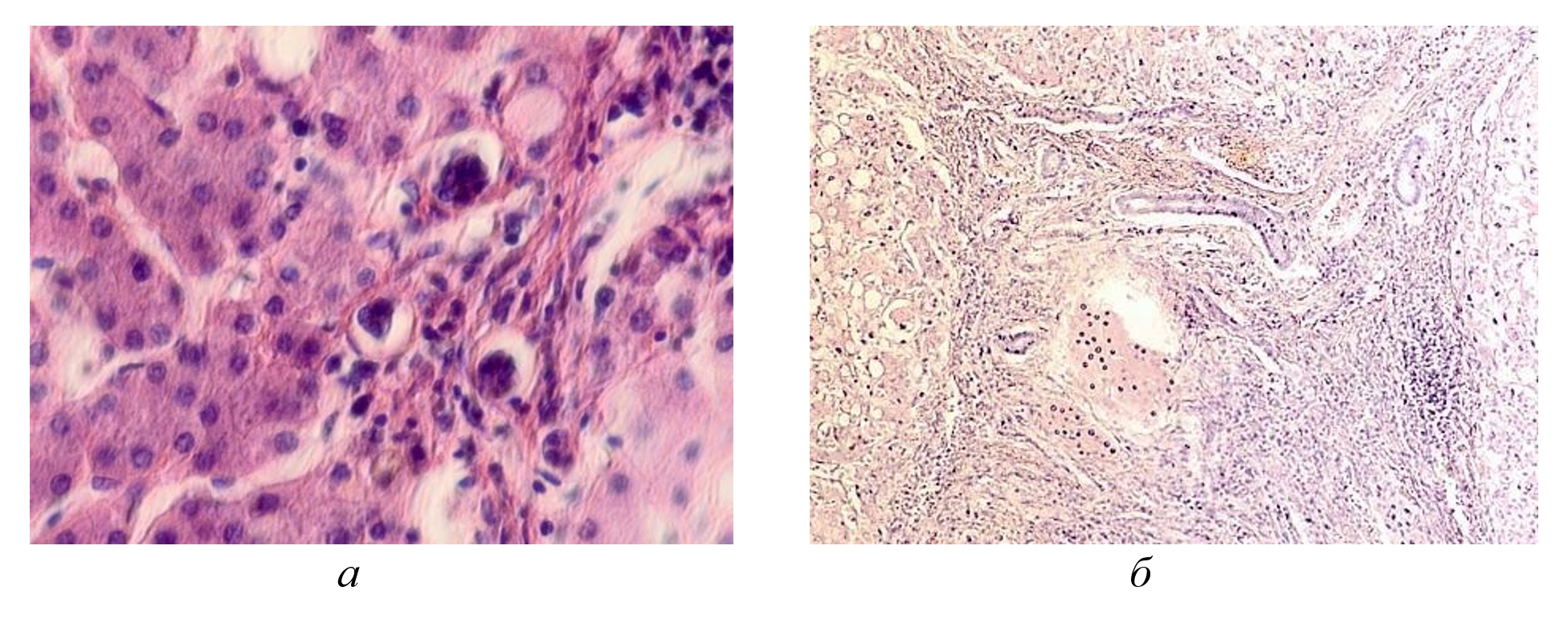
Рисунок 4 - Паренхимная структура печени больных с гепатитом С у ВИЧ инфицированных пациентов, псевдодолька печени:
а - тельца Councilman; б - замещение клеток паренхимы печени рубцовой тканью и клеточный некроз, отсутствует центральная вена, апоптоз гепатоцитов
Примечание: окраска гематоксилином и эозином; микрофото; ув. а - х 200; б - х 400; составлен авторами по результатам данного исследования
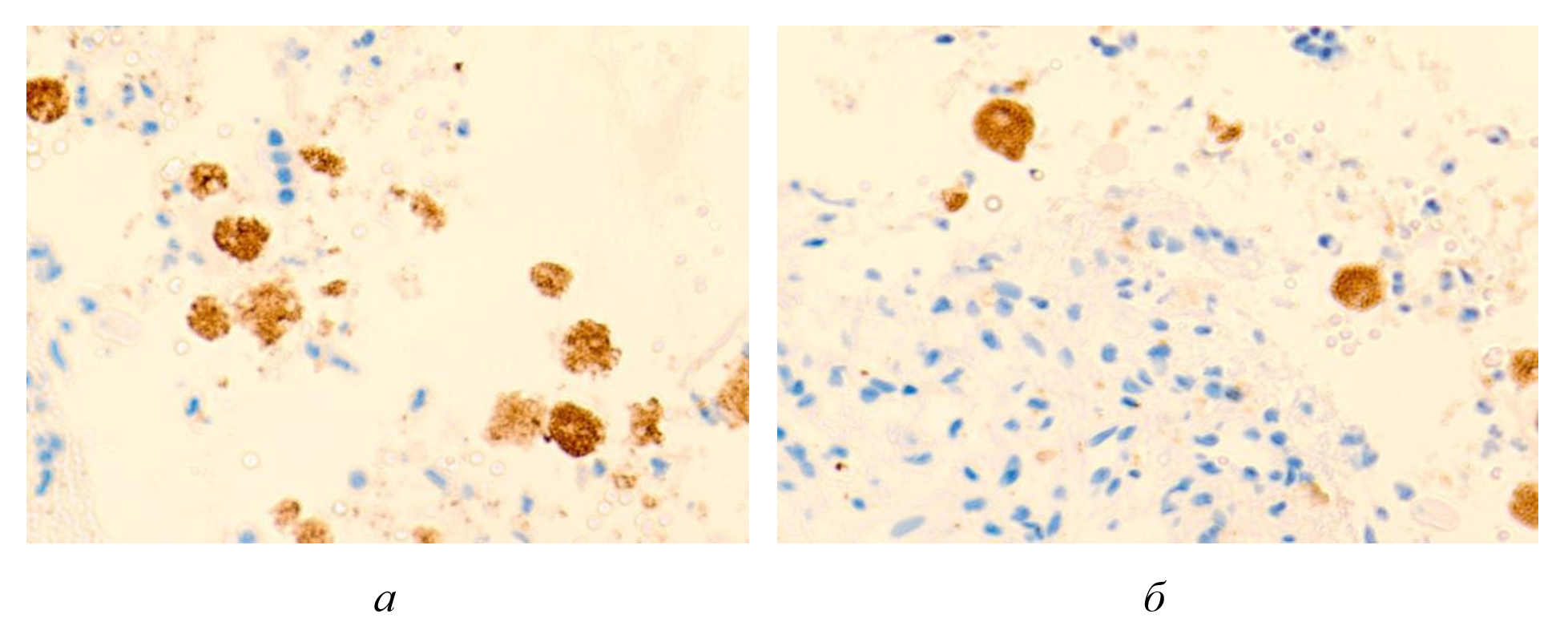
Рисунок 5 - Макрофагальные клетки с трансферрином внутри проема кровеносных сосудов печени больного гепатитом С на фоне ВИЧ инфицирования
Примечание: микрофото; окраска гематоксилином и эозином; ув. х400; составлен авторами по результатам данного исследования
Иммунологический профиль характеризовался выраженной анергией: медиана CD4+ лимфоцитов составила 52,3 кл/мкл при медиане CD8+ 601,2 кл/мкл, что отразилось в критическом снижении иммунорегуляторного индекса до 0,09. Параллельно регистрировалась высокая вирусная нагрузка — 310384 РНК HIV кл/мл.
У пациентов с коинфекцией ВГС, получавших антиретровирусную терапию, несмотря на структурные нарушения печени, зафиксированы более высокие иммунологические показатели: медиана CD4+ достигала 95,4 кл/мкл, CD8+ — 488,7 кл/мкл, иммунорегуляторный индекс — 0,19, при существенном снижении вирусной нагрузки вплоть до неопределяемого уровня.
Микроскопически в 73% случаев (n=32) идентифицированы нарушения микроциркуляции в виде венозного полнокровия с дилатацией центральных вен и капилляров. На фоне гипоксически-индуцированного гемолиза отмечена редукция популяции клеток Купфера, коррелирующая с системным иммунодефицитом.
Морфологический анализ выявил комплексные патологические изменения печеночной паренхимы, характеризующиеся внутрипеченочным холестазом с обструкцией билиарных протоков и последующим развитием склеротических изменений в соединительнотканном компоненте печени. При светооптическом исследовании гематоксилин-эозиновых препаратов у всех пациентов (n=44) обнаружены дегенеративные изменения гепатоцитов, при этом в 75% случаев (n=33) визуализировалась жировая дистрофия с формированием множественных вакуолей различного калибра и периферическим смещением ядер. Нарушение дольковой архитектоники печени сопровождалось фиброзом портальных трактов различной степени выраженности с мононуклеарной инфильтрацией у 35% пациентов (n=15). Сочетание различных видов дистрофических изменений с очаговыми некрозами и портальным фиброзом вплоть до цирротической трансформации наблюдалось во всех исследуемых образцах. В 16% случаев (n=7) зафиксировано развитие продуктивных васкулитов с фибриноидным набуханием и некрозом стенок артериол на фоне циркуляторных нарушений, что привело к формированию микроабсцессов и инициации канцерогенеза.
Патоморфологическое исследование выявило, что структурные изменения печеночной паренхимы у пациентов с коинфекцией ВИЧ и гепатита С обусловлены гемолизом эритроцитов, деградацией гемоглобина и последующим развитием клеточной аноксии. При остром течении гепатита С наблюдается характерная морфологическая картина с перидольковой лейкоцитарной инфильтрацией и поражением зоны триад при сохранении архитектоники классической печеночной дольки. Трансформация острого гепатита в хроническую форму сопровождается формированием псевдодолек, дилатацией желчевыводящих путей и апоптозом гепатоцитов, что соответствует общепринятым представлениям о патогенетических механизмах поражения печени при сочетанной ВИЧ/HCV-инфекции.
Комплексный анализ органов ВИЧ-инфицированных пациентов выявил, помимо классических патоморфологических изменений (гиперемия паренхимы, апоптотические и дегенеративные процессы, фибротизация, цирротическая трансформация печени с последующим развитием очаговых некрозов и лейкоцитарной инфильтрации), универсальную депозицию коричневого пигмента в венозном русле всех исследованных органов.
В результате комплексного исследования установлено, что темная пигментация цитоплазмы макрофагов представляет собой накопление трансферрина, обусловленное нарушением катаболизма гемоглобина при массивном гемолизе эритроцитов. При коинфекции ВИЧ и вирусного гепатита С патоморфологические изменения печеночной паренхимы инициируются гипоксическим состоянием, индуцирующим последовательное развитие апоптоза и некроза гепатоцитов. Данные деструктивные процессы усугубляются прогрессирующей ишемией тканей, вызванной токсическим воздействием свободного гемоглобина, поступающего в синусоидальное русло при массированном эритроцитолизе.
В процессе деградации гемоглобина образующиеся метаболиты — железо, билирубин, порфирин и трансферрин — подвергаются фагоцитозу печеночными макрофагами.
Прогрессирующая ишемическая дегенерация гепатоцитов обусловливает комплексное нарушение эритропоэтической функции печени, включая дефицит синтеза компонентов эритропоэтина, дисрегуляцию эритропоэза и угнетение регенерации эритроидного ростка на фоне метаболических расстройств. Данная патогенетическая концепция находит непрямое подтверждение в документированных клинических наблюдениях, свидетельствующих о снижении уровня гемоглобина у пациентов с HCV-инфекцией и ВИЧ, хотя механизмы развития анемического синдрома при этих состояниях ранее детально не рассматривались.
Коинфицированные ВИЧ и вирусом гепатита С пациенты характеризуются повышенным риском развития цирротических изменений печени, что обусловлено недостаточной изученностью патогенетических механизмов анемического синдрома и отсутствием научно обоснованных подходов к его коррекции. Необходимость минимизации потенциальных осложнений определяет актуальность проведения высококачественных рандомизированных исследований, направленных на оценку эффективности терапевтических стратегий при анемии у данной категории больных.
4. Заключение
Освобождение токсичного несвязанного гемоглобина в кровоток при разрушении эритроцитов выступает ключевым патогенетическим фактором системного поражения паренхиматозных органов. Индуцированная гипоксически-аноксическая альтерация гепатоцитов инициирует каскад метаболических нарушений: депрессию энергетического обмена, дисрегуляцию эритропоэза вследствие дефицита эритропоэтина, дисфункцию детоксикационных механизмов. Указанные патобиохимические сдвиги манифестируют стеатозом, активацией апоптотических и некротических процессов с последующим развитием цирротической трансформации и онкогенеза как в печени, так и экстрагепатически.
