INVERSE PROBLEM THE POLYCONDENSATION REACTION OF ASPARTIC ACID
Зиганшина Ф.Т. 1, Спивак С.И. 2
1Ассистент, Уфимский государственный нефтяной технический университет, г.Уфа,
2Профессор, Башкирский государственный университет, г.Уфа, Башкортостан, г.Уфа
ОБРАТНАЯ ЗАДАЧА РЕАКЦИИ ПОЛИКОНДЕНСАЦИИ АСПАРАГИНОВОЙ КИСЛОТЫ
Аннотация
Получены константы скорости для процесса поликонденсации аспарагиновой кислоты, которые позволяют оптимизировать условия проведения реакции поликонденсации аспарагиновой кислоты.
Ключевые слова: обратная задача, поликонденсация.
Ziganshina F.T. 1, Spivak S.I. 2
1Assistant, Ufa State Petroleum Technical University, Ufa
2Prof., Bashkir State University, Ufa
INVERSE PROBLEM THE POLYCONDENSATION REACTION OF ASPARTIC ACID
Abstract
The rate constant obtained for the polycondensation of aspartic acid which can optimize the reaction conditions the polycondensation of aspartic acid.
Keywords: inverse problem, polycondensation
Введение
В статье рассмотрена химическая реакция поликонденсации аспарагиновой кислоты, которая проходит в две параллельные фазы. В качестве исследуемого вещества выбрана – аспарагиновая кислота. Кинетический эксперимент, который проводился в температурном интервале 1690С – 2270С, в результате чего были получены данные по потери веса кислоты по времени для каждой температуры [1].
Постановка задачи
На основе проведенного эксперимента для объяснения полученных данных, записана кинетическая модель для изучаемого процесса, которая проходит независимо и параллельно в двух зонах твердой фазы:
Первая зона:
αA→B+C константа k1
Вторая зона:
(1-α)A→B+C константа k4
αA+C→ B+C константа k2
С→D+B константа k3
(1-α)A+C→ B+C константа k5
С→D+B константа k6
Здесь: A – исходный мономер; B – вода (потеря веса) выделяется во всех происходящих реакциях; C – автокатализирующий промежуточный продукт, димер, триммер и т. д.; D – конечный продукт.
Используя законы химической кинетики можно кинетическую схему однозначно привести к системе дифференциальных уравнений для обеих фаз:
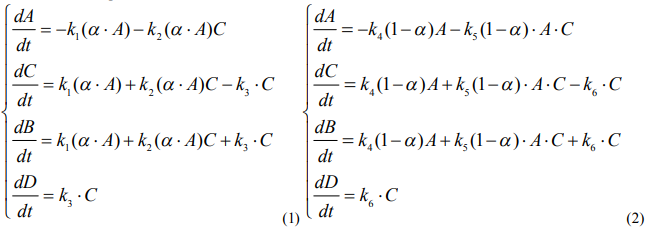
Таким образом, по данной схеме необходимо определить 6 констант скоростей и значение параметра α, отражающий долю исходного мономера для фаз, т.е. решить обратную задачу.
Решение обратной задачи и результаты
Под обратной задачей в химической кинетике понимается расчет констант скоростей всех или нескольких элементарных стадий на основании полученных экспериментальных данных по кинетике протекания сложной реакции.
Константы k1, k2, k3, k4, k5, k6, α ищутся путем минимизации функционала 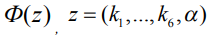 соответствия модельных и экспериментальных значений массы исходного вещества А:
соответствия модельных и экспериментальных значений массы исходного вещества А:
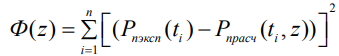 (3)
(3)
где n – количество экспериментальных точек.
Расчетные значения 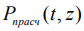 находятся из системы дифференциальных уравнений (СДУ) (1). Для исследования кинетики каждой фазы, удобнее разделить систему дифференциальных уравнений (1) на две СДУ.
находятся из системы дифференциальных уравнений (СДУ) (1). Для исследования кинетики каждой фазы, удобнее разделить систему дифференциальных уравнений (1) на две СДУ.
Для решения СДУ используется метод Рунге-Кутты 4 порядка [2], при начальных условиях t=0, [A]=a0 [B]=0,[C]=0,[D]=0, где α=const.
Минимизация функционала  с помощью метода Хука-Дживса позволила найти соответствующие константы при 1690С - 1970С :
с помощью метода Хука-Дживса позволила найти соответствующие константы при 1690С - 1970С :
Таблица 1
|
Т-ра |
α |
К-ты 1 стадии |
К-ты 2 стадии |
Т-ра |
α |
К-ты 1 стадии |
К-ы 2 стадии |
|
1690 |
0.8 |
k1=2.49063e-6; k2=0.218530; k3=0.13660; |
k4=1.754e-5; k5=1.925; k6=0.0741; |
1870 |
0.7 |
k1=8.7269e-6; k2=3.228187; k3=1.552043; |
k4=2.0473e-5; k5=17.545; k6=1.54943; |
|
1720 |
0.8 |
k1=5.56111e-6; k2=0.3484; k3=0.2087995; |
k4=1.6737e-5; k5=7.2182043; k6=0.27367; |
1920 |
0.7 |
k1=2.4274e-5; k2=5.34023; k3=2.587; |
k4=5.04255e-5; k5=28.00441; k6=2.48301; |
|
1820 |
0.7 |
k1=8.01186e-6; k2=1.832413; k3=0.88824; |
k4=1.69124e-5; k5=9.999; k6=0.88839; |
1970 |
0.7 |
k1=3.9283е-5; k2=7.4205; k3=3.572; |
k4=8.93982е-5; k5=35.99; k6=3.1791107; |
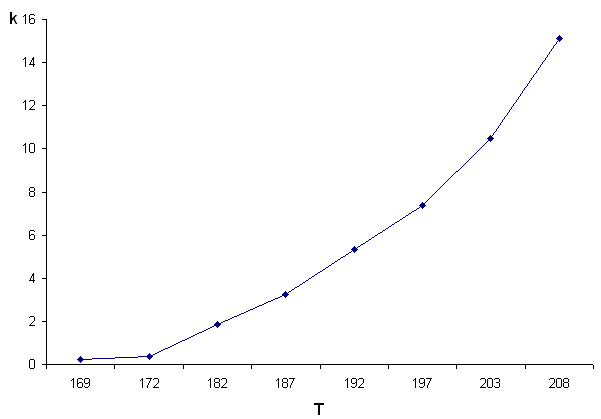
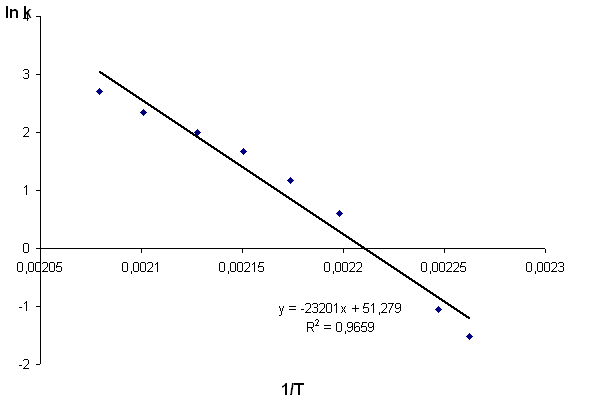
Зависимость скорости реакции от температуры представлена на рисунке 1. Из рисунка видно, что график зависимости k(T) нелинеен. В координатах (ln k,1/T) экспериментальные данные спрямляемы.
 |
 |
|
Рис.1 Зависимость константы скорости k2 от температуры (а). Спрямление экспериментальных данных (б) |
|
Зависимость константы скорости реакции от температуры определяется уравнением Аррениуса: 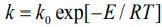 , где E - энергия активации, которую необходимо найти. Энергия активации в элементарных реакциях, минимальная энергия реагентов, достаточная для того, чтобы они вступили в реакцию.
, где E - энергия активации, которую необходимо найти. Энергия активации в элементарных реакциях, минимальная энергия реагентов, достаточная для того, чтобы они вступили в реакцию.
References
Кинетический анализ твердофазной поликонденсации аспарагиновой кислоты. / В. М. Гольдберг [и др. ]. - // Доклады Академии наук. - 2008. - Т. 423, N 5, декабрь. - С.583-587. - ISSN 0869-5652. - Библиогр.: с. 638.
Лапчик М.П. и др. Численные методы.2005, М. ACADEMA.384.
