INFLUENCE OF SERPENTINITE ON THE HEMATOPOIETIC SYSTEM OF RATS IN THE EXPERIMENT
INFLUENCE OF SERPENTINITE ON THE HEMATOPOIETIC SYSTEM OF RATS IN THE EXPERIMENT
Abstract
Serpentinite is actively used in agriculture as a soil ameliorant, which led to the necessity to study its effect on living organisms. Healthy Wistar rats were fed with ground serpentinite from Khabaz deposit of the Kabardino-Balkar Republic for 60 days. During the research, multiple blood sampling and study of structural changes in organs of hematopoietic system of animals after taking them out of the experiment were carried out. The results of the experiment showed: serpentinite administration led to the development of megaloblastic type of hematopoiesis with predominance of megaloblasts, hyperchromic erythrocytes, leukocytosis and lymphopenia. In the spleen, hypoplasia of lymphoid follicles, haemosiderosis are observed. These changes, in our opinion, can be regarded as the cause of immunodeficiency syndrome.
1. Введение
Серпентинит (от лат. serpens – змея) – горная порода, основными компонентами которой является серпентин Mg6[Si4O10](OH)8, тальк Mg3Si4O10(OH)2, пирротин FeS, энстатит MgSiO3, магнетит Fe3O4, гематит Fe2O3. Также в состав серпентинита может входить множество различных минералов, в зависимости от месторождения серпентинита. В настоящее время появились работы по применению серпентинита в качестве почвенного мелиоранта на кислых почвах . Входящие в состав серпентинита соли кальция и магния позволяют предполагать быстрый переход этих элементов в почву с осуществлением выраженного мелиорирующего эффекта . Магний является необходимым компонентом для развития культурных растений, так как входит в состав хлорофилла и участвует в процессе фотосинтеза , . Кислая реакция почвенной среды является одной из главных причин низких урожаев сельскохозяйственных культур . Растения поглощают магний из почвенного раствора, который медленно пополняется почвенными запасами, оптимальная подача магния необходима для повышения устойчивости сельскохозяйственных культур к различным стрессам, повышения урожайности и качественных показателей убранной продукции .
Однако из серпентиновых почв происходит выброс никеля и марганца, с последующим поступлением этих металлов в соседние среды, что имеет важное значение для оценки потенциальных последствий, связанных с изменением в землепользовании . Серпентиновые почвы, выделяют в окружающую среду повышенные концентрации токсичных тяжелых металлов. Следовательно, культурные растения, выращиваемые в такой почве или рядом с ней, могут накапливать токсичные тяжелые металлы в съедобных тканях , .
Влияние серпентинита и на живые организмы не изучено.
2. Объекты и методы исследования
В работе использовались 20 подопытных здоровых лабораторных крыс линии Wistar идентичных по серии, массе и возрасту. 15 крыс получали молотый серпентинит из с. Хабаз Кабардино-Балкарской республики в дозе 200 мг на 1 кг веса и 5 крыс не получали серпентинит (контрольная группа). Содержание и использование крыс в эксперименте соответствовало правилам, принятым в ФГБОУ ВО «Кабардино-Балкарский государственный университет им. Х.М. Бербекова» и рекомендациям национального совета по исследованиям, национальным законам. Химический состав серпентинита: лизардит (Н4Мg3O2Si2) – 86,9%, вюстит (FeO) – 8,0%, оксид кремния (SiO2) – 2,6%, соли никеля 2,5%.
По ходу эксперимента у крыс производился забор крови с определением основных показателей. Забор крови производили под эфирным наркозом из хвостовой вены лабораторных животных. Кровь забирали в вакуумные пробирки и анализировали на автоматических анализаторах. Для общего анализа взятие крови осуществляли в одноразовые полипропиленовые пробирки с ЭДТА-К2 («Sarstedt», Германия).
Исследование количества эритроцитов (1012/л) в периферической крови проводили с помощью проточной цитометрии, концентрацию гемоглобина (г/л) определяли натрий лаурилсульфат-гемоглобиновым методом на автоматическом гематологическом анализаторе «Sysmex XT 2000i» согласно инструкции производителя. При проведении исследования программа автоматического гематологического анализатора в каждой пробе рассчитывала HCT (гемотокрит, %) и эритроцитарные индексы (ЭИ): средний объем эритроцита (MCV, фл), среднее содержание гемоглобина в эритроците (MCH, пг), среднюю концентрацию гемоглобина в эритроците (MCHC, г/л). Количество тромбоцитов (109/л) в периферической крови определяли кондуктометрическим методом на автоматическом гематологическом анализаторе «Sysmex XT 2000i» («Sysmex Corporation», Япония). Исследование количества лейкоцитов (109/л) в периферической крови проводили с помощью проточной цитометрии в соответствии с инструкцией производителя, на автоматическом гематологическом анализаторе «Sysmex XT 2000i» («Sysmex Corporation», Япония). Автоматическую дифференцировку лейкоцитарной формулы осуществляли на автоматическом гематологическом анализаторе «Sysmex XT 2000i» («Sysmex Corporation», Япония) с помощью проточной цитофлюориметрии. При дифференцировке лейкоцитарной формулы определяли: абсолютное (109/л) и относительное количество нейтрофилов (%); абсолютное (109/л) и относительное количество лимфоцитов (%); абсолютное (109/л) и относительное количество моноцитов (%); количество эозинофилов абсолютное (109/л) и относительное (%); количество лимфоцитов абсолютное (109/л) и относительное (%); количество незрелых гранулоцитов абсолютное (109/л) и относительное (%).
После выведения животных из эксперимента проведена аутопсия по стандартной методике .
Образцы ткани органов для световой микроскопии исследования фиксировали 10% забуференным нейтральным формалином и заключали в парафин по классической методике. На санном микротоме, из парафиновых блоков с образцами ткани, изготавливали серийные срезы толщиной 3-5 мкм и наносили их на предметные стекла. Полученные срезы образцов ткани окрашивали гематоксилином и эозином, по классическому протоколу. Микроскопию полученных гистологических препаратов осуществляли при 10, 20, 40-кратном увеличении с помощью светового микроскопа «LEICA DM4000 B».
При микроскопическом анализе костного мозга оценивалось: состояние всех ростков кроветворения: клеточность, полноценность клеточных элементов, «стромальный» компонент, наличие патологических изменений.
При микроскопическом анализе селезенки оценивалось состояние красной и белой пульпы, наличие патологических изменений.
3. Результаты исследования и их обсуждение
Через 2 месяца приема серпентинита было выявлено статистически значимое повышение гематокрита до 54,3±0,95% (р<0,05), содержания гемоглобина в крови до 215,5±11,5 г/л (р<0,05), среднего объема эритроцитов до 56,3±1,41 фл. (р<0,05), средней концентрации гемоглобина в эритроците до 39,6±1,41 г/дл (р<0,05), среднего содержания гемоглобина в эритроците до 22,3±1,02 пг (р<0,05). Отмечалось повышение содержания лейкоцитов в крови до 16,11±0,06 тыс/мкл (р<0,05) за счет возрастания содержания нейтрофилов до 77,7±2,62% (р<0,05); содержание лимфоцитов в крови было снижено до 23,3±1,03% (р<0,05) (табл. 1).
Таблица 1 - Гематологические показатели крови у крыс-самцов линии Wistar, Клинический анализ крови
Показатели | Контрольная группа | Основная группа | Р |
Гематокрит, % | 38,5±1,06 | 52,3±2,95 | p<0,001 |
Гемоглобин, г/л | 145,6±6,37 | 215,5±11,5 | p<0,001 |
Эритроциты, 1012/л | 8,5±0,23 | 9,65±0,32 | p<0,02 |
MCV (ср. объем эритр.), фл. | 48,4±1,22 | 56,3±1,41 | p<0,001 |
МСН (ср. содержание Нb в эритроц.), пг | 16,5±1,02 | 22,3±1,13 | p<0,002 |
МСНС (ср. конц. Нb в эритр.), г/дл | 35,3±1,21 | 39,6±1,41 | p<0,001 |
Тромбоциты, 109/л | 450,8±13,8 | 409,5±12,6 | p<0,02 |
Лейкоциты, 109/л | 8,7±0,16 | 16,11±0,26 | p<0,05 |
Базофилы, % | 0,18±0,02 | 0,12±0,01 | p>0,05 |
Эозинофилы, % | 3,95±0,01 | 0,09±0,01 | p>0,05 |
Нейтрофилы (общее число), % | 65,7±1,06 | 77,7±2,62 | p<0,001 |
Палочкоядерные, % | 2,6±0,04 | 2,5±0,01 | p>0,05 |
Лимфоциты, % | 40,8±2,37 | 23,3±1,03 | p<0,001 |
Моноциты, % | 3,7±0,06 | 0,01±0,001 | p>0,05 |
Базофилы, абс. тыс/мкл | 0,01±0,001 | 0,01±0,001 | p>0,05 |
Эозинофилы, абс. тыс/мкл | 0,01±0,001 | 0,01±0,001 | p>0,05 |
Нейтрофилы (общее число), абс. тыс/мкл | 5,71±0,12 | 12,4±0,35 | p<0,001 |
Лимфоциты, абс. тыс/мкл | 3,55±0,03 | 1,41±0,02 | p<0,001 |
Моноциты, абс. тыс/мкл | 1,72±0,06 | 0,16±0,01 | p<0,001 |
Выявленные изменения свидетельствовали о том, что у крыс развился мегалобластический тип кроветворения с преобладанием мегалоцитов, гиперхромных эритроцитов. По-видимому, это было связано с сохранившимся оксидом железа в серпентините, что привело к стимуляции эритропоэза, повышению синтеза гемоглобина. Также никель обладает стимулирующим действием на кроветворение за счет стимуляции экспрессии гена эритропоэтина, повышения синтеза нуклеиновых кислот, РНК, ДНК и белков.
При морфологическом исследовании костного мозга у животных, получавших серпентинит, были выявлены следующие изменения: гиперклеточность за счет гиперплазии всех ростков кроветворения, но преимущественно за счет эритроидного ростка миелоидной ткани (рис. 1) по типу мегалобластного эритропоэза.
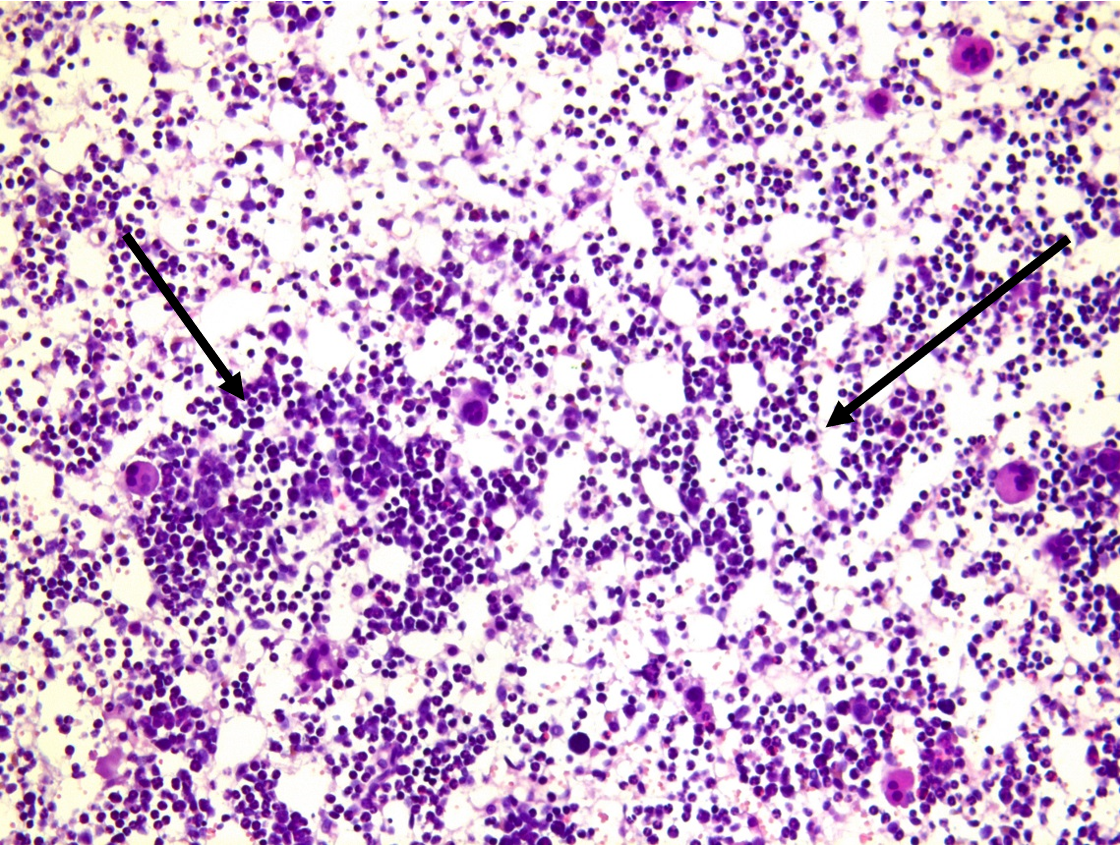
Рисунок 1 - Костный мозг крысы линии Wistar: реактивная гиперплазия ростков кроветворения, окраска гематоксилином и эозином, х100
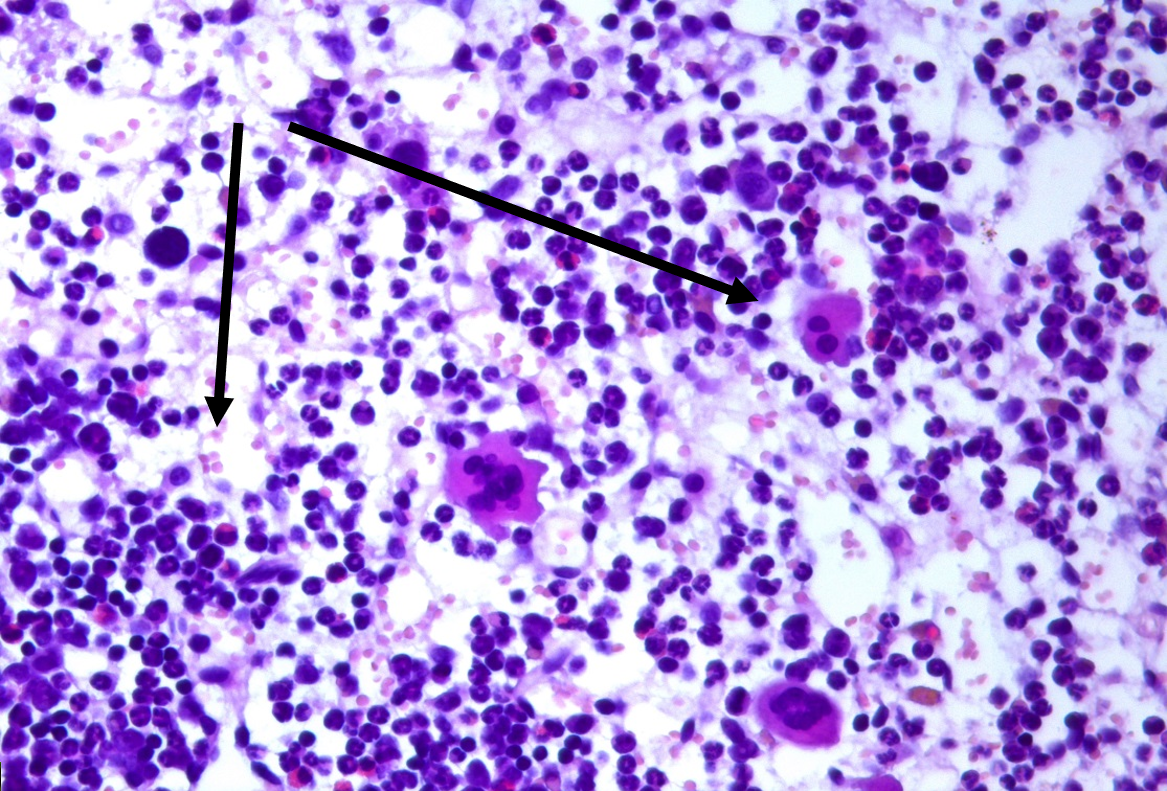
Рисунок 2 - Костный мозг крысы: реактивная гиперплазия ростков кроветворения, мегалобласты и мегакариоциты, окраска гематоксилином и эозином, х400
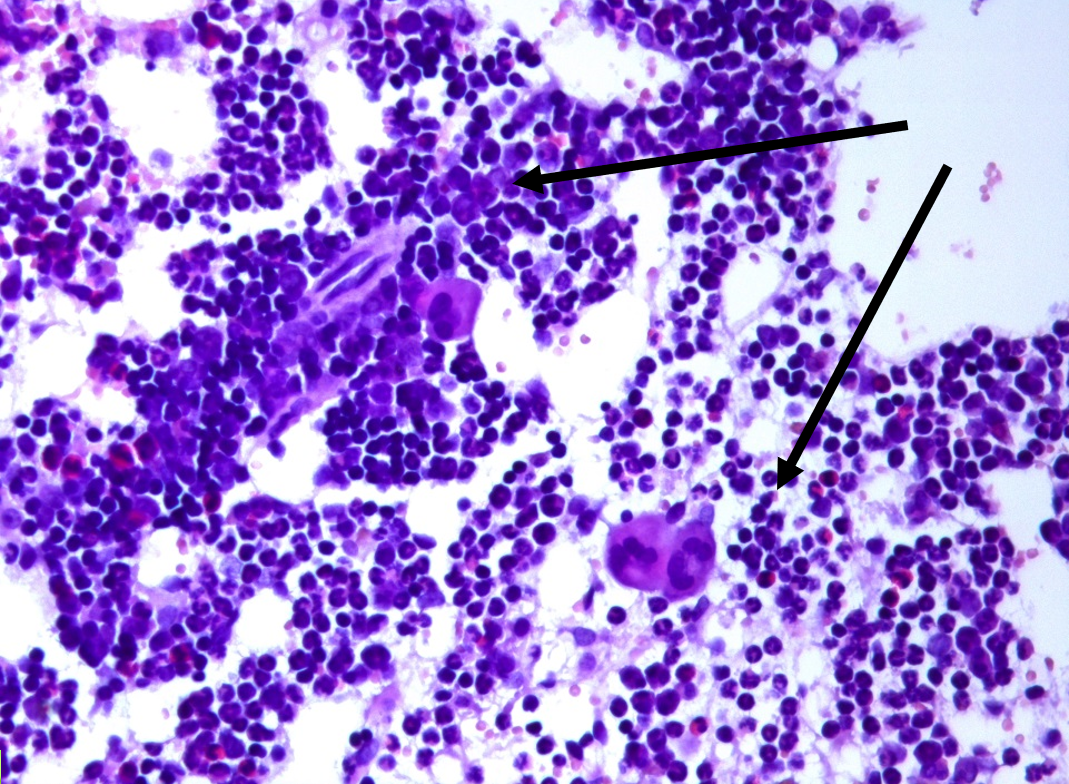
Рисунок 3 - Костный мозг крысы линии Wistar: реактивная гиперплазия ростков кроветворения, периваскулярные инфильтраты из миелоидных клеток, окраска гематоксилином и эозином, х400
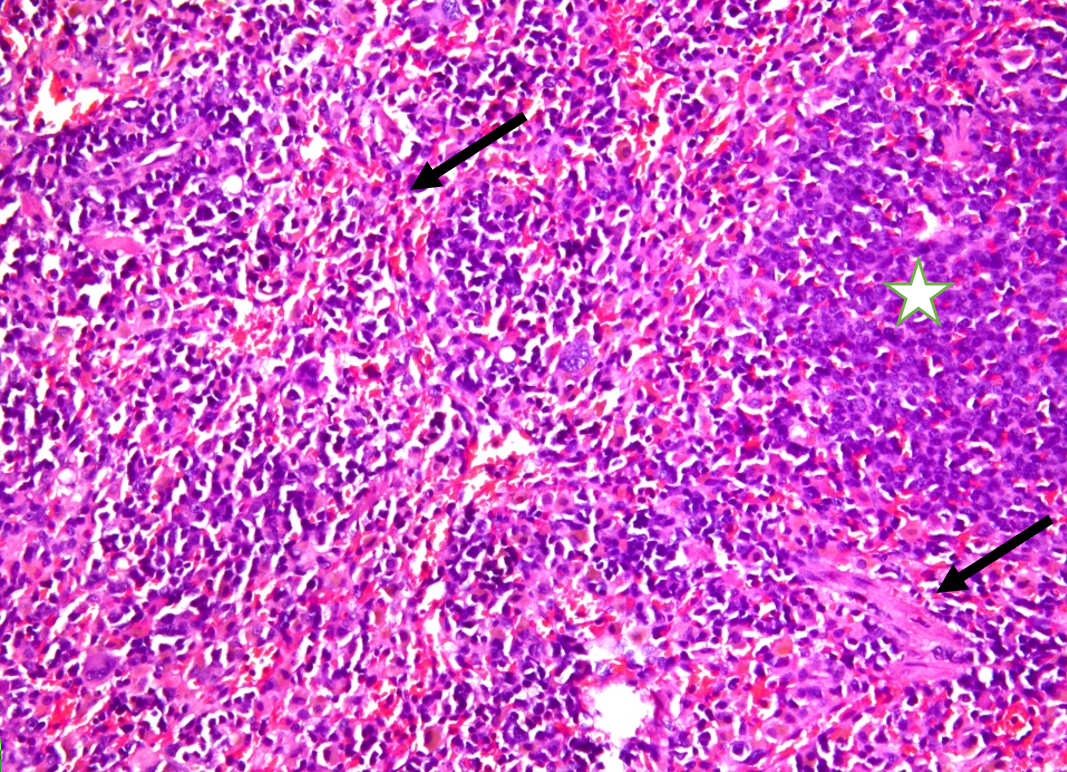
Рисунок 4 - Селезенка крысы: фокусы экстрамедуллярного кроветворения (звёздочка), фиброз стромы (стрелки), окраска гематоксилином и эозином, 200
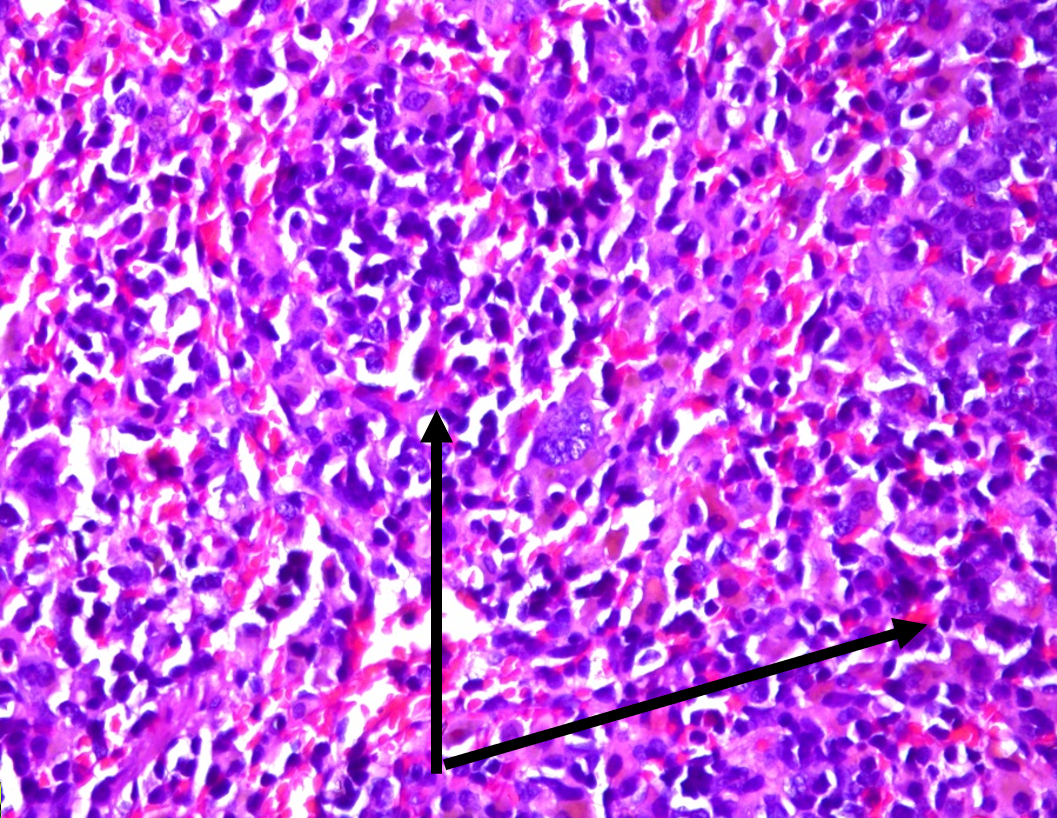
Рисунок 5 - Селезенка крысы линии Wistar: фокусы экстрамедуллярного кроветворения, пролиферация мегакариоцитарного ростка, окраска гематоксилином и эозином, х400
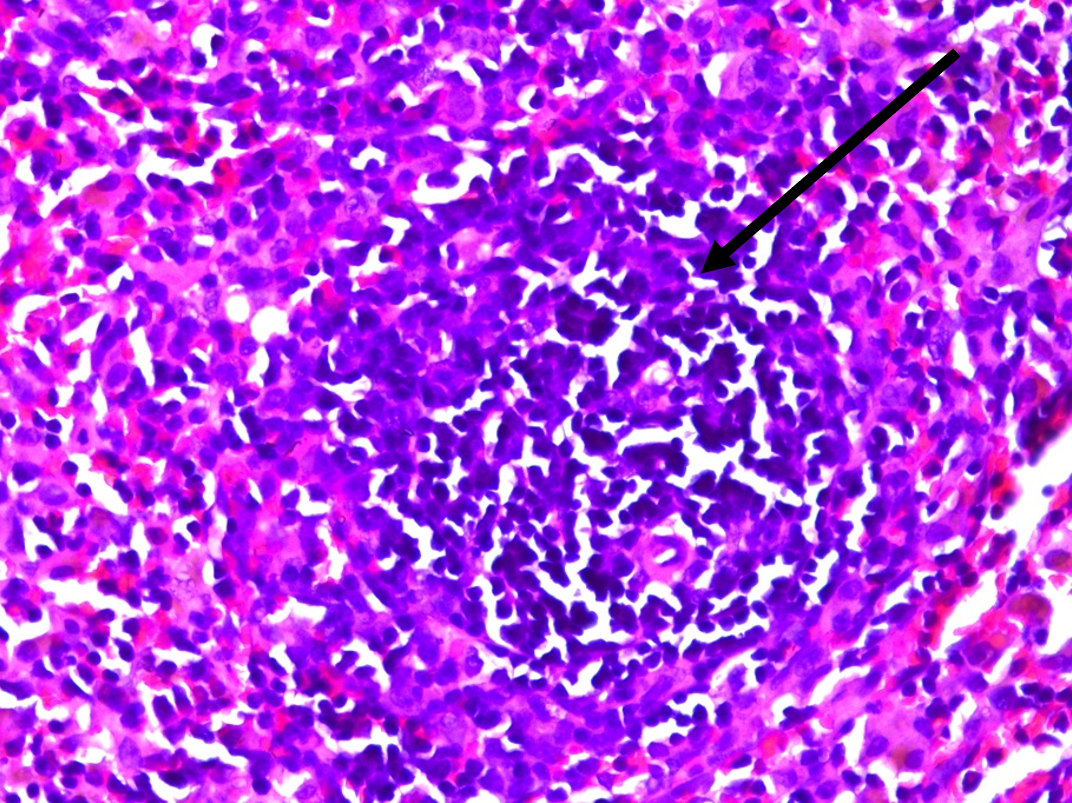
Рисунок 6 - Селезенка крысы линии Wistar: редукция лимфоидных фолликулов, окраска гематоксилином и эозином, х400
4. Заключение
Введение серпентинита крысам линии Wistar на протяжении двух месяцев вызвало выраженную гиперплазию всех ростков кроветворения в костном мозге, дистрофические изменения в селезенке с редукцией лимфоидного аппарата белой пульпы, и появлением очагов экстрамедуллярного кроветворения в красной пульпе. Морфологические изменения в костном мозге и селезенке подтверждались клинико-лабораторными изменениями в крови исследуемых животных и отсутствовали у крыс контрольной группы.
На основании проведенных исследований можно заключить, что применение неочищенного от солей никеля и железа серпентинита привело к повреждающему действию на кроветворную систему крыс. Исследования необходимо продолжить в целях выбора безопасного для живых объектов использования удобрений на основе серпентинита в сельском хозяйстве.
