Comparative Characterization of the Effect of a New Pyridine Derivative on the Course of Diabetes Mellitus in Four Experimental Models
Comparative Characterization of the Effect of a New Pyridine Derivative on the Course of Diabetes Mellitus in Four Experimental Models
Abstract
Aim: observation of changes in body weight and glycemia level in rats of two age groups with diabetes mellitus induced in four different ways of pharmacocorrection with a new pyridine derivative.
Materials and methods. The experiment was carried out on 91 individuals of white outbred male rats of two different age categories. Compound cv-150, a partially hydrogenated pyridine derivative containing a furan fragment in the fourth position, was administered orally at a dose of 1 mg/kg to experimental groups of animals after simulated dithizone, alloxane, streptomycin and dexamethasone diabetes mellitus. During the experiment, the level of venous blood glucose was measured twice (at the end of the simulation and pharmacocorrection) as the main index. Weekly weighing and visual observation of the psychosomatic status of the animals were performed. The information obtained about the dynamics of changes in body weight and glycemic level in the experimental groups was compared with similar indicators in the control and intact groups.
Results. The most profound hyperglycemia was established in animals with dexamethasone diabetes mellitus in two age groups in rats aged 3 and 18 months. The maximum level of glycemia was recorded in 18-month-old rats after modeling dexamethasone diabetes (15.99 mmol/L). The lowest of this index was in 3-month-old animals with alloxan-induced DM (9.7 mmol/l). The highest hypoglycemic activity of the cv-150 compound was manifested in senile rats with the dexamethasone diabetes model. The decrease in glucose levels was 81.3% compared with the control group. The maximum body weight gain was recorded in 3-month-old rats in the streptomycin DM model stage (160.31%). The greatest weight loss was seen in the dexamethasone diabetes control group in 18-month-old rats (89.27%). The greatest influence on the dynamics of body weight change of the experimental animals was the substance in the dexamethasone DM model in both age groups, which was manifested by a significant "smoothing" of the curve of weight change caused by dexamethasone withdrawal syndrome.
Conclusion. The diabetogenic effect of the streptomycin antibiotic from the group of aminoglycosides was established when used for 28 days at a dose of 115 mg/kg. The experimental compound with the laboratory code cv-150, had a pronounced hypoglycemic and metabolic-regulating effect in all the models of diabetes we tested.
1. Введение
Сахарный диабет (СД) является современной проблемой медицины, что связано с высоким риском. Осложнения СД заключаются в полиорганной недостаточности, вызванной комбинацией различных факторов. К числу этих факторов можно отнести нарушения микроциркуляции в тканях, вызванные микро- и макроангиопатиями, а также центральной и переферической невропатиями. К числу микроангиопатий, наиболее значимыми в своих проявлениях следует отметить ретинопатию [1] и нефропатию [2], диабетическую автономную невропатию [3]. Разновидностью диабетической автономной невропатии, приносящей опасные для жизни осложнения, является кардиальная автономная невропатия [4]. Однако суть этих осложнений заключается в их совместном проявлении, поскольку они являются патогенетическими ступенями одного заболевания. Особенно следует выделить следующие факторы:
1. Осложнения СД, характерные для течения самого заболевания.
2. Осложнения СД, характерные для течения самого заболевания, усугубленные возрастным фактором.
3. Осложнения СД, характерные для течения самого заболевания, усугубленные наличием тяжелой инфекции.
4. Осложнения СД, характерные для течения самого заболевания, усугубленные побочными эффектами фармакотерапии.
5. Полная или частичная комбинация вышеупомянутых факторов.
Известно, что СД в гериатрической практике характеризуется тяжелым течением. Поскольку так называемый «гериатрический синдром» связан непосредственно со старением, а также возрастными заболеваниями. В ходе исследования, было установлено, что средние показатели индексов коморбидности с возрастом увеличиваются как у мужчин, так и у женщин [5]. Среди тяжелых инфекционных заболеваний следует особо отметить новую коронавирусную инфекцию, для которой характерна мультиморбидность. Помимо респираторной системы поражаются сердечно-сосудистая, мочевыделительная, мышечная, гепатобилиарная, центральная нервная система. Частота сахарного диабета, как сопутствующего заболевания, при COVID-19 колеблется от 16,2% до 25% [6], [7]. Сочетание сахарного диабета, ожирения и артериальной гипертензии увеличивает риск смертности COVID-19 в несколько раз [8]. И наконец, не следует забывать о лекарственных препаратах, провоцирующих возникновение СД или усугубляющих его течение. Особенное место среди прочих занимают глюкокортикостероиды (ГКС), нашедшие широкое применение в лечении новой коронавирусной инфекции. Отрицательные эффекты ГКС на гомеостаз глюкозы вызваны множеством факторов. Основными из которых являются инсулинорезистентность, снижение массы β-клеток и нарушение глюкогенеза в печени [9]. Особенно сложно осуществлять гликемический контроль у пациентов пожилого возраста с новой коронавирусной инфекцией, имеющих в анамнезе СД и получающих в качестве патогенетической терапии ГКС [10].
В современной практике доклинических исследований имеется большой опыт применения различных моделей сахарного диабета у животных. Целью этих экспериментов является обнаружение положительной фармакологической активности у потенциально новых химических соединений. Проблема осложнений СД характеризуется не только наличием гипергликемии, но и достаточно широким спектром физиологических нарушений. А это, в свою очередь, предъявляет высокие требования как к методикам моделирования, так и к тестируемым соединениям. Существуют химические методы моделирования СД, которые заключаются во введении животным различных диабетогенных веществ.
2. Дитизоновый диабет
Дитизон (дифенилтиокарбазон) представляет собой соединение, диабетогенная активность которого известна с 40-х годов прошлого века. Для пояснения развития инсулиновой недостаточности под действием дитизона была сформулирована «цинковая теория», которая объясняла способность дитизона формировать комплексные соли с ионами цинка в β-клетках, что приводило к их разрушению. Несмотря на то, что эта модель использовалась в числе первых химических моделей для индукции СД, она все еще рекомендована для доклинических испытаний [11], [12], [13]. Исходя из механизма действия дитизона, развивается абсолютная инсулиновая недостаточность, вызванная прямым цитотоксическим действием. Рекомендуется индуцировать диабет путем внутривенной инъекцией дитизона (35 мг/кг массы тела) самцам кроликам, которые предварительно голодали на протяжении 16–18 часов [11]. Рекомендовано вводить в водном растворе аммиака. Наилучшим объектом для изучения дитизонового диабета являются кролики, хотя удалось вызвать его и у мышей [12]. Актуальной эта модель является в связи с ростом техногенного загрязнения окружающей среды, в том числе хилатообразующими соединениями, повышающими риск бета-цитотоксического эффекта [11].
3. Аллоксановый диабет
Аллоксан (2,4,5,6-тетраоксогексагидропиримидин) нестабильный пиримидин, производное мочевой кислоты, обладающий диабетогенным действием. В 1943 году было показано, что введение этого химического соединения кроликам вызывает избирательный некроз островков поджелудочной железы с последующим развитием классических симптомов сахарного диабета [14]. Аллоксан представляет собой структурный аналог глюкозы, за счет чего он связывается с транспортером глюкозы GLUT2 и избирательно накапливается в β-клетках поджелудочной железы. Дальнейшее изучение биохимических механизмов действия аллоксана показало наличие механизма деструктивного действия последнего путем генерации в циклической реакции с диалуровой кислотой активных форм кислорода, которые инициируют разрушение β-клеток, имеющих низкую антиоксидантную защиту. В гепатоцитах и клетках почечных канальцев крыс также экспрессируется транспортер глюкозы GLUT2, поэтому ведение аллоксана может оказывать токсическое действие на печень и почки. Однако гепатоциты крыс, обладающие более высокой антиоксидантной активностью, чем β-клетки поджелудочной железы, менее восприимчивы к цитотоксическому действию аллоксана. Аллоксан обладает диабетогенным действием только при парентеральном способе введения – внутривенном, подкожном, внутримышечном и интраперитонеальном. Эффективная доза зависит от вида животного, способа введения, состояния питания и формы вызываемого диабета. При внутривенном введении диабетогенные дозы аллоксана для крыс составляют 50-75мг/кг, при подкожном или внутрибрюшинном введении - 150-200 мг/кг и выше [14], [17]. Для развития СД в субкомпенсированной форме рекомендовано вводить белым беспородным крысам внутрибрюшинно натощак в дозах 50 мг/кг, 70 мг/кг и 50 мг/кг веса животных с интервалом в 7 дней. Для развития СД в декомпенсированной форме троекратно по 100 мг/кг через день [16]. Актуальной эта модель является в связи с имеющимися данными об эндогенном происхождении аллоксана. Содержание его у людей, собак и крыс составляет 0,15025 мг % [14].
4. Стрептомициновый диабет
Стрептомицин – первый антибиотик из группы аминогликозидов. Согласно литературным данным, эта модель не имеет широкого использования. За исключением авторского патента SU 1629916 A1 за 1987 год об этой модели вообще нет упоминания в специальной литературе. Согласно данным запатентованной методики, при внутримышечном введении стрептомицина в дозе 15 мг/кг на протяжении 4 недель было зафиксировано повышение уровня глюкозы до 7,22 ммоль/л. Данный уровень глюкозы можно трактовать как проявление сахарного диабета весьма условно, однако преимуществом данной модели, как подчеркивает коллектив авторов запатентованной методики, является отсутствие летальности в отличие от иных существующих моделей [18]. Актуальностью этой модели, на наш взгляд, является отсутствие в литературе сведений о каком-либо диабетогенном действии антибиотиков группы аминогликозидов и стрептомицина, в частности.
5. Дексаметазоновый диабет
Дексаметазон – фторированный глюкокортикостероид (ГКС). Известно, что длительный прием глюкокортикостероидных лекарственных препаратов, за счет прямой стимуляции глюконеогенеза вызывает гипергликемию. Отмечено также прямое повреждающее действие на β-клетки поджелудочной железы. Высокие дозы ГКС нарушают секреторную функцию β-клеток и приводят к развитию инсулинорезистентности [11]. Механизм нарушения регуляции обмена углеводов и липидов связывают, в основном, с прямым влиянием ГКС на экспрессию транспортеров глюкозы GLUT1 и GLUT4, а также инактивацией митохондриальной ФАД-глицерофосфатдегидрогеназы, что приводит к инсулинорезистентности, снижению утилизации глюкозы адипоцитами и нарушению индуцированной глюкозой секреции инсулина [11], [19]. В настоящее время существует множество разновидностей методики вызвать у подопытных животных метастероидный диабет, являющийся разновидностью эндокринной модели СД [14]. В литературе есть информация об использовании дозы дексаметазона 100 мкг/кг ежедневно на протяжении 28 суток [20], 125 мкг/кг ежедневно на протяжении 13 суток [22], 800 мкг/кг ежедневно на протяжении 4 суток [21] и 800 мкг/кг однократно [19]. Перечисленные эксперименты проводились преимущественно на молодых крысах возрастом 8-16 недель (2-4 месяца). Отдельного внимания заслуживает моделирование стероидного диабета у 18-ти месячных крыс периода старческих изменений. Поскольку известно, что введение дексаметазона 125 мк/кг массы тела на протяжении 13 суток 18-ти месячным крысам приводит к умеренной базальной гипергликемии, двукратному повышению концентрации инсулина и неэтерифицированных жирных кислот в сыворотке крови экспериментальных животных. Иными словами, стероидный сахарный диабет у старых животных позволяет отобразить основные патогенетические механизмы у больных сахарным диабетом 2 типа. Аналогичная схема введения дексаметазона у молодых трехмесячных крыс воссоздает картину преддиабета [11]. Дексаметазоновая модель СД с целью поиска новых соединений, способных эффективно снижать уровень гипергликемии и регулировать нарушенные метаболические процессы, на сегодняшний день является наиболее актуальной. Поскольку не только отображает актуальную проблему побочных эффектов фармакотерапии ГКС при различных заболеваниях, в том числе таких тяжелых инфекционных заболеваниях, как новая коронавирусная инфекция, но также позволяет варьировать между различными возрастными группами и степенью тяжести патологии.
Задачей нашего эксперимента было испытать фармакологическую активность нового синтезированного гетероциклического соединения из группы частично гидрированных пиридинов, производных цианотиоацетамида. С лабораторным шифром cv-150, на различных моделях СД. Проведено наблюдение динамики изменений уровня глюкозы крови, а также изменений массы тела подопытных животных, что косвенно отображает изменение метаболических процессов в организме крыс на различных этапах моделирования и фармакокоррекции. Таким образом, на модели «дитизонового диабета» тестировалась фармакологическая активность при СД 1 типа, на модели «аллоксанового диабета» фармакологическая активность при СД смешанного типа. Модель стрептомицинового диабета тестировалась без учета типа диабета, поскольку ставится под сомнение его существование на фоне приема антимикробных препаратов. В отношении «дексаметазонового диабета» исследование фармакологической активности нового соединения позволяет оценить его действие как при сахарном диабете, так и в условии преддиабетического состояния.
По данным виртуального биоскрининга с использованием комплекса программ Swiss Target Prediction, разработанных учеными из Swiss Instituteof Bioinformatics, on-line ресурсов: Online SMILES Translatorand Structure File Generator от U.S. National Cancer Institute, OPSIN: Open Parser for Systematic IUPAC nomenclature от University of Cambridge, Centrefor Molecular Informatics синтезированных нами на базе НИЛ «Химэкс» ЛГУ им. Владимира Даля 170 новых производных ди- и тетрагидропиридинов [23]. Одним из этих соединений является соединение cv-150. Формула соединения представлена на рисунке 1.
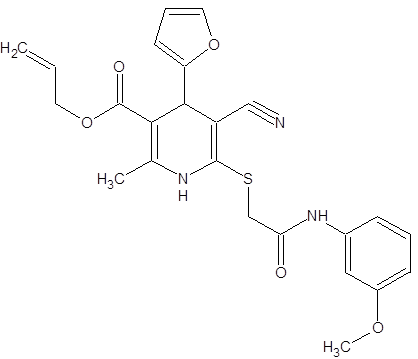
Рисунок 1 - cv-150
Среди потенциальных биологических мишеней, к которым insilico, проявил высокую степень сродства оказались следующие:
Аденозиновые рецепторы(А2а, А2b,A1 и А3).
Каннабиоидные рецепторы (CB1 и CB2).
Рецепторы глюкокортикоидов (NR3CI).
Ферментные системы микросомальной системы печени цитохрома P-450 (СYP2C9, СYP2C19 и СYP2EI).
Серотониновый рецептор (HTR6).
Участие в регулирующем действии на метаболизм посредством вышеперечисленных рецепторов и ферментных систем у соединения cv-150 предполагается наличие in vivo гипогликемического, гепатопротекторного, антиоксидантного, антиишемического и антидепрессантного эффектов. Воздействие на рецептор к глюкокортикоидам позволяет предположить наличие возможности регулировать метаболические нарушения, вызванные этим классом соединений.
В последние годы в научных публикациях встречаются данные о наличии гепатопротекторной активности некоторых производных цианотиоацетамида [24], [25], [26], [27]. В частности, влияние на размер некоторых долей печени соединения с лабораторным шифром cv-150 [24]. Учитывая ключевую роль печени в метаболизме, можно предположить регулирующее воздействие на патогенез СД исследуемого соединения посредством влияния на этот орган.
6. Материалы и методы
Цель работы – провести сравнительный анализ динамики изменения массы тела и уровня глюкозы крови крыс разных возрастных групп на четырех моделях сахарного диабета на фоне фармакокоррекции новым производным пиридина.
Исследования проводили в соответствии с правилами качественной лабораторной практики при проведении доклинических исследований в РФ (Приказ Министерства здравоохранения и социального развития Российской Федерации от 23 августа 2010 г., №708н), а также правилами и Международными рекомендациями Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997 г.). Дизайн эксперимента был рассмотрен и одобрен на заседании локального этического комитета ГУ ЛНР «ЛГМУ им. Св. Луки», протокол № 03/19. Для эксперимента использовались белые беспородные крысы самцы разных возрастов, полученные из вивария ГУ ЛНР «Луганский государственный медицинский университет имени Святителя Луки» в осенне-зимний период. Животные содержались в одинаковых условиях и получали корм и воду в неограниченном количестве.
Эксперимент проводился в несколько этапов. Первая группа состояла из 3-х месячных животных, что соответствует периоду полового созревания, вторая из 18-ти месячных периода выраженных старческих изменений [28].
Группа молодых животных состояла из 50 особей, которые были разделены на 5 групп по 10 особей в каждой. Первая группа состояла из интактных животных. Во второй группе моделировался «дитизоновый» СД путем однократного внутрибрюшинного введения водной суспензии дитизона из расчета 35 мг/кг массы тела [11]. Третья группа представляла собой модель «аллоксанового» СД, воссозданная путем трехкратного введения во внутрибрюшинное пространство натощак водной суспензии аллоксана, в дозах 50, 70 и 50 мг/кг массы животных с недельным промежутком. Такой режим дозирования нами был выбран для получения СД в субкомпенсированной форме [16]. В четвертой группе создавался принципиально новый подход к моделированию «стрептомицинового» диабета. Поскольку в оригинальной методике были представлены данные, с нашей точке зрения не убедительные (уровень глюкозы 7,22 ммоль/л) [18], нами было принято решение увеличить дозу стрептомицина с 15 до 115 мг/кг массы тела животного. Количество дней ежедневных внутримышечных инъекций соответствовало оригинальной методике и составило 28 дней [18]. В пятой группе животных воспроизводился «дексаметазоновый» сахарный диабет путем в/м введения дексаметазона из расчета 125 мкг/кг массы животного [20], [22]. После 28 дней наблюдения все животные 4 опытных групп, на которых воссоздавался та или иная модель СД, были разделены на контрольные и опытные подгруппы. Контрольные подгруппы представляли собой группы сравнения, а опытные получали в качестве фармакокоррекции ежедневно перорально посредством желудочного зонда новое соединение с лабораторным шифром cv-150 в виде водной суспензии из расчета 1мг/кг массы тела в течение 2-х недель.
Группа 18-ти месячных животных состояла из 41 особи, которые были разделены изначально на 2 группы. Первая группа состояла из интактных животных в количестве 12 особей. Вторая группа составляла 29 животных, на которых проводилось моделирование «дексаметазонового» сахарного диабета по стандартной методике. Крысам вводили во внутрибрюшинное пространство дексаметазон из расчета 125 мкг/кг массы тела на протяжении 13 суток [11]. На 14 сутки группа животных, у которых был смоделирован стероидный СД, была разделена на контрольную и опытную подгруппы. Контрольная подгруппа представляла собой группу сравнения, а опытная получала в качестве фармакокоррекции ежедневно перорально посредством желудочного зонда новое соединение с лабораторным шифром cv-150 в виде водной суспензии из расчета 1мг/кг массы тела в течении 3-х недель.
На протяжении всего эксперимента проводилось еженедельное взвешивание животных как с целью изучения динамики изменения массы тела крыс, так и с целью корректировки доз диабетогенных и фармакокорректирующего веществ. По окончанию процессов моделирования СД был взят предварительный анализ крови из хвостовой вены для определения уровня глюкозы крови. По окончанию этапа фармакокоррекции после проведения последнего контрольного взвешивания животных был произведен забой животных под эфирным наркозом и взятием крови для конечного определения уровня глюкозы.
На 27 и 28 день эксперимента при моделировании дексаметазонового диабета у молодых животных была зарегистрирована гибель двух крыс. На 35 день эксперимента у молодых животных в контрольной группе (получавшие декасаметазон на протяжении 28 дней) погибло 1 животное. На 21-й и 22-й день эксперимента после моделирования СД у возрастных животных в контрольной группе (получавшая 13 дней дексаметазон) погибло 3 животных. В интактных и опытных группах, получавших фармакокоррекцию, смертность зарегистрирована не была. Все погибшие животные погибли от осложнений дексаметазонового СД.
7. Результаты и их обсуждение
На первых этапах моделирования СД, несмотря на существенную разницу методик, наблюдалась определенная динамика визуальных изменений внешнего вида и поведенческих реакций животных, характерных для патогенеза вызываемого заболевания. При наблюдении за крысами отмечались внешние признаки нарушения обмена веществ в виде появления незаживающих ран и язв, гангренозные изменения хвоста и конечностей. Изменение аппетита и появление жажды, что было видно по интенсивности поглощения пищи и воды. Изменения шерстяного покрова, вплоть до появления аллопеции, а также агрессивное поведение наблюдались во всех контрольных группах, особенно у животных, получавших дексаметазон. Как оказалось, возрастной фактор вносил существенные изменения на скорость нарушения и восстановления метаболизма крыс на различных этапах эксперимента, в частности при моделировании «стероидного» диабета. Динамика ухудшения состояния животных на этапе моделирования и улучшения вышеизложенного состояния на этапе фармакокоррекции новым производным пиридина была различна у молодых и старых животных, однако была несомненна. Не вызывали сомнения и различные регенеративные способности животных в паузе между процессами моделирования СД и процессом лечения. Восстановительные способности молодых особей были безусловно выше.
Тяжесть течения заболевания корреляционно подтверждалась динамикой изменения массы тела крыс и изменениями уровня глюкозы крови. Результаты измерения промежуточного (предварительного) и конечного уровня глюкоза отображены в табл. 1.
Таблица 1 - Сравнительная характеристика показателей уровня глюкозы в разных экспериментальных группах
Сравнительная характеристика показателей уровня глюкозы в разных экспериментальных группах | |||||||||||
Модели СД 3-х месячных животных | Модели СД 18-х месячных животных | ||||||||||
Вид забора крови | Вид забора крови | ||||||||||
Группа | Предварительный | Конечный | Группа | Предварительный | Конечный | ||||||
3И | M | 3,83 | 3И | M | 4,34 | 18И | M | 5,26 | 18И | M | 5,53 |
m | 0,35 | m | 0,09 | m | 0,21 | m | 0,21 | ||||
n | 10 | n | 10 | n | 12 | n | 12 | ||||
3Д | M | 10,96 | 3ДК | M | 5,68 | 18ДЕ | M | 15,99 | 18ДЕК | M | 11,73 |
m | 0,76 | m | 0,49 | m | 0,93 | m | 0,27 | ||||
n | 10 | n | 4 | n | 29 | n | 9 | ||||
– | – | 3ДО | M | 5,45 | – | – | 18ДЕО | M | 6,47 | ||
– | – | m | 0,61 | – | – | m | 0,48 | ||||
– | – | n | 6 | – | – | n | 17 | ||||
3А | M | 9,70 | 3АК | M | 5,73 | ||||||
m | 0,52 | m | 0,19 | – | |||||||
n | 10 | n | 4 | – | |||||||
– | – | 3АО | M | 4,86 | – | ||||||
– | – | m | 0,69 | – | |||||||
– | – | n | 6 | – | |||||||
3С | M | 11,80 | 3СК | M | 6,38 | – | |||||
m | 0,53 | m | 0,50 | – | |||||||
n | 10 | n | 4 | – | |||||||
– | – | 3СО | M | 5,45 | – | ||||||
– | – | m | 0,57 | – | |||||||
– | – | n | 6 | – | |||||||
3ДЕ | M | 13,23 | 3ДЕК | M | 5,50 | – | |||||
m | 0,53 | m | 0,40 | – | |||||||
n | 8 | n | 3 | – | |||||||
– | – | 3ДЕО | M | 4,85 | – | ||||||
– | – | m | 0,85 | – | |||||||
– | – | n | 4 | – | |||||||
Примечание: первая цифра в названии группы (3, 18) - возрастная характеристика подопытных животных (в месяцах); второе буквенное обозначение (И, Д, А, С, ДЕ) - название модели сахарного диабета («интактная группа» «дитизоновый», аллоксановый, «стрептомициновый», «дексаметазоновый» диабеты), соответственно; третье дополнительное буквенное обозначение (К, О) - тип подгруппы экспериментальных животных (контрольная и опытная), соответственно; M - среднее значение (ммоль/л); m - стандартная ошибка; n - количество животных
Согласно предварительным результатам анализа уровня глюкозы крови, взятых после моделирования СД, был зафиксирован рост этого показателя у всех групп, получавших диабетогенные вещества. Максимальный абсолютный показатель гликемии был зафиксирован в обеих вариантах моделирования «стероидного» сахарного диабета. У 1,5 летних животных уровень гликемии был существенно выше, чем у 3-х месячных животных, несмотря на меньшую продолжительность воздействия дексаметазона. С неожиданно высоким показателем гликемии оказались животные, получавшие стрептомицин, учитывая тот момент, что нами не было найдено литературного подтверждения наличия диабетогенного воздействия этого антибиотика на организм человека. Исходя из показателей уровня глюкозы в крови, в сравнении с контрольными группами, зафиксированных после фармакокоррекции новым химическим соединением с лабораторным шифром cv-150, была зафиксирована его гипогликемическая активность на фоне диабетогенного действия всех применяемых нами соединениями. Максимальную разницу между опытной и контрольной подгруппами молодых животных этот показатель составил на моделях «аллоксанового» и «стрептомицинового» диабетов (17,9 и 17,1 ммоль/л соответственно). У молодых животных с «дексаметазоновым» диабетом разница между контрольной и опытной группами составила 13,4%, что тоже является достоверным отличием, но оно не идет ни в какое сравнение с данными по животным периода старческих изменений. Разница по этим группам составила 81,3%, в сторону снижения уровня гликемии у крыс, получавших опытное соединение, что говорит о высокой гипогликемической активности вещества. Следует отметить, что действие диабетогенных веществ оказались обратимым и, по-видимому, не привели к абсолютной инсулиновой недостаточности. Уровень глюкозы крови нормализовался практически до нормальных значений, кроме группы 18-месячных животных. Однако, на фоне фармакокоррекции новым гидрированным пиридином под лабораторным шифром cv-150, уровень гликемии был достоверно ниже соответствующих контрольных групп.
Вызывает интерес динамика изменения массы тела в ходе эксперимента, поскольку этот показатель косвенно характеризует состояние метаболических процессов в организме. На графике 1 отображена динамика изменения массы тела 3-месячных крыс на этапе моделирования разных типов сахарного диабета. Учитывая молодой возраст животных, является вполне обоснованным их активный рост и набор веса. Примечательно, что самым активным набором веса характеризовались животные, получавшие стрептомицин. Набор веса у этой группы был выше, чем у группы интактных животных. Что касается животных, получавших в качестве диабетогенных веществ аллоксан и дитизон, то набор массы тела был менее интенсивен чем в группе сравнения, а на последних неделях эксперимента средняя масса животных стабилизировалась. У группы животных, получавших дексаметазон на протяжении 28 суток на протяжении всего эксперимента, динамика изменения массы тела не характеризовалась ее увеличением, а порой даже носила отрицательный характер.
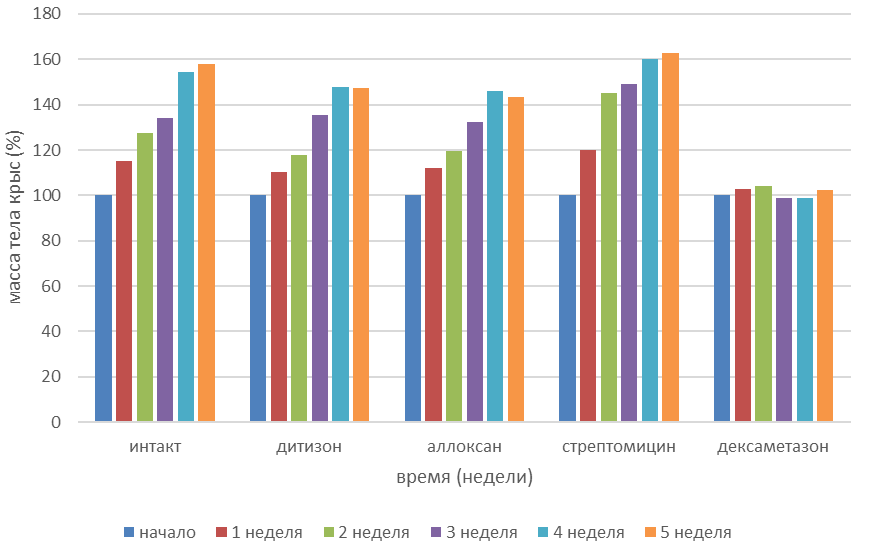
Рисунок 2 - Динамика изменений массы тела 3-месячных крыс на этапе моделирования СД
На графике 2 отображена динамика изменения массы тела животных, получавших в качестве фармакокоррекции новое химическое соединение cv-150 в сравнении с группами контроля (соответствующих моделей без фармакокоррекции) и интактной группой. Вес животных, получавших дитизон без фармакокоррекции продолжил находиться в состоянии отсутствия какой-либо динамики, что для молодых животных не является характерным. Группа животных с дитизоновым сахарным диабетом, получавших соединение cv-150, на второй неделе фармакокоррекции резко прибавили в весе. В группе аллоксанового диабета ситуация была обратной – контрольная группа начала постепенный набор веса, а опытная группа на фоне соединения cv-150, резко потеряла в весе на второй неделе эксперимента. Группы, получавшие стрептомицин, продолжили увеличивать массу тела, в независимости от фармакокоррекции, примерно в том же темпе, что и на этапе фармакокоррекции. Самым интересным, на наш взгляд, является динамика изменения массы тела крыс, получавших дексаметазон. Как мы помним, на фоне ежедневных инъекций дексаметазона динамика изменения массы тела у крыс отсутствовала. После прекращения введения дексаметазона животные стали резко набирать вес, что характерно для синдрома отмены дексаметазона. В опытной дексаметазоновой группе на фоне ежедневного приема производного частично гидрированного пиридина cv-150, увеличение массы тела была менее выраженной.
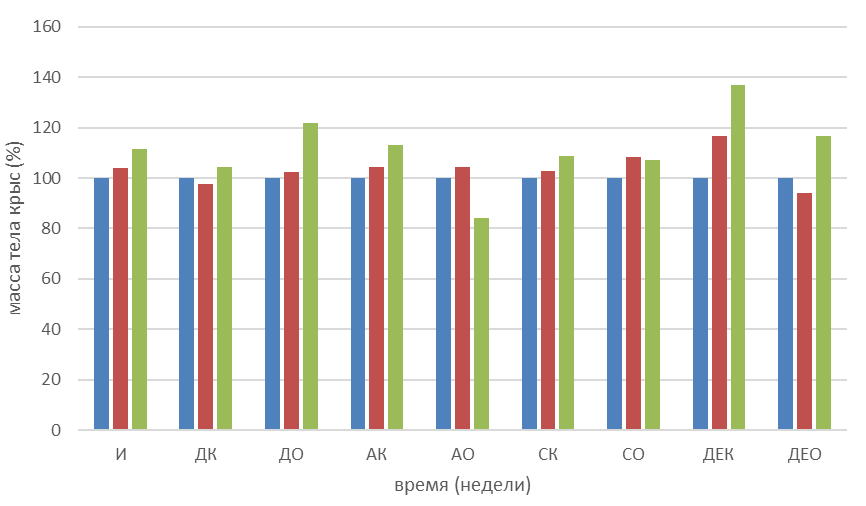
Рисунок 3 - Динамика изменений массы тела 3-месячных крыс на этапе фармакокоррекциии соединением cv-150
Динамика изменения массы тела 18-месячных крыс отображена на графике 3. Как и ожидалось, она существенно отличается от динамики молодых животных. Во-первых, скорость набора массы тела у интактных животных этого возрастного периода существенно меньше, чем у животных периода половозрелости, и обычно составляет 0,01-0,2% в день [28]. Данный эксперимент подтвердил эту справочную информацию. Что касается влияния дексаметазона на изменения массы тела, то они тоже существенно иные. Если при действии на молодых животных масса тела в принципе не менялась, то старые животные реагировали существенным снижением массы тела. На графике видно, что начиная с 3 недели, когда животным было прекращено введение дексаметазона и начата фармакокоррекция новым соединением cv-150, они постепенно перешли на режим набора массы тела. Вероятно, это тоже объясняется синдромом отмены глюкокортикостероидов. Однако протекало это не так интенсивно, как в группе с молодыми животными. Но даже здесь на фоне лечения новым производным частично гидрированных пиридинов, процесс набора массы тела был менее резок.
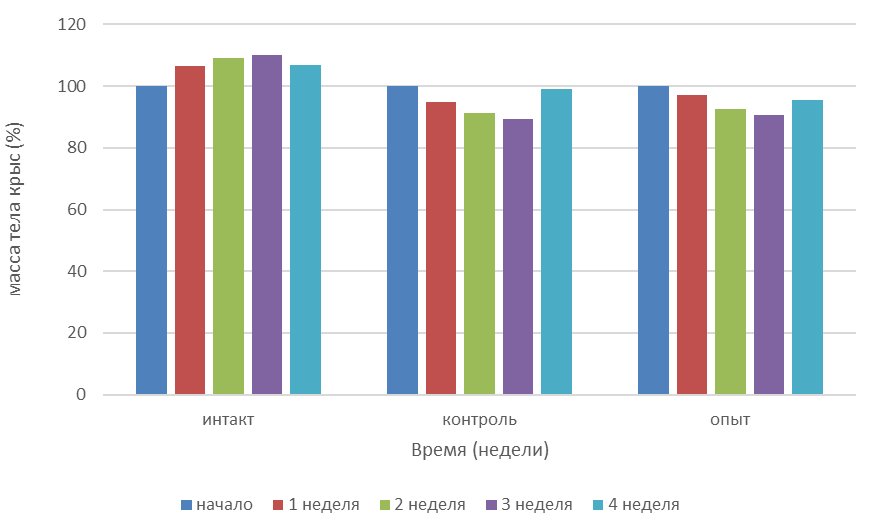
Рисунок 4 - Динамика изменения массы тела 18-месячных крыс на фоне моделирования дексаметазонового СД с последующей фармакокоррекцией соединение cv-150
8. Заключение
Все испытанные нами диабетогенные соединения способны моделировать СД в субкомпенсированной форме как у животных молодого, так и старшего возраста. Эксперимент подтвердил предположение, что антибиотик из группы аминогликозидов стрептомицин обладает ранее неизвестным диабетогенным действием. Это подтверждает уровень глюкозы крови подопытных животных, который составляет 11,8 ммоль/л при использовании внутримышечных инъекций на протяжении 28 суток в дозе 115 мг/кг массы тела животного. По нашему мнению, дальнейшие испытания других антибиотиков на наличие диабетогенного действия, является актуальной задачей современной фармакологии.
Из всех испытанных нами моделей, наиболее актуальными и эффективными являются модели стероидного сахарного диабета. Из различных вариантов моделирования стероидного сахарного диабета с целью испытания потенциально новых лекарственных веществ наиболее эффективным является воспроизведение методики на 18-ти месячных крысах-самцах путем парентерального введения дексаметазона в дозе 125 мкг/кг массы животного на протяжении 13 суток.
Соединение из группы частично гидрированных пиридинов, производных цианотиоацетамида, с лабораторным шифром cv-150, проявило выраженное гипогликемическое действие на всех испытанных нами моделях сахарного диабета. Согласно визуальным наблюдениям за психосоматическим состоянием и динамикой изменения массы тела животных с сахарным диабетом отмечено положительное влияние этого соединения на метаболические процессы подопытных животных. Также, это соединение оказывает, по-видимому, коррекцию метаболических нарушений, вызванных синдромом отмены дексаметазона, что было отмечено в разных возрастных группах животных.
Актуальным следует считать дальнейшее исследование различных видов фармакологических активностей частично гидрированного пиридина производного цианотиоацетамида, с лабораторным шифром cv-150, в связи с широким применением дексаметазона и других глюкокортикоидов.
