Morphological features of prenatal organogenesis of rat lungs under the influence of the L-type potential-dependent calcium channel blocker dihydropyridine derivative nimesulide
Morphological features of prenatal organogenesis of rat lungs under the influence of the L-type potential-dependent calcium channel blocker dihydropyridine derivative nimesulide
Abstract
The effect of the hypotensive drug nimesulide, a blocker of potential-dependent calcium channels L-type dihydropyridine derivative, on morphological features of prenatal organogenesis of lungs of Wistar rat fetuses was studied. Four groups of 25 fetuses each from 13 days old to 21 days old were studied. Fetuses of experimental groups received therapeutic, subtoxic and toxic doses of nifedipine. The analysis of the obtained data indicates the dose-dependent nature of the negative effect of the studied hypotensive drug on lung organogenesis, which is confirmed by the studied parameters. The therapeutic dose of nifedipine has no statistically significant effect on lung organogenesis. Subtoxic dose slows down lung development after the 19th day of prenatal organogenesis. By the 21st day, a decrease in the diameter of the air-conducting and respiratory sections and single haemorrhages in the lung stroma are recorded. A toxic dose of nifedipine leads to thinning of the bronchial wall due to the absence of smooth muscles and cartilage in medium calibre bronchi, as well as narrowing of the lumen. The diameter of intrapulmonary bronchi is 29,27±0,01% smaller and their specific area is reduced by 31,11±0,01% compared with the lungs of intact rat fetuses. Reduction of air-conducting and respiratory sections and predominance of interstitium were noted. Small haemorrhages are present throughout the interstitium and in the lumen of single bronchi.
1. Введение
Время внутриутробной закладки и созревания легких является важнейшим этапом онтогенеза дыхательной системы, обусловливающей выполнение жизненно важной функции газообмена и существования организма в течение постнатальной жизни. Осложнение течения беременности артериальной гипертензией признано одной из главных причин материнской смертности и детской перинатальной патологии. Она наблюдается у 5-20% беременных, при этом в 30% случаев диагностируется хроническая артериальная гипертензия, а в 70% – гестационная артериальная гипертензия, преэклампсия и эклампсия . Терапия артериальной гипертензии жизненно необходима, однако все антигипертензивные препараты в той или иной степени проникают через плаценту и потенциально способны прямо или опосредованно через материнский организм оказывать влияние на плод . В соответствии с рекомендациями FDA (Food and Drug Administration), определяющими возможность применения фармакологических препаратов при беременности, препараты из группы блокаторов кальциевых каналов по действию на плод относятся к категории C . В исследованиях на животных выявлены побочные реакции у плода при назначении препаратов категории С . Контролируемых исследований на беременных женщинах, принимавших блокатор кальциевых каналов нифедипин, не проводилось, но исходя из исследований на животных, существует рекомендация не применять этот гипотензивный препарат в первом триместре беременности , . Лекарства этой категории могут назначаться только при условии, что польза от назначения этого препарата превышает риск для плода , .
Нифедипин – блокатор кальциевых каналов L-типа (long-lаsting large-capacitance, от англ. long-lаsting – долгоживущий, large – большой; имеется в виду проводимость канала), способен задерживать проникновение ионов кальция в гладкие мышечные клетки кровеносных сосудов по этим «медленным» каналам клеточных мембран. Препарат вызывает артериальную вазодилатацию, уменьшает общее периферическое сопротивление сосудов и снижает артериальное давление . В связи с вышеизложенным, цель данной работы – изучить морфологические особенности пренатального органогенеза легких крыс под влиянием блокатора потенциал-зависимых кальциевых каналов L-типа производного дигидропиридина нимесулида.
2. Материал и принципы исследования
В исследовании использованы 100 легких плодов самок белых крыс породы «Вистар», полученных в контрольной группе и трех экспериментальных группах в возрасте 13, 15,17, 19 и 21 сутки. Три опытные группы составили крысы, получавших терапевтическую, субтоксическую и токсическую дозу нифедипина. Животных с датированным сроком беременности получали при помощи метода ежедневного изучения вагинальных мазков . Эксперименты выполняли с соблюдением принципов гуманности, изложенных в директиве Европейского Сообщества (86/609/ЕС), и согласно «Правилам проведения работ с использованием экспериментальных животных».
Расчет доз нифедипина (Коринфар, производство AWD pharma, Германия) проводился с учетом рекомендаций .
Формула для расчета:
Где r – коэффициент видовой выносливости для крысы = 3,62.
R – коэффициент видовой выносливости для человека = 0,57.
Расчет доз нифедипина производился исходя из терапевтической, субтоксической и токсической доз для человека. Терапевтическая доза для человека составляет 20мг/кг, для крысы она составила 127мг/кг, субтоксическая доза для человека – 80мг/кг, для крысы она составила 508мг/кг, токсическая доза для человека – 120мг, для крысы она составила 762мг/кг.
Изучаемое вещество вводили самкам с восьмого дня беременности однократно в одно и то же время суток, внутрижелудочно при помощи зонда. В каждой группе, по достижении самками 13, 15, 17, 19 и 21 суток беременности проводили выведение их из эксперимента путем декапитации под эфирным наркозом. Учитывая наличие циркадных ритмов, забой проводили в одно и то же время. Проводилось вскрытие брюшной полости и рогов матки. Зародышей извлекали, подвергали внешнему осмотру и быстро фиксировали 10% нейтральным формалином. Материал заключали в парафин и из него изготовляли серийные срезы толщиной 5 мкм. Парафиновые срезы наносились на предметные стекла с адгезивным покрытием полилизином и высушивались в термостате в течение 48-72 часов при температуре 42º-45ºС. Обзорные препараты окрашивали гематоксилином и эозином.
Диаметр внутрилегочных бронхов и площадь, занимаемую бронхами, измеряли с помощью программы "ImageJ" при общем увеличении в 400 раз светового микроскопа «Олимпус» СХ40 по 50 измерений на срез. Удельную площадь бронхов рассчитывали в процентах от площади легких в срезах. Сравнения статистических выборок диаметров бронхов и удельной площади бронхов по отношению к контрольной группе в каждом изученном сроке органогенеза легких или по отношению к каждому показателю в срезах предыдущего срока проводили, используя программу MS Office Excel 2007 и STATISTICA 10,0 Enterprise (StatSoft Inc., США), с помощью критерия Манна-Уитни (U-критерий) со степенью достоверности различий p=0,05.
Статистическая обработка включала проверку на нормальность распределения по критерию Шапиро-Уилка, критерий Манна-Уитни для попарных сравнений, а групповые данные описывались с помощью медианы, первого и третьего квартилей (интерквартильный размах).
3. Основные результаты
У зародышей всех 4-х изученных групп до 15-ти суток пренатального развития железистая стадия органогенеза легких происходила идентично. Морфологические особенности органогенеза выявлены только начиная с 17-х суток гестации.
В контролена 17-е сутки в легких, имеющих по своему строению сходство с развивающейся экзокринной железой, просвет бронхов 1-го и 2-го порядков закономерно расширяется по сравнению с 15-ми сутками гестации, бронхи 3-го и 4-го порядков также удлиняются и увеличиваются в диаметре. Все отделы бронхиального дерева выстланы многорядным призматическим эпителием, высота которого уменьшается в дистальном направлении, и заполнены жидкостью (рис. 1а). При этом в крупных бронхах наблюдается хорошо выраженная складчатость слизистой оболочки, в бронхах мелкого калибра 5-го и 6-го порядков она отсутствует. В мелких бронхах формируется просвет, выстланный кубическими эпителиоцитами. Ядра центрально расположены, круглые, лежат в два ряда. В стенке бронхов 1-го и 2-го порядков присутствуют удлиненные молодые фибробласты, лежащие в 2-3 слоя и ориентированные циркулярно вокруг базальной мембраны эпителия. Эмбриональная соединительная ткань, составляющая строму развивающихся легких, имеет типичное строение и выполняет пространство между ветвями бронхиального дерева. Четко выражено дольчатое строениелегких. Хорошо сформированы стенки кровеносных сосудов. Сосуды заполнены кровью.
В этом сроке гестации на фоне терапевтической дозы нифедипина, введенного беременным самкам крыс, не обнаруживается отставания в развитии органа. Легкие сохраняют железистое строение. Присутствуют бронхи всех порядков ветвления как результат дихотомического деления, характерные в норме для данной стадии развития. На срезах в просветах бронхов выявляется нежная оксифильная сеточка, образованная присутствующей жидкостью. Заметного изменения морфологии эмбриональной соединительной ткани по сравнению с контрольной группой не отмечается.
Субтоксическая и токсическая доза нифедипина также принципиально не влияют на морфологическое строение легких. Они сохраняют железистое строение. В просвете бронхов всех шести порядков ветвления имеется жидкость. Однако диаметр бронхов заметно меньше, чем в контрольной группе. Наиболее узкие на срезах легких бронхи присутствуют на фоне введения токсической дозы нифедипина (рис. 1б). Медиана диаметра бронхов контрольной группы на 22,83±0,01% больше по сравнению с таковой после введения токсической дозы лекарственного препарата, а медиана удельной площади бронхов последней группы на 24,21±0,01%меньше, чем в контроле (табл. 1). Эпителиальная выстилка бронхов разного калибра соответствует таковой в контрольной группе и при введении терапевтической дозы нифедипина.
При гистологическом исследовании легких 19 суточных плодов контрольной группы наблюдается появление на концах терминальных бронхиол выпячивания – эпителиальные почки респираторных бронхиол, в которых
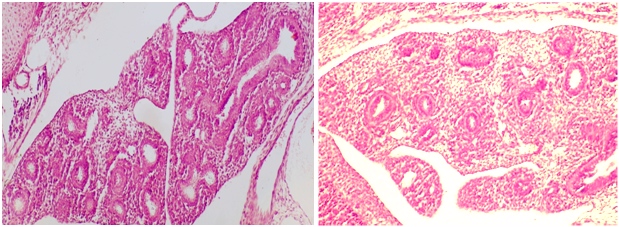
Рисунок 1 - Срез легких плодов крыс в возрасте 17 суток гестации. Закладки лёгких с бронхами второго-шестого порядков ветвления и окружающая эмбриональная соединительная ткань. Окраска гематоксилином и эозином
Примечание: а – Контрольная группа. Увеличение: х150. б – Токсическая доза нифедипина. Увеличение: х100.
Таблица 1 - Сравнения статистических выборок диаметров бронхов и удельной площади бронховв легких контрольной и третьей основной группы (токсическая доза нифедипина)
Сутки | Опытная группа. Токсическая доза нифедипина медиана (1-3 квартили), интерквартильный размах | Контрольная группа медиана (1-3 квартили), интерквартильный размах | P-значение | Изученные структуры |
15 | 363,34 (323,01-400,27)* | 410,10 (356,76-443,15) | <0,01 | Диаметр внутрилегочных бронхов в мкм |
15 | 50,47 (46,23-55,40)* | 66,22 (57,80-69,64) | <0,05 | Удельная площадь бронхов в % |
17 | 386,04 (304,18-421,12)* ** | 500,27 (470,32-526,01)** | <0,01 | Диаметр внутрилегочных бронхов в мкм |
17 | 59,06 (47,05-65,07)* ** | 77,93(65,84-79,02)** | <0,01 | Удельная площадь бронхов в % |
19 | 409,22 (325,16-440,04)* ** | 569,11 (518,11-594,41)** | <0,01 | Диаметр внутрилегочных бронхов в мкм |
19 | 63,41 (58,10-67,81)* ** | 84,17 (78,22-89,90)** | <0,01 | Удельная площадь бронхов в % |
21 | 430,55 (407,15-433,26)* ** | 608,73 (561,01-633,05)** | <0,01 | Диаметр внутрилегочных бронхов в мкм |
21 | 62,05 (53,28-64,01)* ** | 90,07 (84,21-92,03)** | <0,01 | Удельная площадь бронхов в % |
Примечание: *Достоверность различия с контролем, P = 0,05. **Достоверность различия с предыдущим этапом исследования, P = 0,05.
Быстро формируется просвет. Стенка респираторных бронхиол образована однослойным, низким кубическим эпителием. Ядра эпителиальных клеток круглые, цитоплазма окрашена слабо оксифильно. Все отделы бронхиального дерева и респираторные бронхиолы заполнены жидкостью. Респираторные бронхиолы располагаются близко друг к другу, разделены прослойкой эмбриональной соединительной ткани, в которой определяется множество капилляров. Клетки эмбриональной соединительной ткани полиморфны: овальной, круглой, звездчатой формы. Цитоплазма клеток оксифильна, ядра круглые и овальные.
На 19-е сутки пренатального гистогенеза на фоне введения беременным самкам терапевтической дозы нифедипина морфологическая картина легких мало отличается от контроля. Бронхи первых пяти порядков ветвления развиты соответственно возрасту. Они заполнены жидкостью и их просвет по размерам не отличается от контрольной группы. Стенка бронхов образована циркулярно расположенными фибробластами, гладкими мышечными клетками и островками гиалиновой хрящевой ткани. Обращает на себя внимание большее, чем в контрольной группе, присутствие эмбриональной соединительной ткани между закладками бронхов и бронхиол. Кровеносных сосудов много и они заполнены кровью.
Субтоксическая доза нифидипина к 19-м суткам более ярко влияет на органогенез. Наблюдается значительное отставание роста имеющихся бронхов в ширину. Складчатость слизистой оболочки имеется только в бронхах 1-го порядка ветвления (рис. 2а). Просветы бронхов малого калибра не выражены, выглядят, как скопление эпителиальных клеток. Степень дифференцировки эпителия отстает от таковой в легких, развивающихся в условиях отсутствия повреждающих факторов. Объем эмбриональной соединительной ткани уменьшился незначительно в сравнении с предыдущим этапом развития. Интерстиций легких образован толстыми прослойками, состоящими из межклеточного вещества и молодых фибробластов, морфология которых не изменена. В периэпителиальной эмбриональной соединительной ткани обнаружено умеренное количество кровоизлияний.
У плодов крыс 19–ти суток развития под влиянием токсической дозы нифедипина строение и размеры бронхов не соответствуют таковым в контроле. Ветвление бронхов запаздывает, развиваются респираторные бронхиолы, однако они малочисленны и ширина их просветов меньше, чем в контроле (рис. 2б). Медиана диаметра бронхов на 13,55±0,01% меньше по сравнению с контрольной группой (см. табл. 1). Медиана удельной площади бронхов на 24,66±0,01% меньше, чем в контрольной группе. Прослойки эмбриональной соединительной ткани между компонентами бронхиального дерева и формирующимися легочными ацинусами обширные и слабо васкуляризированы. В ней присутствуют множественные мелкие кровоизлияния.
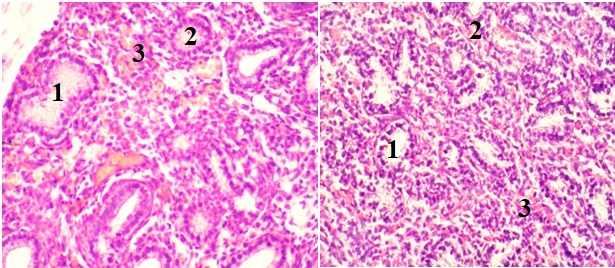
Рисунок 2 - Срез легких плодов крыс в возрасте 19 суток гестации. Закладки лёгких с бронхами среднего (1) и малого (2) калибра и окружающая эмбриональная соединительная ткань с очаговыми кровоизлияниями (3). Окраска гематоксилином и эозином
Примечание: а – Субтоксическая доза нифедипина. б – Токсическая доза нифедипина. Увеличение: х150.
В легких 21 суточных плодов развивавшихся в условиях введения нифедипина наблюдается схожая дозозависимая морфологическая картина. В этом возрасте обнаруживается заметное влияние нифедипина на развитие легких. При введении терапевтической дозы бронхиальное дерево имеет все имеющиеся в контроле отделы. Стенка крупных бронхов имеет гиалиновые полукольца, пластинки и гладкие мышцы. Жидкость в просвете бронхов присутствует. Сформированы альвеолярные ходы и мешотчатые расширения. Однако их меньше и просвет значительно уже, чем у плодов, развивавшихся в нормальных условиях. На фоне субтоксической дозы нифидипина бронхиальное дерево сформировано, заполнено жидкостью, но стенка бронхов тоньше и не имеет всех положенных компонентов. Компоненты респираторного отдела легких разделены очень толстыми прослойками эмбриональной соединительной ткани. Кровеносные сосуды переполнены кровью. При введении токсической дозы нифедипина строение и размеры бронхов не соответствуют таковым в контроле. Медиана диаметра бронхов на 29,27±0,01% меньше по сравнению с контрольной группой (см. табл. 1). Медиана удельной площади бронхов на 31,11±0,01% меньше, чем в контрольной группе. Гладкие мышцы и гиалиновые пластинки выявляются только в самых крупных внутрилегочных бронхах. Ветвление бронхов запаздывает, развиваются респираторные бронхиолы, однако они малочисленны и ширина их просветов отстает по сравнению с контрольной группой (рис. 3б). Закладки альвеол отсутствуют. Прослойки эмбриональной соединительной ткани истончились, но недостаточно, чтобы соответствовать контрольным. Промежутки между бронхами остаются достаточно широкими. Обнаруживаются единичные кровоизлияния в интерстициальную ткань и в просвет бронхов.
4. Обсуждение
Фармакологическое и тератогенное действие блокатора кальциевых каналов нифедипина на плод изучено недостаточно. Поэтому врач, назначающий этот лекарственный препарат, берет на себя ответственность за жизнь и здоровье не только матери, но и плода .
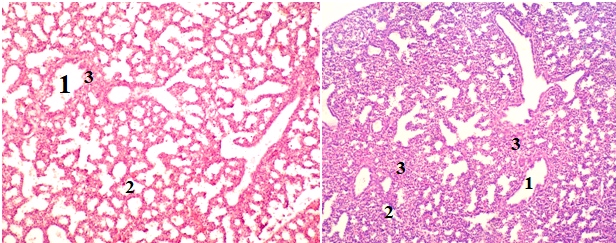
Рисунок 3 - Срез легких плодов крыс в возрасте 23 суток гестации. Закладки лёгких с бронхами среднего (1) и малогокалибра (2) и окружающая эмбриональная соединительная ткань (3). Окраска гематоксилином и эозином
Примечание: А – Контрольная группа. Б – Токсическая доза нифедипина. Увеличение: х150.
Феномен морфогенеза ветвления презумптивного эпителия – фундаментальный процесс, характеризующий не только развитие легких, но и ряда других органов .
Вместе с тем, введение терапевтической дозы нифедипина еще не приводит к заметным морфологическим изменениям в закладках легких по сравнению с контрольной группой. Субтоксическая доза вызывает мало заметные изменения. Ветви бронхов соответствуют контролю, но диаметр бронхов несколько сужен. При воздействии токсической дозы нифедипина наблюдается уменьшение количества бронхов малого калибра и терминальных бронхиол, что согласуется с данными NawalAhmedSaidetal . Бронхи имеют меньший диаметр, чем в контроле. К 21-м суткам разница с контрольной группой составляет почти треть – 29,27±0,01%, а удельная площадь, занимаемая бронхами снижена на 31,11±0,01%. Эти же авторы указывают, что дополнительные данные производителя препарата в виде отчета в контролирующие органы (информация, предоставляемая врачам) указывают на тератогенный потенциал этого лекарственного препаратаи отмечают, что нарушения постнатального развития возникают даже при суточной субтоксической дозе 30 мг/кгв 1 день между 10 и 16 днями беременности. Однако они касаются дефектов скелета пальцев, т.е. гиперфалангию, укорочения конечностей, олигодактилии, укорочения хвоста и появления гематом. В наших исследованиях мы также приводим данные о появлении гематом в легких после приема субтоксической и токсической дозы нифедипина.
В рекомендациях Замалеевой Р. С., Черепановой Н. А. с соавт., 2021 предлагается не применять нифедипин в первом триместре беременности. По результатам нашего исследования мы не обнаружили значимую разницу в закладке и органогенезе легких мышей при применении терапевтической, субтоксической и токсической дозе нифедипина, начиная с 13-ти суток пренатального онтогенеза, когда проявляются первые структуры закладки легких и их дальнейшее развитие.
5. Заключение
Развитие легких у плодов крыс при введении блокатора кальциевых L-каналов нифедипина имеет дозозависимый характер. Терапевтическая доза нифедипина не оказывает статистически значимого влияния на органогенез легких. Субтоксическая доза замедляет развитие легких после 19-х суток пренатального органогенеза. К 21-м суткам фиксируется уменьшение диаметра воздухопроводящего и респираторного отделов и единичные кровоизлияния в строму легких. Токсическая доза нифедипина приводит к истончению стенки бронхов за счет отсутствия гладких мышц и хрящей в бронхах среднего калибра, а также сужения просвета. Диаметр внутрилегочных бронхов на 29,27±0,01% меньше, а их удельная площадь снижена на 31,11±0,01% по сравнению с легкими интактных плодов крыс. Отмечается редукция воздухопроводящих и респираторных отделов, а также преобладание интерстиция. Мелкие кровоизлияния имеются по всему интерстицию и в просветах единичных бронхов.
