Application of the generalized desirability method in the development of substrate formulations for oral dispersible films based on the substance 2-ethyl-6-methyl-3-hydroxypyridine succinate
Application of the generalized desirability method in the development of substrate formulations for oral dispersible films based on the substance 2-ethyl-6-methyl-3-hydroxypyridine succinate
Abstract
This research aims to develop the composition and technology of soluble substrates used in the preparation of films dispersible in the oral cavity using ink jet printing. The substrates are used to apply a solution containing an active pharmaceutical substance (APS) using ink jet printing technology to produce dose-variable drug films by varying the printing area and density. Film forming polymer and plasticizers were used to develop model substrate formulations. Commercially available substrates consisting of starch paper, rice paper or sugar paper were also used. The model samples were compared in terms of tensile strength, fracture resistance, disintegration time, loss in mass on drying, and release of 2-ethyl-6-methyl-3-hydroxypyridine succinate APS in 3 min. Once the results were obtained, they were converted to a dimensionless scale using Harrington's partial desirability and generalized desirability was calculated using ranking by importance of factors. The generalized desirability analysis identified formulations that met the optimum performance, among them the formulation produced by pour-on-dry technology and from commercially available substrate in the form of printing paper.
1. Введение
В настоящее время все большее развитие получают направления медицины, связанные с персонализированной медициной и, в частности, с разработкой лекарственных форм (ЛФ), имеющих возможность «гибкого» изменения дозы. Среди методов получения лекарственных средств (ЛС), обладающих данными свойствами, следует выделить методы трехмерной и струйной печати, где дозы активной фармацевтической субстанции (АФС) регулируются за счет размера и плотности нанесения полупродукта при формировании ЛФ
, , . Струйная, или двухмерная, печать отличается большей дешевизной и простотой приготовления ЛФ и представляет собой метод, в котором на растворимую или биодеградируемую подложку наносят раствор, содержащий АФС , . В соответствии с особенностями приготовления основные характеристики ЛФ зависят от свойств подложек, на которые наносится раствор . Поэтому при разработке модельных ЛФ пленок, диспергируемых в полости рта на основе 2-этил-6-метил-3-гидроксипиридина сукцината (ЭГПС), получаемых с помощью метода двумерной печати, уделяли особенное внимание разработке и исследованию подложек для печати.АФС ЭГПС обладает широким спектром фармакологической активности от нейропротекторной, антиишимической до противовоспалительной и применяется в кардиологии, неврологии, наркологии, офтальмологии со своими схемами лечения, вследствие чего существует необходимость в создании лекарственного препарата (ЛП), обладающего свойствами индивидуализации в виде пленок, диспергируемых в полости рта.
Цель данной статьи заключается в разработке состава и технологии получения подложек, обладающих удовлетворительными фармацевтико-технологическими характеристиками с использованием функции обобщенной желательности для дальнейшего изготовления пленок ЭГПС, диспергируемых в полости рта.
2. Методы и принципы исследования
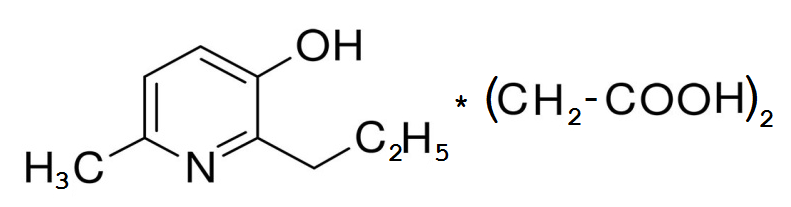
Рисунок 1 - Структурная формула 2-этил-6-метил-3-гидроксипиридина сукцината
Таблица 1 - Физико-химические свойства соединения 2-этил-6-метил-3-гидроксипиридина сукцинат
№ | Показатели | Размерность | Результаты |
1 | Молекулярная масса | г/моль | 255,55 |
2 | pH, 1% раствора | – | 4,59±0,5 |
3 | Растворимость в воде | – | 1:5 |
4 | Растворимость в спирте | – | 1:5 |
5 | Температура плавления | °С | 109-115 |
Вспомогательные вещества (ВВ): гидроксипропилметилцеллюлоза 3, 6, 15 (ГПМЦ, VIVAPHARM® HPMC E 3, VIVAPHARM® HPMC E 6, VIVAPHARM® HPMC E 15, Hypromellose, Ph. Eur., USP, JP, E 464, FCC, тип 2910, JRS Pharma, Германия), гидроксипропилметилцеллюлоза K100LV (Benecel™ HPMC K100LV Ashland™, США); полипропиленгликоль (1,2 Propylene glycol USP, BASF, SE, Ludwigshafen, Germany), глицерин (Глицерин безводный pure EP, USP (pharma grade), neoFroxx GmbH, Einhausen, Germany), Твин 80 (Полисорбат 80, EMPROVE® ESSENTIAL, Sigma-Aldrech, a subsidiary of Merck KGaA, Burlington, MA, USA), рисовая бумага (Sen Soy Premium, ООО «ТД «СОСТРА-РУС», Hiep Long – Hanoi Foods JSC, Вьетнам); крахмальная бумага (вафельная бумага, DecoLand®, 0,35 мм, Jiaxing YueAn Foods Со., Ltd, КНР); крахмальная бумага (вафельная бумага, DecoLand®, 0,6 мм, Jiaxing YueAn Foods Со., Ltd, КНР); сахарная бумага (Modecor DecoLand®, Jiaxing YueAn Foods Со., Ltd, КНР).
Используемое оборудование и методики: Методика определения распадаемости (ОФС.1.4.2.0013., ГФ XV) – тестер распадаемости PTZ-S (Pharma Test, Германия); потеря в массе при высушивании (ОФС.1.2.1.0010.15, ГФ XV) – анализатор влажности Sartorius MA-35 (Sartorius AG, Германия); предел прочности на растяжение AnD MCT-2150 универсальное устройство для испытаний; термоструйный принтер Canon PIXMA TS5040 (Canon Inc, Tokyo, Japan), оснащенный печатающей головкой QY6-0089-000000, тестер растворения – Laboao RC-6D (Zhengzhou laboao instrument equipment co., ltd, Китай); спекторофотометр ПЭ-5400УФ (Экрос, Россия), магнитной мешалке ЭКРОС-6113Н (Экрос, Россия).
Предел прочности на разрыв
Пленки крепятся на зажимах, которые впоследствии отодвигаются друг от друга со скоростью ползуна 50 мм/мин до разрыва пленки, таким образом определяется прочность на разрыв (Н/мм2).
Сопротивление излому
Сопротивление излому или устойчивость к складыванию – еще одна процедура оценки механических свойств пленки и используется для измерения гибкостью пленки. Измеряют путем многократного складывания пленки в одной и той же точке до тех пор, пока она не порвется. Значение устойчивости к складыванию определяется количеством сгибаний пленки без разрывов. Более высокое значение сопротивления излому указывает на более высокое значение механической прочности пленки
.Количественное определение АФС в пленках
Количественное определение ЭГПС проводят с помощью метода УФ-спектрофотометрии. Анализ проводили на спектрофотометре ПЭ-5400УФ (Россия).
Около 0,3 г (точная навеска) порошка растертых пленок помещают в мерную колбу вместимостью 100 мл, прибавляют 60 мл 0,01 М раствора кислоты хлористоводородной, взбалтывают в течение 10 мин, доводят объем суспензии 0,01 М раствором кислоты хлористоводородной до метки, перемешивают и фильтруют через бумажный фильтр, отбрасывая первые 10 мл фильтрата. 1 мл полученного фильтрата переносят в мерную колбу вместимостью 100 мл, доводят объем раствора 0,01 М раствором кислоты хлористоводородной до метки и перемешивают (испытуемый раствор).
Измеряют оптическую плотность испытуемого раствора на спектрофотометре в максимуме поглощения при длине волны 297 нм в кювете с толщиной слоя 10 мм. Параллельно в тех же условиях измеряют оптическую плотность раствора РСО ЭГПС. В качестве раствора сравнения используют 0,01 М раствор кислоты хлористоводородной.
Содержание ЭГПС в одной таблетке в граммах (X) вычисляют по формуле (1).
где D1 – оптическая плотность испытуемого раствора;
D0 – оптическая плотность раствора РСО ЭГПС;
а0 – навеска РСО ЭГПС, в граммах;
а1 – навеска порошка растертых пленок, в граммах;
b – средняя масса таблетки, в граммах.
Содержание С8Н11NO • С4Н6O4 (ЭГПС) должно быть от 0,119 г до 0,131 г, считая на среднюю массу одной пленки, диспергируемой в полости рта.
Метод приготовления растворов с АФС
Растворы, содержащие 30,0 г пропиленгликоля, 1,0 г Твин 80 и 23 г ЭГПС из расчета на 100 г водного раствора, готовили путем перемешивания на магнитной мешалке ЭКРОС-6113Н (Экросхим, Россия). Раствор использовали свежеприготовленным.
Метод приготовления подложек, диспергируемых в полости рта методом выливания
Готовили растворы, содержащие смесь полимеров и пластификатора (ВВ в концентрациях, указанных в таблице 2), в химическом стакане при перемешивании с использованием магнитной мешалки ЭКРОС-6113Н (Экрос, Россия) и нагревании воды очищенной до 80 °С. Затем добавляли полимеры при работающей мешалке и уменьшали скорость смесителя для предотвращения образования пены и добавляли пластификатор, отстаивали получившуюся гелеобразную массу до достижения температуры 30 °С. Производили розлив готовых растворов в силиконовые формы размером лист А4. Растворы в силиконовых формах сушили в сушильном шкафу с принудительной конвекцией при 30 °С.
Функция обобщённой желательности Харрингтона
Для математического анализа данных использовали метод обобщённой функции желательности Харрингтона, в котором все результаты фармацевтико-технологических испытаний переводили в безразмерную шкалу и оценивали желательность характеристик каждого состава относительно друг друга
, , .3. Основные результаты
При разработке модельных составов подложек использовали гидроксипропилметилцеллюлозу (ГПМЦ) низкой вязкости от 3 до 100 сПаз в комбинации с пластификаторами, обеспечивающими эластичность и возможность получения однородных пленок для печати. В качестве пластифицирующих вспомогательных веществ использовали глицерин и полипропиленгликоль (ППГ), которые применяют для обеспечения эластичности пленок и удержания некоторого количества воды. Кроме того, данные ВВ обеспечивают небольшое уменьшение времени распадаемости и улучшение высвобождение активной фармацевтической субстанции. Модельные составы варьировали не только по видам ВВ, но и по их количественному содержанию в растворе для выливания в форму при приготовлении пленок, согласно процессу, описанному в «материалах и методах». Также в таблице 2 представлены коммерческие подложки, находящиеся на рынке и представляющие собой бумагу, разрешенную для пищевого применения.
Таблица 2 - Составы модельных смесей для получения подложек, используемых для получения плёнок, диспергируемых в полости рта методом струйной печати
№ | ГПМЦ* К100LV, % | ГПМЦ 3 HM, % | ГПМЦ 6 HM, % | ГПМЦ 15 HM, % | ППГ**, % | Глицерин, % |
1 | 1 | - | - | - | 1 | - |
2 | 1 | - | - | - | 2 | - |
3 | 1 | - | - | - | - | 1 |
4 | 1 | - | - | - | - | 2 |
5 | 2 | - | - | - | 1 | - |
6 | 2 | - | - | - | 2 | - |
7 | 2 | - | - | - | - | 1 |
8 | 2 | - | - | - | - | 2 |
9 | - | 1 | - | - | 1 | - |
10 | - | 1 | - | - | 2 | - |
11 | - | 1 | - | - | - | 1 |
12 | - | 1 | - | - | - | 2 |
13 | - | 2 | - | - | 1 | - |
14 | - | 2 | - | - | 2 | - |
15 | - | 2 | - | - | - | 1 |
16 | - | 2 | - | - | - | 2 |
17 | - | - | 1 | - | 1 | - |
18 | - | - | 1 | - | 2 | - |
19 | - | - | 1 | - | - | 1 |
20 | - | - | 1 | - | - | 2 |
21 | - | - | 2 | - | 1 | - |
22 | - | - | 2 | - | 2 | - |
23 | - | - | 2 | - | - | 1 |
24 | - | - | 2 | - | - | 2 |
25 | - | - | - | 1 | 1 | - |
26 | - | - | - | 1 | 2 | - |
27 | - | - | - | 1 | - | 1 |
28 | - | - | - | 1 | - | 2 |
29 | - | - | - | 2 | 1 | - |
30 | - | - | - | 2 | 2 | - |
31 | - | - | - | 2 | - | 1 |
32 | - | - | - | 2 | - | 2 |
33 | Рисовая бумага, Sen Soy Premium, Россия | |||||
34 | Крахмальная бумага, DecoLand, 0,35 мм, Россия | |||||
35 | Крахмальная бумага, DecoLand, 0,6 мм, Россия | |||||
36 | Сахарная бумага Modecor FREE TOP, Германия | |||||
Примечание: *гидроксипропилметилцеллюлоза; **полипропиленгликоль
При разработке технологии получения подложек остановились на использовании технологии выливания гелеобразной массы и последующего высушивания получившихся пленок при 40 °С до достижения уплотненной пленки.
Разработанные модельные составы подложек для струйной фармацевтической печати исследовали по следующим характеристикам: предел прочности на растяжение (Н), сопротивление излому, время распадаемости (мин), потеря в массе при высушивании (%) и высвобождение полученных образцов пленок (табл. 2).
Таблица 3 - Фармацевтико-технологические свойства подложек для струйной печати пленок этилметилгидроксипиридина сукцината (ЭГПС)
№ | Предел прочности при растяжении, Н | Сопротивление излому, кол-во | Время распа- даемости, мин | Потеря в массе при высушивании, % | Высвобождение за 3 мин, % |
(x1) | (x2) | (x3) | (x4) | (x5) | |
1 | 26,4±1,19 | 15±0,75 | 8,6±0,34 | 27±1,38 | 75,4±2,26 |
2 | 19,5±0,88 | 20±1 | 8,1±0,32 | 32±1,63 | 77,5±2,33 |
3 | 25,3±1,14 | 19±0,95 | 8,2±0,33 | 31±1,58 | 73±2,19 |
4 | 18,7±0,84 | 29±1,45 | 7,91±0,32 | 38±1,94 | 73,9±2,22 |
5 | 34,3±1,54 | 17±0,85 | 8,9±0,36 | 30±1,53 | 72,1±2,16 |
6 | 30,1±1,35 | 19±0,95 | 8,71±0,35 | 34±1,73 | 75,4±2,26 |
7 | 33,6±1,51 | 18±0,9 | 8,8±0,35 | 29±1,48 | 73,1±2,19 |
8 | 29,4±1,32 | 17±0,85 | 8,9±0,36 | 30±1,53 | 71,7±2,15 |
9 | 9,2±0,41 | 48±2,4 | 2±0,08 | 18±0,92 | 96,4±2,89 |
10 | 9,3±0,42 | 55±2,75 | 1,5±0,06 | 23±1,17 | 98,5±2,96 |
11 | 10,4±0,47 | 54±2,7 | 1,6±0,06 | 22±1,12 | 94±2,82 |
12 | 7,8±0,35 | 64±3,2 | 1,31±0,05 | 29±1,48 | 94,9±2,85 |
13 | 13,6±0,61 | 52±2,6 | 2,3±0,09 | 21±1,07 | 93,1±2,79 |
14 | 12,4±0,56 | 54±2,7 | 2,11±0,08 | 25±1,27 | 96,4±2,89 |
15 | 13,9±0,63 | 55±2,75 | 2,2±0,09 | 20±1,02 | 94,1±2,82 |
16 | 11,3±0,51 | 52±2,6 | 2,3±0,09 | 21±1,07 | 92,7±2,78 |
17 | 15,6±0,7 | 30±1,5 | 2,5±0,1 | 20±1,02 | 86,5±2,6 |
18 | 13,4±0,6 | 35±1,75 | 2±0,08 | 25±1,27 | 88,6±2,66 |
19 | 15,3±0,69 | 34±1,7 | 2,6±0,1 | 24±1,22 | 84,1±2,52 |
20 | 14,1±0,63 | 44±2,2 | 1,81±0,07 | 31±1,58 | 85±2,55 |
21 | 18,4±0,83 | 32±1,6 | 2,8±0,11 | 23±1,17 | 83,2±2,5 |
22 | 17,3±0,78 | 34±1,7 | 2,61±0,1 | 27±1,38 | 86,5±2,6 |
23 | 17,9±0,81 | 33±1,65 | 2,7±0,11 | 22±1,12 | 84,2±2,53 |
24 | 16,4±0,74 | 32±1,6 | 2,8±0,11 | 23±1,17 | 82,8±2,48 |
25 | 20,1±0,9 | 23±1,15 | 3±0,12 | 22±1,12 | 85,4±2,56 |
26 | 18,6±0,84 | 28±1,4 | 2,5±0,1 | 27±1,38 | 87,5±2,63 |
27 | 19,4±0,87 | 27±1,35 | 2,6±0,1 | 26±1,33 | 83±2,49 |
28 | 17,8±0,8 | 37±1,85 | 2,31±0,09 | 33±1,68 | 83,9±2,52 |
29 | 21,4±0,96 | 25±1,25 | 3,3±0,13 | 25±1,27 | 82,1±2,46 |
30 | 20,1±0,9 | 27±1,35 | 3,11±0,12 | 29±1,48 | 85,4±2,56 |
31 | 20,5±0,92 | 26±1,3 | 3,2±0,13 | 24±1,22 | 83,1±2,49 |
32 | 19,2±0,86 | 25±1,25 | 3,3±0,13 | 25±1,27 | 81,7±2,45 |
33 | 133,1±5,99 | 1±0,05 | 2,2±0,09 | 18±0,92 | 75,6±2,27 |
34 | 13±0,58 | 25±1,25 | 1,2±0,05 | 15±0,77 | 97,8±2,93 |
35 | 20,83±0,94 | 42±2,1 | 1,8±0,07 | 17±0,87 | 99,3±2,98 |
36 | 5,04±0,23 | 8±0,4 | 3±0,12 | 22±1,12 | 96,7±2,9 |
Представленные составы исследовали по таким основополагающим фармацевтико-технологическим характеристикам, как механические свойства пленок, поскольку они должны выдерживать технологический процесс печати и иметь свойства цельности вплоть до употребления пленок пациентами. Пленки должны обладать минимальными значениями остаточной влажности, исследуемыми по методике потери в массе при высушивании, ввиду того, что это напрямую влияет на их адсорбционные способности. Кроме того, в настоящем исследовании ориентировались на требования Государственной фармакопеи XV издания для таблеток, диспергируемых в полости рта, которые должны обладать свойствами диспергируемости в полости рта до 3 минут и за это время обеспечивать полноценное высвобождение АФС
.Для определения оптимального состава подложек для печати пленок, диспергируемых в полости рта, использовали один из методов математического планирования, а именно функцию обобщенной желательности Харрингтона. Данный метод позволяет определить оптимальный модельный состав с помощью объединения частных откликов фармацевтико-технологических и физико-химических свойств.
В таблице 4 показаны рассчитанные частные отклики желательности (di), соответствующие характеристикам образцов (xi) в таблице 3, и обобщенная желательность всех частных откликов. Для расчета обобщенной желательности использовали коэффициент, соответствующий весу каждого фактора.
Таблица 4 - Значения частных и обобщённых желательностей модельных составов подложек для фармацевтической печати
№ | d1 | d2 | d3 | d4 | d5 | D |
1 | 0,463 | 0,492 | 0,393 | 0,617 | 0,445 | 0,458 |
2 | 0,434 | 0,533 | 0,429 | 0,512 | 0,486 | 0,471 |
3 | 0,458 | 0,525 | 0,422 | 0,534 | 0,398 | 0,452 |
4 | 0,430 | 0,602 | 0,442 | 0,372 | 0,415 | 0,452 |
5 | 0,495 | 0,508 | 0,372 | 0,556 | 0,380 | 0,439 |
6 | 0,478 | 0,525 | 0,385 | 0,466 | 0,445 | 0,452 |
7 | 0,492 | 0,517 | 0,379 | 0,577 | 0,400 | 0,449 |
8 | 0,475 | 0,508 | 0,372 | 0,556 | 0,372 | 0,433 |
9 | 0,389 | 0,724 | 0,772 | 0,764 | 0,772 | 0,664 |
10 | 0,390 | 0,761 | 0,791 | 0,689 | 0,794 | 0,673 |
11 | 0,395 | 0,756 | 0,788 | 0,706 | 0,745 | 0,663 |
12 | 0,383 | 0,802 | 0,798 | 0,577 | 0,755 | 0,659 |
13 | 0,408 | 0,745 | 0,761 | 0,721 | 0,734 | 0,659 |
14 | 0,403 | 0,756 | 0,768 | 0,654 | 0,772 | 0,663 |
15 | 0,410 | 0,761 | 0,765 | 0,736 | 0,746 | 0,668 |
16 | 0,398 | 0,745 | 0,761 | 0,721 | 0,729 | 0,655 |
17 | 0,417 | 0,609 | 0,752 | 0,736 | 0,642 | 0,615 |
18 | 0,408 | 0,644 | 0,772 | 0,654 | 0,674 | 0,623 |
19 | 0,416 | 0,637 | 0,748 | 0,672 | 0,604 | 0,604 |
20 | 0,411 | 0,701 | 0,780 | 0,534 | 0,618 | 0,610 |
21 | 0,429 | 0,623 | 0,740 | 0,689 | 0,589 | 0,601 |
22 | 0,424 | 0,637 | 0,748 | 0,617 | 0,642 | 0,610 |
23 | 0,427 | 0,630 | 0,744 | 0,706 | 0,605 | 0,608 |
24 | 0,420 | 0,623 | 0,740 | 0,689 | 0,582 | 0,597 |
25 | 0,436 | 0,556 | 0,731 | 0,706 | 0,625 | 0,598 |
26 | 0,430 | 0,594 | 0,752 | 0,617 | 0,657 | 0,608 |
27 | 0,433 | 0,587 | 0,748 | 0,636 | 0,585 | 0,591 |
28 | 0,426 | 0,657 | 0,760 | 0,489 | 0,600 | 0,593 |
29 | 0,442 | 0,572 | 0,717 | 0,654 | 0,570 | 0,582 |
30 | 0,436 | 0,587 | 0,726 | 0,577 | 0,625 | 0,591 |
31 | 0,438 | 0,579 | 0,722 | 0,672 | 0,587 | 0,589 |
32 | 0,432 | 0,572 | 0,717 | 0,654 | 0,563 | 0,578 |
33 | 0,802 | 0,372 | 0,765 | 0,764 | 0,449 | 0,585 |
34 | 0,406 | 0,572 | 0,802 | 0,802 | 0,787 | 0,651 |
35 | 0,439 | 0,689 | 0,780 | 0,777 | 0,802 | 0,683 |
36 | 0,372 | 0,433 | 0,731 | 0,706 | 0,775 | 0,581 |
После получения откликов по каждому из свойств и представления их в виде безразмерных величин (частных желательностей) вычисляли обобщённую желательность, используя дифференциацию важности отдельных значений, которым присвоили коэффициенты: 0,2 значению предела прочности при растяжении и сопротивлении излому, 0,25 времени распадаемости и высвобождению АФС за 3 мин и 0,1 значению потери в массе при высушивании. По шкале желательности определяли состав со значением обобщённой желательности (D) максимально близким к 1. Составу № 35 соответствует наибольшее значение, равное 0,683, что позволяет сделать вывод о наибольшем соответствии его выбранным критериям и представляет собой наиболее оптимальную подложку для печати растворов с ЭГПС (рис. 2).
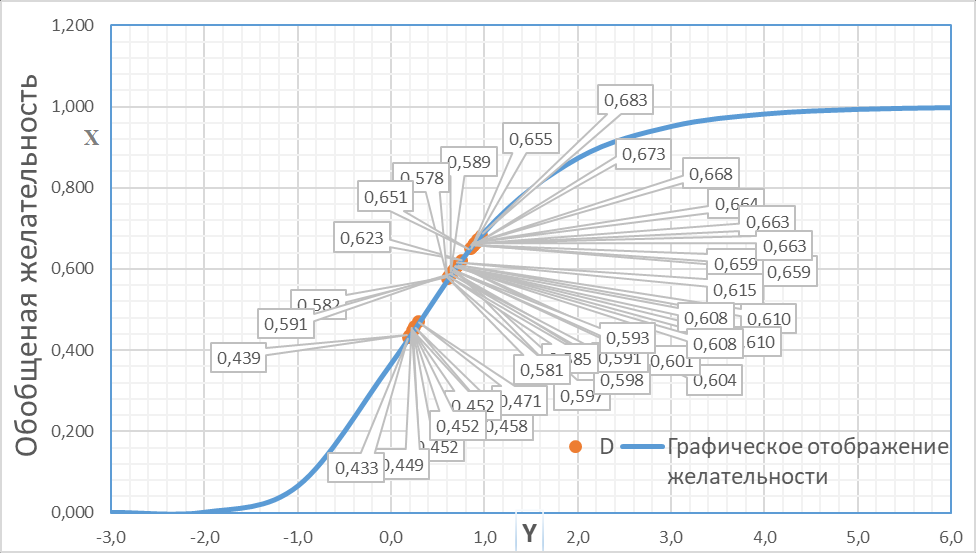
Рисунок 2 - Графическое отображение значений обобщённой желательности Харрингтона
В результате исследований с разработанным раствором («чернилами») для фармацевтической печати, полученным на предыдущих этапах исследований, составом подложки и предварительно подобранными технологическими режимами существует возможность получения лабораторных образцов с помощью пьезоэлектрического и термоструйного метода печати для сравнения их характеристик.
4. Заключение
В результате исследований разработанных и готовых к применению подложек для струйной печати пленок, диспергируемых в полости рта на основе 2-этил-6-метил-3-гидроксипиридина сукцината, охарактеризованы основные параметры, отвечающие за механические характеристики, распадаемость и высвобождение. Изученные фармацевтико-технологические свойства составов сравнивали между собой с помощью психрометрической шкалы с использованием метода обобщенной желательности Харрингтона. При сравнении значений обобщенных желательностей модельных составов выявлена подложка, обеспечивающая оптимальные характеристики и представляющая собой лист крахмальной бумаги 0,6 мм. Кроме того, выявлен оптимальный состав, полученный с помощью технологии выливания и высушивания раствора полимера, состоящий из ГПМЦ Е 3 и пластификатора полипропиленгликоля.
