TACTICAL DECISIONS IN THE BIOLOGY OF THE BLV, USING BIOCHEMICAL TEST SYSTEMS
Батенёва Н.В.1, Смирнов П.Н.2, Кашковский В.Г.3, Рябинина В.А.4
1Кандидат биологических наук, 2доктор ветеринарных наук, 3доктор сельскохозяйственных наук, 4аспирант, Новосибирский государственный аграрный университет
ТАКТИЧЕСКИЕ РЕШЕНИЯ В ИЗУЧЕНИИ БИОЛОГИИ BLV, С ИСПОЛЬЗОВАНИЕМ БИОХИМИЧЕСКИХ ТЕСТ-СИСТЕМ
Аннотация
BLV высоко эндемичен во многих странах, в том числе в России [3, 18, 13] нанося большой экономический ущерб животноводству в результате выбраковки скомпрометированных в отношение инфекции и собственно лейкоза животных [10-12, 14, 16, 17].
Проведенный нами информационный анализ данных структурных особенностей разных изолятов BLV (NCBI) подтверждает зависимость структурных особенностей BLV от породной принадлежности носителя. А также открывает новые возможности в изучении структурного разнообразия BLV и биологических особенностей вируса.
Ключевые слова: вирус лейкемии крупного рогатого скота, генотипирование, ПДРФ-анализ, gag ген, болезни животных, вирусы, биотехнология животных
Bateneva N.V.1,Smirnov P.N.2, Kashkovskij V.G.3, Ryabinina V.A.4
1 PhD in Biology, 2 PhD in Veterinary Medicine and Science, 3 PhD in Agriculture, 4Post-graduate student, Novosibirsk state agrarian University
TACTICAL DECISIONS IN THE BIOLOGY OF THE BLV, USING BIOCHEMICAL TEST SYSTEMS
Abstract
BLV is highly endemic in many countries, including in Russia [3, 18, 13] causing great economic losses to livestock as a result of culling compromised against infection and leukemia in animals [10-12, 14, 16, 17].
We held an information data analysis structural features of different BLV isolates (NCBI) confirms the dependence of the structural features of BLV from breed media. And also opens new possibilities in the study of the structural diversity of BLV and biological features of the virus.
Key words: bovine leukemia virus, genotyping, RFLP analysis, gag gene, animal diseases, viruses, animal biotechnology
Вирус лейкоза крупного рогатого скота (BLV) является возбудителем энзоотического лейкоза крупного рогатого скота (EBL), который характеризуется накоплением трансформированных B-клеток в периферической крови и/или локализации опухолей в различных тканях [2-10].
Классические методы контроля стад на инфекцию BLV, хотя и являются обязательными, однако не дают желаемого эффекта – сроки оздоровления растягиваются во времени из-за случаев скрытого носительства вируса. В этом и состоит актуальность проблемы [16, 17, 19, 20]. По всей вероятности суть ее кроется в нераскрытых до конца особенностях механизма взаимодействия в системе «вирус-клетка».
Многие механизмы взаимодействия вирус-клетка хотя и изучаются учеными во всем мире, но остаются не до конца выясненными [1, 5, 6, 8, 10, 16].
Так, при экспериментальном инфицировании телят в 50 % случаев BLV элиминируется из организма. В то время как у остальных 50 % некоторых животных он вызывает лейкоз, который со временем из гематологической стадии (PL-лимфоцитоз) течения переходит в клиническую [16].
Известно, что крупный рогатый скота мясных пород не восприимчив к BLV, однако, так и остается не выясненным механизм защиты животных от этого вируса [16]. Возможно, он находится в маскированном (неактивном) состоянии, как и то, что вирусы закономерно претерпевают эволюционные изменения, приспосабливаясь к организму «хозяина». В результате таких изменений на данный момент классифицировано 7 типов BLV (по происхождению) [1-4, 6, 9, 15]. Данная классификация основана на нуклеотидных и аминокислотных заменах в структуре env гена.
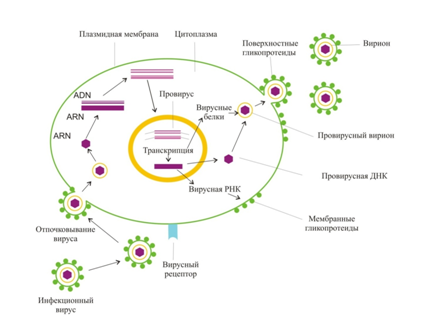
Проанализировав общую схему жизненного цикла ретровирусов, в частности BLV, мы пришли к следующему заключению: существует два контрольных этапа взаимодействия вирусной клетки с клеткой «хозяина». Первый – касается взаимодействия оболочки вируса с оболочкой клетки животного. Причем, на этом этапе задействован env ген, структура которого широко изучена во всем мире. Второй этап заключается во взаимодействии ядра клетки животного с вирионом. В данном процессе участвуют белки, кодируемые геном gag (рис. 1).
Поскольку нуклеотидные и аминокислотные замены, выявленные в геноме разных типов и субтипов BLV на участке, кодируемом env геном, нельзя дифференцировать по чувствительности к определенной породной принадлежности крупного рогатого скота, поэтому в качестве сталкерного гена нами был выбран gag ген.
Рис. 1 - Схема жизненного цикла репликационно-компетентного ретровируса
Ранее полученные нами данные рестрикционного анализа небольшого участка (347 п.н.) гена gag показали, что существует определенная связь между породной принадлежностью животного и изменением структуры BLV, циркулирующего на животных конкретно изучаемой породы [18].
Зарубежные исследователи, в последнее время секвенируют не короткие последовательности участков генов вируса, а последовательность целых генов, а иногда и полный геном BLV [1, 4, 9]. В этой связи мы полагаем, что в наших условиях, целесообразней всего изучать вирус небольшими фрагментами, в дальнейшем подвергать RFLP (Restriction Fragment Length Polymorphism) анализу, а уже затем, распределив на группы паттернов, делать выборку для дальнейшего секвенирования.
Объектом исследований служили коровы акционерных обществ и ПЗ Краснодарского и Ставропольского краев, разной породной принадлежности: красная степная, черно-пестрая голштинизированная, айрширская. Методом случайной выборки было отобрано 120 проб крови (по 30 проб из каждого хозяйства) от реагирующих в РИД (реакция иммунодиффузии в агаровом геле с антигеном gp51 BLV животных.
Предметом исследований служили пробы крови вышеперечисленных животных, отобранные из подхвостовой вены в стерильные пробирки с антикоагулянтом.
В дальнейшем из проб крови выделяли ДНК сорбентным методом с использованием наборов для выделения НК «АмплиСенс» в соответствии с инструкцией к набору.
Для подбора олигунуклеотидных праймеров нами были проанализированы 11 изолятов BLV из Международной базы NCBI GI: 151413539, 210767, 237688388, 9739119, 678246211, 678246204, 429534208, 429534201, 429534194, 9626225, 2801494.
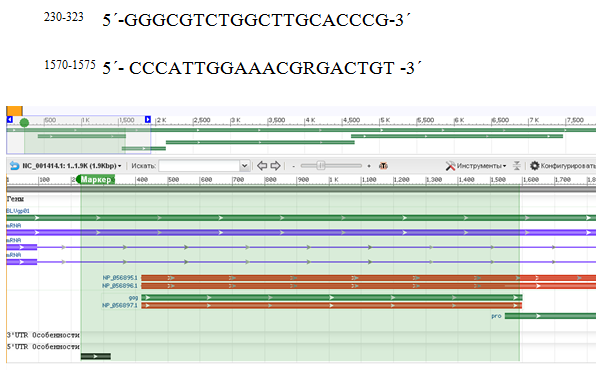
С учетом замен в структуре некоторых известных изолятов нами были сконструированы праймеры, фланкирующие вариабельный участок gag гена (рис. 2).
Рис.2 – Схема участка провируса BLV, фланкируемого олигонуклеотидными праймерами.
Поставили триплет реакций RialTime PCR с использованием красителя SuberGreen. После получения данных определили температуру плавления праймеров, которая составила 68 °C. Провели контрольную реакцию с использованием профиля с рассчитанной температурой.
Температурный профиль: 2 min – 94 °C; (30 s - 95 °C; 30 s - 68 °C; 30 s - 72 °C) – 40 циклов; 3 min – 72 °C.
Данные праймеры захватывают весь ген gag (небольшую часть LTR-области) (рис. 3), со всеми известными заменами, чувствительны к последовательностям всех известных на данный момент времени типов и субтипов BLV (NCBI).
Рис. 3. – Схема расположения известных нуклеотидных замен в провирусе BLV на участке генома (включающего gag ген и часть LTR-области), фланкируемом праймерами GGCGTCTGGCTTGCACCCG; CCCATTGGAAACGRGACTGT, с указанием сайтов рестрикции эндонуклеазами Fae I (CATG↑, ↓GTAC), Hae III (GG↑CC, CC↓GG)
По данной рестрикционной карте возможна констатация структурных особенностей 11 групп паттернов (изолятов) провируса. При этом некоторые профили свойственны только определенной породе крупного рогатого скота, что дает основание говорить о возможной адаптации вируса к особенностям носителя - крупного рогатого скота [18]. Итак, проведенный нами информационный анализ данных структурных особенностей разных изолятов BLV (NCBI) подтверждает ранее проведенные нами исследования о зависимости структурных особенностей BLV от породной принадлежности носителя. А также открывает новые возможности в изучении структурного разнообразия BLV и биологических особенностей вируса.
Литература
- Alvarez I, Gutierrez G, Gammella M, Martinez C, Politzki R, Gonzalez C, Caviglia L, Carignano H, Fondevila N, Poli M, Trono K: Evaluation of total white blood cell count as a marker for proviral load of bovine leukemia virus in dairy cattle from herds with a high seroprevalence of antibodies against bovine leukemia virus. Am J Vet Res 2013,74:744–749.
- Burny, A.; Bruck, C.; Cleuter, Y.; Couez, D.; Deschamps, J.; Gregoire, D.; Ghysdael, J.; Kettmann, R.; Mammerickx, M.; Marbaix, G. Bovine leukaemia virus and enzootic bovine leukosis. Onderstepoort. J. Vet. Res. 1985, 52, 133–144.
- Gutierrez G, Carignano H, Alvarez I, Martinez C, Porta N, Politzki R, Gammella M, Lomonaco M, Fondevila N, Poli M, Trono K: Bovine leukemia virus p24 antibodies reflect blood proviral load. BMC Vet Res 2012, 8:187.
- Jimba M, Takeshima SN, Murakami H, Kohara J, Kobayashi N, Matsuhashi T, Ohmori T, Nunoya T, Aida Y: BLV-CoCoMo-qPCR: a useful tool for evaluating bovine leukemia virus infection status. BMC Vet Res 2012, 8:167.
- Kettmann R, Burny A, Callebaut I, Droogmans L, Mammerickx M, et al.. (1994) Bovine leukemia virus. In: The Retroviridae. New York: Plenum Press. pp. 39–81
- Licursi M, Inoshima Y, Wu D, Yokoyama T, Gonzalez ET (2002) Genetic heterogeneity among bovine leukemia virus genotypes and its relation to humoral responses in hosts. Virus Res 86: 101–110. doi: 10.1016/s0168-1702(02)00059-x
- Mammerickx M, Portetelle D, de Clercq K, Burny A: Experimental transmission of enzootic bovine leukosis to cattle, sheep and goats: infectious doses of blood and incubation period of the disease. Leuk Res 1987, 11:353–358.
- Mewes, G.(1997): Langzcitstudie zur Persistent des Bovinen Leukose-virtrs (BLV) in einer leukosesanierten Milchviehhcrde. Vet. Diss., Berlin. Sagata. N., T. Yasunaga, J. Tsuziiku-Kawnmurn, K. Ohishi. Y. Ogawa, Y. Ikawa (1985): Complete nucleotide sequence of the genome of bovine leukemia virus: Its evolutionary relationship to other retro-viruses. Proc. Natl. Acnd. Sci. USA 82,677-681.
- The molecular characterization of bovine leukaemia virus isolates .Y Rola-Łuszczak M., Pluta A., Olech M., Kuźmak J., Donnik I., Petropavlovskiy M., Gerilovych A., Vinogradova I., Choudhury B. PLoS ONE. 2013. Т. 8. № 3. С. e58705.
- Willems L, Thienpont E, Kerkhofs P, Burny A, Mammerickx M, et al. (1993) Bovine leukemia virus an animal model for the study of intrastrain variability. J Virol 67: 1086–1089.
- Влияние экологических факторов на организм животных. Донник И.М., Шкуратова И.А., Шушарин А.Д., Верещак Н.А., Бейкин Я.Б. Ветеринария. 2007. № 6. С. 38-42.
- Новые методы исследований по проблемам ветеринарной медицины. Смирнов А.М., Гулюкин М.И., Субботин В.В., Донник И.М., Колбасов Д.В., Скира В.Н., Суворов А.В., Бабышова Л.В., Срибный Н.И. Москва, 2008. Том Часть IV Лабораторные методы исследований инфекционной патологии животных
- Петропавловский, М. В. Особенности течения и распространения лейкоза крупного рогатого скота на южном Урале/М.В. Петропавловский,И.М. Донник, А.Т. Татарчук, А.В. Лысов, Ю.Ф. Водиченков, М.П. Михеев//Журн. Аграрный вестник Урала, Екатеринбург, 2010. -№ 10. -с. 48
- Профилактика лейкоза крупного рогатого скота в племенных хозяйствах Краснодарского края. Донник И.М., Джаилиди Г.А. Ветеринария Кубани. 2013. № 5. С. 8-10
- Региональная молекулярно-генетическая структура вируса лейкоза крупного рогатого скота. Донник И.М., Петропавловский М.В. Ветеринария Кубани. 2010.№ 3. С. 12-13
- Смирнов П.Н.Болезнь века - лейкоз крупного рогатого скота.-Новосибирск, 2007.
- Смирнов П.Н.,Храмцов В.В., Смирнова В.В. Научное обеспечение и реализация в условиях производства комплексной системы противолейкозных мероприятий // Ветеринария Сибири. -2001. -№ 5. -С. 46-50.
- Смирнов, П.Н. Генотипическое разнообразие вируса лейкоза крупного рогатого скота на территории Новосибирской области и Краснодарского края /П.Н. Смирнов,Н.В. Батенёва, В.А. Белявская//Вестник НГАУ/Новосиб. гос. аграр. ун-т. - Новосибирск, 2011. -№ 2 (18). -С. 81 -83.
- Сравнительные биохимические показатели крови коров айрширов в связи с их продуктивностью и неблагополучием по инфекции BLV/ П.Н. Смирнов, Т.В. Гарматарова, Н.В. Батенёва [и др.]//Междунар. н.-и. журн. -2013. -№ 9. -С. 64-66.
- Эпизоотические аспекты лейкоза крупного рогатого скота в краснодарском крае. Донник И.М., Джаилиди Г.А., Якубенко Е.В., Тихонов С.В. Ветеринария Кубани. 2014. № 2. С. 15-18.
References
- Alvarez I, Gutierrez G, Gammella M, Martinez C, Politzki R, Gonzalez C, Caviglia L, Carignano H, Fondevila N, Poli M, Trono K: Evaluation of total white blood cell count as a marker for proviral load of bovine leukemia virus in dairy cattle from herds with a high seroprevalence of antibodies against bovine leukemia virus. Am J Vet Res 2013,74:744–749.
- Burny, A.; Bruck, C.; Cleuter, Y.; Couez, D.; Deschamps, J.; Gregoire, D.; Ghysdael, J.; Kettmann, R.; Mammerickx, M.; Marbaix, G. Bovine leukaemia virus and enzootic bovine leukosis. Onderstepoort. J. Vet. Res. 1985, 52, 133–144.
- Gutierrez G, Carignano H, Alvarez I, Martinez C, Porta N, Politzki R, Gammella M, Lomonaco M, Fondevila N, Poli M, Trono K: Bovine leukemia virus p24 antibodies reflect blood proviral load. BMC Vet Res 2012, 8:187.
- Jimba M, Takeshima SN, Murakami H, Kohara J, Kobayashi N, Matsuhashi T, Ohmori T, Nunoya T, Aida Y: BLV-CoCoMo-qPCR: a useful tool for evaluating bovine leukemia virus infection status. BMC Vet Res 2012, 8:167.
- Kettmann R, Burny A, Callebaut I, Droogmans L, Mammerickx M, et al.. (1994) Bovine leukemia virus. In: The Retroviridae. New York: Plenum Press. pp. 39–81
- Licursi M, Inoshima Y, Wu D, Yokoyama T, Gonzalez ET (2002) Genetic heterogeneity among bovine leukemia virus genotypes and its relation to humoral responses in hosts. Virus Res 86: 101–110. doi: 10.1016/s0168-1702(02)00059-x
- Mammerickx M, Portetelle D, de Clercq K, Burny A: Experimental transmission of enzootic bovine leukosis to cattle, sheep and goats: infectious doses of blood and incubation period of the disease. Leuk Res 1987, 11:353–358.
- Mewes, G.(1997): Langzcitstudie zur Persistent des Bovinen Leukose-virtrs (BLV) in einer leukosesanierten Milchviehhcrde. Vet. Diss., Berlin. Sagata. N., T. Yasunaga, J. Tsuziiku-Kawnmurn, K. Ohishi. Y. Ogawa, Y. Ikawa (1985): Complete nucleotide sequence of the genome of bovine leukemia virus: Its evolutionary relationship to other retro-viruses. Proc. Natl. Acnd. Sci. USA 82,677-681.
- The molecular characterization of bovine leukaemia virus isolates .Y Rola-Łuszczak M., Pluta A., Olech M., Kuźmak J., Donnik I., Petropavlovskiy M., Gerilovych A., Vinogradova I., Choudhury B. PLoS ONE. 2013. Т. 8. № 3. С. e58705.
- Willems L, Thienpont E, Kerkhofs P, Burny A, Mammerickx M, et al. (1993) Bovine leukemia virus an animal model for the study of intrastrain variability. J Virol 67: 1086–1089.
- The influence of environmental factors on the organism of animals. Donnik I. M., Shkuratova I. A., Shusharin A. D., Vereshchak N. And., Belkin Y. B. Veterinary medicine. 2007. No. 6. P. 38-42.
- New methods of research on problems of veterinary medicine. Smirnov A. M., Gulykin M. I., Subbotin V. V., Donnik I. M., Kolbasov D. V., Skhirat, V. N., Suvorov A.V., Babyshow L. V., Sribnyi N. And. Moscow, 2008. The Part IV Laboratory methods for studies of infectious diseases of animals
- Petropavlovskiy M. V. Peculiarities of the course and distribution of bovine leukemia in the southern Urals Petropavlovskiy M., Donnik I. M., A. T. Tatarchuk, A. V. Lysov, Y. F. Vovchenko, P. M. Mikheev//Phys. Agrarian Bulletin of the Urals, Ekaterinburg, 2010. - No. 10. -p. 48
- Prevention of bovine leucosis in breeding farms of the Krasnodar region. Donnik I. M., Dailide G. A. Veterinary Kuban. 2013. No. 5. P. 8-10
- Regional molecular genetic structure of the virus leukemia cattle. Donnik I. M., аnd Petropavlovskiy M. Veterinary Kuban. 2010. No. 3. S. 12-13
- Smirnov P. N. The disease of the century - the bovine leukemia.-Novosibirsk, 2007.
- Smirnov P. N., Khramtsov V. V., Smirnov V. V. Scientific support and implementation in production of a comprehensive system of anti-leukemic activities veterinary of Siberia. -2001. - No. 5. -P. 46-50.
- Smirnov, P. N. Genotypic diversity of leukemia virus of cattle in the territory of the Novosibirsk region and the Krasnodar territory /P. N. Smirnov, N. In. Bateneva, Belyavskaya V. A.//Bulletin of University/Novosibirsk. GOS. Agrar. Univ - Novosibirsk, 2011. -№ 2 (18). -S. 81 -83.
- Comparative biochemical blood parameters of cows Ayrshire due to their productivity and trouble on BLV infection/ P. N. Smirnov, T. V. Garmatarova, T. V. Bateneva V.[et al.]//Intern. B. I. Phys. -2013. - No. 9. Pp. 64-66.
- Epizootic aspects of bovine leukemia in the Krasnodar region. Donnik I. M., Dailide G. A., E. Yakubenko V., Tikhonov S. V. Veterinary Kuban. 2014. No. 2. P.15-18.