STATE REGULATION OF DRUG TURNOVER IN THE CONSUMER MARKET OF THE RUSSIAN FEDERATION: CURRENT PROBLEMS AND CONTRADICTIONS
STATE REGULATION OF DRUG TURNOVER IN THE CONSUMER MARKET OF THE RUSSIAN FEDERATION: CURRENT PROBLEMS AND CONTRADICTIONS
Abstract
The turnover of pharmaceuticals is one of the most important aspects of the healthcare optimization and localization strategy. In the current realities, the independence and universality of the drug supply system is directly responsible for health, and consequently for the prosperity of the country. The article examines the problems and contradictions of the modern system of state regulation of medicines on the consumer market. The gaps and issues are indicated, the elaboration and development of which will allow to improve the Russian legislation in the pharmaceutical sphere. In order to disclose the main issues of the research the analysis of the pharmaceutical market of Russia is carried out, the current legislation of the country in this sphere is considered, the main topical problems are analysed.
1. Введение
В Российской Федерации вопросы регулирования оборота лекарственных средств, в связи с их приоритетностью и важностью, находятся под жестким контролем государства. При этом регулирование фармацевтического рынка производится на всех уровнях и в рамках различной законотворческой деятельности – начиная от федерального и заканчивая региональными и муниципальными нормативными актам. Также регулированием занимаются все органы государственного и муниципального управления, задействованные в обороте лекарственных препаратов.
Процесс централизованного и тотального контроля производства и обращения лекарственных средств не всегда был столь организован и структурирован как в настоящее время. Изначально жесткой регламентации подвергалось только производство лекарственных препаратов – фармакопея была создана и актуализируется уже в течение двухсот лет – на сегодня это электронное издание, которое постоянно актуализируется и пополняется новыми статьями. В конце двадцатого века, в связи кратным увеличением оборота лекарственных препаратов и расширения их номенклатуры остро стал вопрос о правовом регулировании данной сферы. В связи с этим был создан первый нормативный акт – Федеральный закон «О лекарственных средствах» от 22.06.1998 N 86-ФЗ. Как все изначальные нормативные акты он был несовершенен и требовал актуализации и доработок. Но данный нормативный акт послужил основой для актуального федерального закона – который на сегодня является основным законом, регламентирующим оборот лекарственных средств – 61-ФЗ от 12.04.20210. В рамках регуляторной гильотины закон подвергается постоянной актуализации и модернизируется в соответствии с новыми внешними условиями и вызовами фармацевтической сферы
.Факт того, что законодатель регулярно вносит поправки в действующие нормы, говорит об актуальности и значимости вопроса оборота лекарственных средств в Российской Федерации. Сегодня перед страной стоит вызов лекарственной безопасности, и соответственно, мы должны максимально качественно настроить процесс производства, распределения и реализации лекарств. Дорожная карта этих экономических, технологических и социальных процессов должна комплиментарно дополнять друг друга, быть понятной, открытой и прозрачной. При этом все процессы должны идти в ногу со временем и быть интегрированы в постоянно развивающуюся цифровую среду здравоохранения. Наука постоянно уделяет большое внимание этому направлению, что нашло отражение в статьях и научных трудах в самых разных сферах и направлениях научных интересов. В большинстве работ ученые приходят к выводу, что система постоянно совершенствуется, но несмотря на это, к сожалению, содержит много недоработок, которые требуют корректировки.
В соответствии с актуальностью темы исследования была определена его цель – проанализировать проблемы и противоречия вопроса о государственном регулировании оборота лекарственных средств на потребительском рынке Российской Федерации. Для реализации цели исследования были определены следующие задачи:
– провести оценку современного состояния и особенностей российского фармацевтического рынка;
– проанализировать характер государственного регулирования оборота лекарственных средств;
– оценить перспективы дальнейшего государственного регулирования данной отрасли.
В исследовании применялись методы, которые позволили реализовать комплексное теоретико-методологическое исследование заданной проблемы:
– анализ и структурирование информации – метод использовался для анализа, систематизации и синтеза научных источников, подходов и взглядов по обозначенной проблеме;
– анализ нормативно-правовой базы – метод исследования, суть которого заключается в изучении и интерпретации нормативно-правовой литературы;
– библиографическое описание;
– прогнозирование.
2. Основные результаты
2.1. Современное состояние и особенности российского фармацевтического рынка
В современных реалиях, в век цифровизации и автоматизации всех процессов Фармацевтический рынок является лидером в направлении формализации всех вышеперечисленных процессов. Более 20-ти лет система постоянно совершенствуется, меняются подходы и сферы влияния отдельных контролирующих и разрешительных органов, но неизменным остается одно- все этапы – от разработки фармацевтических субстанций и лекарственных препаратов до их утилизации подлежат жесткому регламентированию со стороны государства.
Фармацевтический рынок многогранен. Если объектом его неизменно являются лекарственные препараты, то субъектами рынка, в связи с тем, что рынок лекарственных препаратов действует на пересечении двух зон стратегических интересов – экономической и социальной, выступают с одной стороны игроки экономической сферы это производители лекарственных препаратов, дистрибьютеры, розничное звено в виде федеральных и региональных аптечных сетей различных форм собственности. С другой же стороны субъектами выступают блюстители как раз социальной сферы – законотворцы и органы контролирующие и регулирующие этот рынок – такие как Росздравнадзор, Минпромторг, Минздрав Российской Федерации. Построенная система позволяет держать равновесие и давать стимул в развитии и совершенствовании Российского потребительского фармацевтического рынка, что выражается в высокой оценке международными экспертами потенциала роста и уровня организации данной сферы в нашей стране. В трудах И.П. Артюхова существующая модель фармацевтического рынка охарактеризована как гибридный комплекс экономических отношений, включающих в себя различные сферы субъектов фармацевтического рынка, преследующих как экономические так и социальные и регуляторные цели в рамках купли-продажи, назначения и применения всех средств лекарственного и аптечного ассортимента
.Проанализировав работы А.И. Анопченко и М.В. Россинской мы пришли в выводу, что, согласно мнению авторов, отечественный фармацевтический рынок очень качественно и продуктивно был готов и ответил на внешние угрозы, что позволило охранить лекарственное обеспечение населения жизненно важными лекарственными препаратами в полном объёме. В первую очередь это было достигнуто благодаря стратегии развития фармацевтического производства «Фарма-2020» принятой правительством еще в 2009 году. Уже тогда правительством была поставлена задача полной независимости рынка важнейших лекарственных препаратов от импорта. Все это позволяет на год от года увеличивать емкость фармацевтического рынка, а в вместе с постоянно растущей долей государственного финансирования в рамках национального проекта «Здравоохранение» и постоянного наращивания государственных закупок лекарственных препаратов для лечения в том числе и высокозатратных нозологий позволять оставаться российскому рынку лекарственных препаратов одним из самых перспективных и быстрорастущих в мире
.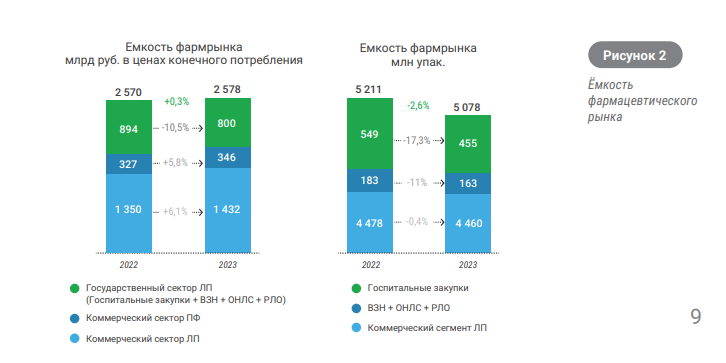
Рисунок 1 - Емкость фармацевтического рынка
П.И. Опанасенко отмечает, что ключевыми факторами развития фармацевтического рынка в России в настоящее время являются
:– импортозамещение;
– оптимизация логистических цепочек;
– переход на отечественное оборудование для производства.
Процесс производства фармацевтической продукции в России на всех этапах четко регламентирован:
1. Процесс разработки лекарственного препарата. В зависимости от назначения и состава разрабатываемого препарата инициатором данного процесса будет выступать государство (если мы говорим о государственном заказе или разработке наркотического препарата) или частная компания. Этот эта будет включать в себя разработку и анализ формулы в рамках действующего законодательства и принципов применения лекарственных препаратов, прописанных в 323 Федеральном законе.
2. Разработка досье на лекарственный препарат и его дальнейшая регистрация в соответствии в актуальными правовыми нормами.
3. Непосредственно сам этап производства лекарственного препарата, в соответствии с досье и в рамках норм, предъявляемых к безопасности и эффективности лекарственного препарата.
4. Этап формирования логистических цепочек – включающих в себя соблюдения условий транспортировки и хранения лекарственного препарата на всех этапах его жизненного цикла – от производства до потребления в соответствии с регистрационными данными.
5. Этап реализации и применения лекарственного препарата. Данный этап ложится уже на розничную аптечную сеть и стационары, которые так же ответственны за соблюдение всех необходимых условий хранения и применения лекарственных средств.
6. Параллельно на всех этапах непрерывно ведется мониторинг применения лекарственных препаратов в рамках Фармаконадзора.
7. И конечный этап – при необходимости – утилизация лекарственных средств, пришедших в негодность или изъятых из оборота на любом этапе в связи с определенными обстоятельствами.
Все вышеперечисленные этапы в очередной раз показывают стратегическую важность лекарственного обеспечения страны и контроль всех процессов оборота лекарственных препаратов со стороны государства. Основным требованием, предъявляемым различными законодательными актами к лекарственным препаратам является их эффективность и безопасность. Экономического благосостояния станы невозможно добиться без здорового и работоспособного населения. В связи с этим задача всех регуляторных мер на современном фармацевтическом рынке не допустить в обращение неэффективные и небезопасные препараты, при этом постоянно совершенствующиеся технологии производства лекарственных препаратов и применение различных экономических и математических алгоритмов в рамках оптимизации обеспечения лекарственными препаратами позволяет еще и финансово значительно сократить суммы, расходующиеся на лекарственное обеспечение, не урезая его , а соответственно, оказать лекарственную помощь большему кругу граждан
.Основной задачей главенствующих нормативных актов в обращении лекарственных препаратов и охраны здоровья граждан страны – Федерального закона от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» и Федерального закона от 21.11.2011 N 323-ФЗ «Об основах охраны здоровья граждан в РФ» является эффективность и безопасность реализуемых лекарственных средств на фармацевтическом рынке, а также постоянный мониторинг, контроль и регулирование обращения лекарственных препаратов.
В рамках данного процесса контролю подвергаются все составляющие процесса функционирования фармацевтического рынка, такие как производство, контроль качества, ценообразование, законность и прозрачность закупочной деятельности, маркетинговая деятельность, рекламная деятельность и т.д.
2.2. Особенности государственного регулирования оборота лекарственных средств в Российской Федерации
Сегодня понятие системы государственного регулирования оборота лекарственных препаратов включает в себя сложную многоуровневую структуру, используемую различные методы и инструменты, направленные на формирование системы экономических отношений, которые будут отвечать определенным требованиям – с одной стороны, структура будет направлена на защиту общественных и частных интересов и достижение баланса развития экономики в общем, с другой стороны, будет полностью отвечать стратегическим целям системы здравоохранения в рамках лекарственного обеспечения и безопасности нации. Учитывая ценность и значимость проблемы государственного регулирования обращение лекарственных средств, вопросам разработки содержания этого процесса уделяется много внимания как в теоретической так и практической плоскости и включает в себя определенные нормы, законы и правила. Контроль за соблюдением действующего законодательства и оптимизация работы как госпитального так и коммерческого рынка лекарственных препаратов осуществляется путем использования прямых методов регулирования
.Производство и реализация лекарственных препаратов является особо контролируемой зоной ответственности государства. Все этапы разработки, производства, транспортировки, хранения, реализации и утилизации лекарственных препаратов подлежат особому виду контроля – лицензированию данных видов деятельности.
Так, субъект обращения лекарственных средств, как юридическое лицо, так и индивидуальный предприниматель, осуществляющий деятельность на потребительском рынке фармацевтических препаратов, должен предварительно получить лицензию на осуществление фармацевтической деятельности. Процесс получения лицензии регулируется Постановлением правительства РФ от 31 марта 2022 г. N 547 «Об утверждении Положения о лицензировании фармацевтической деятельности» с изменениями и дополнениями, вступившими в силу 3 августа 2023 года. В зависимости от сферы деятельности организации лицензирование данных видов деятельности должны осуществлять следующие структуры:
1. Федеральная служба по надзору в сфере здравоохранения – в рамках организации оптовой торговли лекарственными препаратами и реализации лекарственных препаратов аптечными организациями, подведомственными федеральным органам исполнительной власти.
2. Федеральная служба по ветеринарному и фитосанитарному надзору – в части деятельности, осуществляемой в сфере обращения лекарственных средств для ветеринарного применения.
3. Исполнительные органы субъектов Российской Федерации – в части осуществления деятельности в сфере обращения лекарственных средств для медицинского применения юридическими лицами и индивидуальными предпринимателями.
Нормативный акт регламентирует требования, предъявляемые к соискателю лицензии и персоналу, требования к помещению и оборудованию, необходимых для осуществления деятельности, порядок получения лицензии, перечень выполняемых работ, оказываемых услуг, составляющих фармацевтическую деятельность и т.д. Так же документ определяет алгоритм, сроки и формат предоставления услуги
.Основным прямым методом государственного регулирования деятельности организаций на потребительском рынке фармацевтических препаратов является надзор и контроль со стороны государства. Необходимость контроля в этой сфере обусловлена недостатками и проблемами, которые отмечаются в деятельности участников этого сектора на рынке лекарственных средств для медицинского применения в настоящее время. В современной модели риск-ориентированного подхода к проверкам организаций стоит задача профилактики, и тем самым предупреждения нарушений закона о фармацевтической деятельности. Особенно актуально это в кризисных ситуациях, при ухудшении эпидемиологической обстановки в стране и т.д. Так, например, ухудшение эпидемиологической обстановки приводит к повышению спроса на необходимые населению лекарственные препараты, что без качественного контроля и надзора со стороны государства может привести к неподконтрольному применению, созданию ажиотажного спроса и необоснованному повышению цен на необходимые препараты
.3. Обсуждение
Анализируя теоретические аспекты государственного регулирования оборота лекарственных средств на потребительском рынке Российской Федерации, важно отметить, что лекарственные средства для медицинского применения – стратегически важный сегмент рынка, имеющий первостепенное значение в сохранении здоровья нации. Обеспечение доступности лекарственных препаратов на потребительском рынке – это первостепенная задача государства, что обуславливает значение контроля и надзора. Распоряжением Правительства РФ N 2406-р от 12 октября 2019 г. утвержден перечень Жизненно важных лекарственных препаратов (ЖНВЛП) и минимального ассортимента фармацевтических препаратов, необходимых для жизни и здоровья населения и для осуществления медицинской помощи. Соответственно, организация, осуществляющая деятельность на потребительском рынке фармацевтических препаратов, в обязательном порядке должна иметь в наличии минимальный ассортимент лекарственных средств для медицинского применения, согласно данного распоряжения. Минимальный ассортимент ежегодно подлежит актуализации со стороны регуляторной системы.
Нарушение требований данного распоряжения влечет за собой грубое нарушение лицензионных требований, что выражается в административной ответственности юридического и должностного лица в виде штрафа, приостановления деятельности организации и иных последствий (в конкретных случаях)
.Также в рамках нашего исследования нельзя не обратить внимание на проблему фальсифицированных и недоброкачественных препаратов на фармацевтическом рынке. Регулятор понимает важность и значимость этой проблемы и постоянно принимает различные меры для минимизации рисков здоровья населения. Так в 2020 году стартовала обязательная маркировка лекарственных препаратов, и спустя без малого 4 года работы данного проекта можно смело утверждать, что количество недоброкачественной и фальсифицированной продукции на рынке лекарственных препаратов снизилось в разы. Сегодня, в случае изъятия из оборота определенной серии препарата Росздравнадзор, с точностью до упаковки, может отследить путь и конечную точку хранения и реализации.
При этом следует обратить внимание на несовершенство современного законодательства – пациент имеет право заявить и потребовать компенсацию и привлечение к административной ответственности медицинской организации в случае некачественного предоставления медицинской услуги – о чем говорит довольно обширная судебная практика. И вместе с этим при причинении вреда здоровью лекарственным препаратом такой практики нет. Мы считаем что это ущемляет конституционные права граждан и требует доработки со стороны законотворческих органов
.На сегодня есть несколько направлений решения данной проблемы – существует система фармаконадзора – которая собирает всю информацию о побочных и нежелательных эффектах лекарственных препаратов, и в случае принятия решения изымает данный препарат из обращения. Так же начинает набирать обороты фармакоэпидемиология – благодаря эпидемии COVID-19, получившая огромный пласт материала для исследования.
Рассмотрим следующую проблему, связанную с розничным покупателем (потребителем) фармацевтических препаратов. Сегодня таким покупателем может выступать физическое лицо, наделенное статусом дееспособного на момент приобретения лекарственного препарата, и имеющее на руках рецепт лечащего врача в случае покупки рецептурного препарата. В современной России остро стоит проблема самолечения – фармацевтические препараты, при их неверном назначении, неумелом хранении и использовании, бесконтрольном применении и самостоятельном использовании могут нанести вред жизни и здоровью человека. В связи с этим считаем целесообразным рассмотреть вопрос о запрете реализации фармацевтических препаратов лицам, не достигшим совершеннолетия (в настоящее время законодательство РФ не содержит прямого запрета). Соответственно, в перспективе для устранения этой проблемы необходимо внести поправки в Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств», предполагающие запрет на реализацию медицинских препаратов несовершеннолетним лицам и прописать алгоритм назначения и приобретения лекарственных средств для данной категории населения совершеннолетними законными представителями.
Таким образом, можно сделать вывод, что государственный контроль оборота лекарственных средств на потребительском рынке России осуществляется на всех этапах обращения через разрешительные, контрольные и надзорные мероприятия, целью которых является реализация прав граждан страны на охрану здоровья, мониторинга качества и безопасности фармацевтических препаратов. Соблюдение установленных правительством и министерством Здравоохранения норм предполагает постоянный контроль соблюдения действующего законодательства и требует совершенствования в рамках ответственности перед потребителем, а также ужесточения условий отпуска рецептурных лекарственных средств конечному потребителю из аптечной организации.
4. Заключение
В настоящее время государство уделяет большое внимание здоровью нации. В рамках реализуемого национального проекта «Здравоохранение» приоритетными задачами является повышение качества и продолжительности жизни население, что невозможно без эффективного и качественного лекарственного обеспечения. Государственному контролю и регулированию подлежат все сферы оборота лекарственных препаратов для медицинского применения от разработки и производства до реализации и утилизации. Особое внимание уделяется Обязательному ассортименту жизненно необходимых лекарственных препаратов и порядку назначения их.
В рамках данной статьи были рассмотрены основные проблемы государственного регулирования оборота лекарственных средств на потребительском рынке. Решение этих проблем позволит совершенствовать систему государственного контроля и надзора и откроет новые перспективы повышения эффективности данной системы.
