COMPLEX PREVENTION OF ASHERMAN SYNDROME IN INTRA-UTERINE SURGERY. CLINICAL EXAMPLES
COMPLEX PREVENTION OF ASHERMAN SYNDROME IN INTRA-UTERINE SURGERY. CLINICAL EXAMPLES
Abstract
Cervical adhesions, or Asherman's syndrome, is a late and rather frequent complication of transcervical uterine interventions: hysteroscopy, hysteroresectoscopy, vacuum aspiration. This condition occurs in up to 1.5% of the population of all women, from 5 to 33% in women with primary pregnancy loss and up to 88% with recurrent pregnancy loss. Intrauterine synechiae (IUS) can be an etiological factor in infertility and reduce patients' life quality. Therefore, in the light of the high rate of surgical interventions, this problem is particularly relevant. The treatment of IUSs is long and expensive. This article describes methods of preventing adhesions during operations on the uterus cavity. Clinical examples are given of various surgical techniques minimizing the impact on the endometrium and endocervix, physical barriers – Foley 8Fr catheter, and medication – an anti-adhesive gel containing hyaluronic acid and carboxymethylcellulose.
1. Введение
В последние годы отмечается тенденция к увеличению числа оперативных вмешательств на женской репродуктивной системе. По данным форм Федерального статистического наблюдения Управления Федеральной службы государственной статистики за 2018 год в головном учреждении РФ по акушерско-гинекологической помощи, ФГБУ НМИЦ АГП им. В.И. Кулакова, было выполнено 23730 оперативное вмешательство, из них 13196 на женских репродуктивных органах . Число всех гинекологических хирургических вмешательств в условиях дневного стационара на территории РФ, за 2021 года составило 995970 операций, в 2008 году всего 391069, по данным Федеральной Службы Государственной Статистики
. Говоря о высокой эффективности оперативного лечения внутриматочной патологии и патологии, связанной с беременностью, нельзя не упомянуть об отрицательных сторонах хирургии – осложнениях. Гистероскопическая хирургия, как область гинекологической эндоскопии, не является исключением с позиции спаечного процесса. Впервые внутриматочные синехии (ВМС) были описаны Fritsch H. в 1894 году, у женщины с вторичной аменореей после проведенного кюретажа в послеродовом периоде . Bass В. в 1927 году диагностировал атрезии цервикального канала, возникшие после медицинского аборта у 20 из 1500 обследуемых женщин . В 1948 г. Джозефом Ашерманом был опубликован ряд работ, в которых впервые указана частота развития внутриматочных синехий, подробно описаны этиологические факторы, симптоматика, а также представлены рентгенологические снимки ВМС. После данных публикаций термин «синдром Ашермана» используется для описания ВМС до настоящего времени. Несмотря на то, что о ВМС известно больше века, проблема до сих пор остается актуальной. На данном этапе развития мировой медицины ведутся работы, направленные на разработку мер профилактики и лечения данной патологии. Поскольку спаечный процесс в полости матки, как и спаечный процесс в малом тазу, влияет на фертильность и исходы беременности. По данным различных авторов, распространенность спаечного процесса в полости матки довольно высокая: до 1,5% в популяции всех женщин, от 5 до 33% у женщин с первичными потерями беременности, с повторными – до 88% , , , . Согласно исследованию Schenker J.G., Margalioth E.J., У 165 беременных женщин с нелеченной формой синдрома Ашермана, частота спонтанного выкидыша составила 40%, преждевременных родов 23%, своевременные роды произошли в 30% случаев, патологическое прикрепление плаценты наблюдалось у 13% женщин, внематочная беременность – у 12% пациенток . Пусковым механизмом для формирования ВМС является травма базального слоя эндометрия, которая может быть вызвана различными факторами. Основной из них – вмешательства во время беременности или в послеродовом периоде. Несмотря на то, что синдром Ашермана был описан после произведенного выскабливания, на фоне беременности малого срока, в настоящее время установлены и другие причины ВМС. Так, увеличение числа внутриматочных вмешательств по поводу субмукозных миоматозных узлов, аномалий развития матки и схожие патологические состояния, дали еще одну группу пациенток, предрасположенных к формированию ВМС.Существуют различные классификации по степени выраженности синдрома Ашермана:
Таблица 1 - Классификация American Society for Reproductive Medicine
Степень вовлечения полости матки | Менее 1/3 – 1 балл | 1/3-2/3 – 2 балла | 2/3 – 4 балла |
Тип спаек | Нежные – 1 балл | Нежные и плотные – 2 балла | Плотные – 4 балла |
Нарушение менструаций | Норма – 0 баллов | Гипоменорея – 2 балла | Аменорея – 4 балла |
Примечание: Американское Общество Репродуктивной Медицины, ASRM; 1988 год; по ист. [20]
Суммируя баллы, выделяют 3 стадии:
· слабая — 1-4 балла;
· средняя — 5-8 баллов;
· тяжёлая — 9-12 баллов.
Таблица 2 - Классификация European Society of Gynecological Endoscopy,
Степень | Распространённость внутриматочных спаек |
1 | - тонкие и/или плоскостные спайки в устьях маточных труб, которые легко разрушаются тубусом гистероскопа; |
2а | - единичные плотные сращения соединяют противоположные зоны полости матки; – устья маточных труб визуализируются; – спайки не могут быть разделены тубусом гистероскопа. |
2б | - полное заращение внутреннего зева, при этом верхняя часть полости матки выглядит нормально; |
3 | - множественные плотные сращения соединяют противоположные зоны полости матки; – устье одной маточной трубы полностью заращено; |
4 | - выраженные плотные сращения с частичным заращением полости матки и устьев обеих маточных труб; |
5а | -выраженное рубцевание и разрастание или замещение плотной соединительной тканью внутреннего слоя матки в сочетании со спайками 1 или 2 степени; – аменорея или выраженная гипоменорея; |
5б | - выраженное рубцевание и фиброз эндометрия в комбинации со спайками 3 или 4 степени; – аменорея. |
Примечание: Европейское общество Гинекологов Эндоскопистов, ESGE;1995 год ; по ист. [25]
Классификация по March, 2011 год,
· Умеренная — нежные и тонкие спайки, которые занимают менее 25% полости матки. Устья маточных труб и дно матки свободны или минимально вовлечены
· Средняя — спайками покрыто от 25 до 75% полости матки, устья маточных труб и дно частично заращены
· Выраженная — дно и устья маточных труб полностью заращены, спайками покрыто более 75% полости матки
Следует помнить, что профилактика ВМС всегда более эффективна, чем лечение. С этой целью важно максимально минимизировать воздействие на эндометрий, особенно при беременности и в послеродовом периоде .
2. Основная часть
Учитывая прямую зависимость риска возникновения спаек от травматизации эндометрия, объема оперативных вмешательств и тяжелые последствия данной патологии, возникает потребность в рутинной профилактике ВМС, особенно в случаях, когда у пациентки имеются репродуктивные цели и предполагается большой объем оперативного вмешательства. Профилактика ВМС при гистероскопической хирургии может заключаться в двух принципиальных аспектах: снижение травматичности вмешательств, использование противоспаечных барьеров, как физических, так и медикаментозных. Снижение травматичности вмешательства достигается за счет миниатюризации и совершенствования хирургического оборудования, улучшения хирургических методик, в то время как использование противоспаечных барьеров заключается в медикаментозном воздействии на реневую поверхность и создании антиадгезивного барьера между органами и их частями. Методы профилактики подробнее указаны в таблице №3.
Таблица 3 - Методы профилактики
Хирургические аспекты | Противоспаечные барьеры |
применение гистероскопов с меньшим диаметром внешнего тубуса , , | внутриматочные системы (IUD – intrauterine device) , , |
применение вагиноскопии – отказ от фиксации шейки матки и механического расширения цервикального канала , | внутриматочный баллон или катетер Foley , , |
отказ от кюретажа и электроинструмента , , | применение противоспаечных гелей , , |
Снижение травматичности при гистероскопических вмешательствах не только снижает риск развития ВМС, но и в разы увеличивает безопасность проводимой процедуры, уменьшая количество интраоперационных и ранних послеоперационных осложнений. При исследовании причин и механизмов спаечного процесса в полости матки, высказывалось мнение о взаимосвязи воспалительных процессов восходящего характера, влияния микрофлоры на повышения риска развития спаечного процесса. Однако рутинное использование антибиотикотерапии при любых гистероскопических вмешательствах не нашло одобрения мировых профессиональных сообществ , .
Говоря о противоспаечных барьерах, в настоящее время предпочтение отдается противоспаечным гелям, так как наличие инородного тела в полости матки снижает качество жизни пациентки в послеоперационном периоде и подходит не для всех групп пациенток. Гели просты в использовании, они образуют на поверхности полости матки пленку, которая выполняет функцию противоспаечного барьера на время интенсивного заживления тканей, препятствуют контакту ее стенок, таким образом, предотвращая образование ВМС. Гелеобразные формы удобны в применении, введение противоспаечного геля возможно под визуальным контролем (через канал притока гистероскопа, замещая тем самым расширяющую среду в полости матки), или непосредственно после проведения процедуры с использованием специального аппликатора. Также одним из основных преимуществ противоспаечных гелей является равномерное покрытие всей раневой поверхности, даже в труднодоступных местах полости матки. Наибольшее распространение получили барьеры из биоразлагаемых материалов, которые полностью выводятся из организма. Современные противоспаечные гели имеют два компонента: гиалуроновую кислоту – с целью медикаментозного снижения развития спаек и карбоксиметилцеллюлозу – с целью формирования механического барьера. Гиалуроновая кислота была предложена в качестве барьерного агента для предотвращения адгезии и имеет благоприятные для организма биологические свойства, направленные на ускорение репаративных процессов. Механизм действия реализуется на очень ранней стадии заживления тканей – первых 3–4х суток и заключается в подавлении адгезии фибробластов и тромбоцитов, активности макрофагов, а также путем ингибирования образования фибрина и создания защитного барьера на поврежденном участке ткани. Период полураспада гиалуроновой кислоты – около 1–3-х дней. Полное расщепление в организме происходит в течении 4-х суток с помощью фермента гиалуронидазы . Другой антиадгезивный компонент под названием карбоксиметилцеллюлоза представляет собой̆ высокомолекулярный̆ полисахарид, который̆ также служит эффективным противоспаечным средством. Данный компонент биологически безопасен и применяется в качестве субстрата для закрепления и пролонгирования действия гиалуроновой кислоты на поверхности ткани. Действует как механический барьер . Говоря о механических барьерах, используемых для профилактики ВМС, возможно применение внутриматочного баллона (катетер Foley) или внутриматочной спирали. Но их серьезным недостатком является зависимость клинического эффекта от площади изделия. По этой причине при использовании внутриматочной спирали рекомендуют делать выбор в пользу петли Липпса и отказа от современных Т-образных спиралей .
Применение данных противоспаечных гелей рекомендовано крупными профессиональными сообществами. В рекомендациях Королевского колледжа акушерства и гинекологии (RCOG Великобритания), посвященных профилактике спаечного процесса , , отмечено, что любое хирургическое вмешательство на органах живота и малого таза ведет к образованию спаек и связанных с ними осложнений в отдаленном периоде. Во избежание таких рисков необходимо применение противоспаечных барьерных средств. Наиболее эффективными противоспаечными средствами в акушерстве и гинекологии признаны производные гиалуроновой кислоты. Американская ассоциация гинекологов лапароскопистов (AAGL) рекомендует применять барьерные противоспаечные средства (гели), в состав которых входит гиалуроновая кислота, после проведения любых внутриматочных вмешательств, т. к. доказано, что эти средства достоверно снижают риск образования спаечного процесса в полости матки , . В клинических рекомендациях по проведению гистероскопии Польского Общества Гинекологов и Акушеров (PSGO) так же рекомендовано применение гелей с гиалуроновой кислотой и/или карбоксиметилцеллюлозой , .
Отдельно стоит отметить перспективные методы лечения синдрома Ашермана, такие как использование клеточной терапии. Опубликованные клинические данные и данные о фертильности впоследствии говорят о перспективности данных методик. При использовании клеточной терапии менструальная функция возвращается к норме в течение 6 месяцев после применения, а также регистрируются три спонтанные беременности и беременности после экстракорпорального оплодотворения. Описанные в литературе результаты, представляют собой лишь первый взгляд на лечение такого типа, для пациентов с синдромом Ашермана с успешным исходом менструального цикла и фертильности , , . Также перспективу имеет метод применения тромбоцитарно-обогащенной аутоплазмы крови (PRP-терапия). Введение аутоплазмы непосредственно в эндометрий способствует улучшению васкуляризации эндометрия. Однако данная методика на этапе исследования и получения достоверных отдаленных результатов , .
В настоящей публикации приведены клинические примеры по большей части профилактического применения различных комбинаций противоспаечных мер при проведении гистероскопии в условиях fast-track хирургии, за 2021-2023 год.. Более подробно клинические примеры приведены в таблице №4.
Таблица 4 - Клинические примеры
Параметр | Пациентка З, 24 года | Пациентка М, 28 лет | Пациентка Е, 43 года | Пациентка Д, 33 года | Пациентка Е, 26 лет | Пациентка А, 30 лет | Пациентка Ф, 32 года |
Показание к оперативному вмешательству | Бесплодие I (исключение трубно-перитонеального и маточного фактора) | Бесплодие I (исключение трубно-перитонеального и маточного фактора) | Спаечный процесс в полости матки (по данным УЗИ органов малого таза), аномальное строение матки U1 T-Shaped по классификации ESHRE/ESGE, бесплодие II | Спаечный процесс в полости матки, синдром Ашермана II стадии (5 баллов по ASRM) Хронический эндометрит | Спаечный процесс в полости матки, синдром Ашермана I стадии (4 баллов по ASRM) Хронический эндометрит | Полип цервикального канала, спаечный процесс в полости матки, Ашермана I стадии (2 баллов по ASRM) | Бесплодие I (трубно-перитонеальный фактор по гистеросальпингоскопии) Рубец на матке после операции кесарево сечение |
Акушерский анамнез | Беременности - 0, неудачная попытка ЭКО | Беременности - 0 | Беременности - 2, роды - 1 (через естественные родовые пути, без осложнений), 1 - фарм. прерывание беременности | Беременности - 0 | Беременность-2, роды -1 (через естественные родовые пути без осложнений), 1 неразвивающаяся беременность – вакуум-аспирация содержимого полости матки | Беременности - 1, самопроизвольный выкидыш на 9-й неделе беременности - вакуум-аспирация содержимого полости матки | Беременности – 1 (кесарево сечение по поводу преэклампсии) |
Гинекологический (хирургический) анамнез | Гистероскипия, раздельное диагностическое выскабливание 2-х кратно, Лапароскопия диагностическая, хромгистеросальпингография- по выше указанной патологии | Гистероскипия, раздельное диагностическое выскабливание 2-х кратно по поводу полипа цервикального канала, Гистероскипия, раздельное диагностическое выскабливание, лапароскопия диагностическая, хромгистеросальпингография - по выше указанной патологии | Гистероскипия, раздельное диагностическое выскабливание однократно по поводу полипа эндометрия | Гистероскопия по поводу внутриматочных синехий | Вакуум-аспирация содержимого полости матки+ раздельное диагностическое выскабливание | Вакуум-аспирация содержимого полости матки+ раздельное диагностическое выскабливание | Кесарево сечение |
Объем оперативного вмешательства | Гистероскопия+ «bubble» тест (тест на проходимость маточных труб), разделение синехий, прицельная (grasper) биопсия эндометрия | Гистероскопия+ «bubble» тест (тест на проходимость маточных труб), прицельная (grasper) биопсия эндометрия | Гистероскопия+«bubble» тест (тест на проходимость маточных труб), прицельная (grasper) биопсия эндометрия, гистероскопическая метропластика | Гистероскопия+«bubble» тест(тест на проходимость маточных труб), разделение синехий прицельная (grasper) биопсия эндоцервикса и эндометрия | Гистероскопия разделение внутриматочных синехий | Гистероскопия+полипэктомия, разделение внутриматочных синехий | Гистероскопия+ «bubble» тест (тест на проходимость маточных труб), бужирование маточного устья справа, прицельная (grasper) биопсия и эндометрия |
Результат оперативного вмешательства | Синехии полностью разделены. Трубно-перитонеальный и маточные факторы исключены («bubble» тест + послеоперационное УЗИ органов малого таза) | Маточные фактор исключен, проходимость маточных труб сохранена с одной стороны («bubble» тест + послеоперационное УЗИ органов малого таза) | Хирургическая коррекция анатомии полости матки с U1 T-Shaped до U0 по классификации ESHRE/ESGE, проходимость маточных труб сохранена с обеих сторон («bubble» тест + послеоперационное УЗИ органов малого таза) | Синехии полностью разделены, проходимость маточных труб восстановлена с обеих сторон («bubble» тест + послеоперационное УЗИ органов малого таза) | Синехии полностью разделены. | Удаление полипа в пределах здоровых тканей, внутриматочне синехии полностью разделены. | Восстановление проходимости маточной трубы справа («bubble» тест + послеоперационное УЗИ органов малого таза) |
Условия проведения вмешательства + анестезиологическое пособие | Дневной стационар (fast-track протокол) + в/в анестезия со спонтанным дыханием | Дневной стационар (fast-track протокол)+ в/в анестезия со спонтанным дыханием | Дневной стационар (fast-track протокол) + в/в анестезия со спонтанным дыханием | Дневной стационар (fast-track протокол) + в/в анестезия со спонтанным дыханием | Дневной стационар (fast-track протокол) + в/в анестезия со спонтанным дыханием | Дневной стационар (fast-track протокол) + в/в анестезия со спонтанным дыханием | Дневной стационар (fast-track протокол) + в/в анестезия со спонтанным дыханием |
Методы профилактики ВМС | Вагиноскопия, отказ от кюретажа в пользу - grasper-биопсии эндометрия, введение противоспаечного барьера (гиалуроновая кислота+ карбоксиметилцеллюлоза) | Отказ от кюретажа в пользу - grasper-биопсии эндометрия, введение противоспаечного барьера (гиалуроновая кислота+ карбоксиметилцеллюлоза) | Вагиноскопия, отказ от электрохирургия в пользу использования внутриканальных инструментов 5 Fr, введение противоспаечного барьера (гиалуроновая кислота+ карбоксиметилцеллюлоза) | Отказ от кюретажа в пользу - grasper-биопсии эндометрия, введение внутриматочного баллона 8 Fr, извлечение через 7 дней | Отказ от электрохирургия в пользу использования внутриканальных инструментов 5 Fr, введение противоспаечного барьера (гиалуроновая кислота+ карбоксиметилцеллюлоза) | Отказ от кюретажа и электрохирургии в пользу использования внутриканальных инструментов 5 Fr, введение внутриматочного баллона 8Fr, извлечение через 7 дней | Отказ от кюретажа и электрохирургии в пользу использования внутриканальных инструментов 5 Fr, введение противоспаечного барьера (гиалуроновая кислота+ карбоксиметилцеллюлоза) |
Отдаленные результаты, от 1 до 3-х месяцев | При контрольной гистероскопии через 1 месяц, данных за рецидив не получено, самостоятельная беременность через 3 месяца | Учитывая отсутствие спаечного процесса, наблюдение в динамике не требуется | Проведена контрольная гистеросальпингография, полость матки треугольной формы, данных за спаечный процесс не получено | При контрольной гистероскопии через 1 месяц, данных за рецидив не получено | При контрольной гистероскопии через 1 месяц, данных за рецидив не получено | При контрольной гистероскопии через 1 месяц, данных за рецидив не получено | При контрольной гистероскопии через 1 месяц данных за спаечный процесс в полости матки не получено, маточные трубы проходимы с обеих сторон |
Стоит отметить факторы, на основании которых было принято решение применения противоспаечных барьеров:
• подозрение на бесплодие трубно-перитонеального генеза;
• подозрение или наличие спаечного процесса (по данным гистероскопии);
• репродуктивная цель;
• оперативные вмешательства на полости матки в анамнезе;
• большой оперативный объем.
В клинической практике отдавалось предпочтиение использованию противоспаечного геля в 5-ти из 7-ми описанных случаев. В 2-х случаях производилось внутриматочное введение катетера Foley 8 Fr под УЗ-контролем (фото №1) и удаление его через 7 дней, по причине невозможности применения противоспаечного геля. Учитывая отдаленные результаты оперативного лечения, данных за наличие ВМС не получено, у одной из представленных пациенток произошла самостоятельная беременность, без патологии.
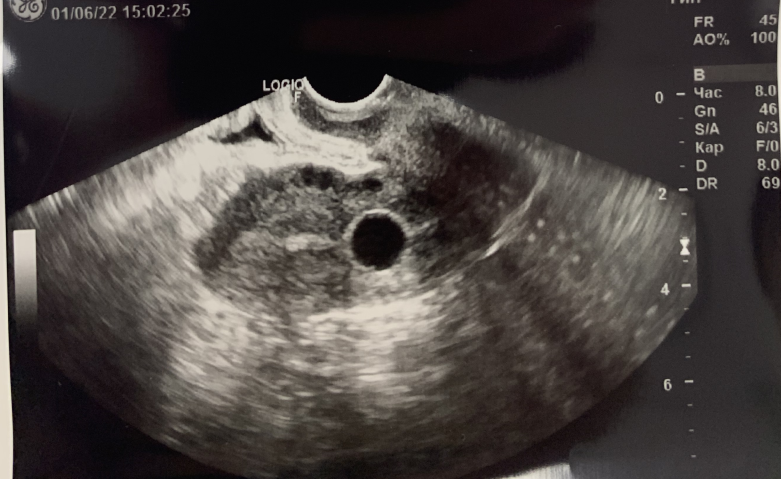
Рисунок 1 - Катетер Foley в полости матки, при трансвагинальном УЗ-сканировании
3. Заключение
Современные знания в отношении этиологии и патогенеза синдрома Ашермана позволяют проводить большие объемы оперативных вмешательств в полости матки с максимальной безопасностью. Фундаментальный научный подход к рутинным гинекологическим операциям позволяет максимально снизить риск осложнений как в раннем, так и в отсроченном периоде. Вышеуказанные клинические примеры показывают оценку рисков возникновения спаечного процесса в полости матки, которая основана на анамнестических данных пациенток и данных об объеме планируемого оперативного вмешательства. Также в приведенных примерах описана возможность использования различных противоспаечных методик в зависимости от возможности операционной. Начиная от технических особенностей оперативного вмешательства – отказ от расширения цервикального канала, кюретажа и электрохирургии до использования комбинаций методов и современных противоспаечных гелей. Это дает возможность минимизировать риски осложнений, даже при невозможности применения всех методов.
Описанные хирургические техники введены в рутинную практику и просты в применении. Использование данных методик не вызывало сложностей у специалистов, проводивших операции. Хирургические техники были использованы во всех описанных случаях. Также, в комбинации с хирургическими техниками, применялись и противоспаечные барьеры: катетер Foley 8Fr и противоспаечный гель. Использование катетера вносило определенные сложности при ведении пациентки – УЗ-контроль интраоперационно и удаление катетера через неделю после вмешательства. Стоит отметить определенные причины дискомфорта для пациенток: факт нахождения инородного предмета в полости матки, длительность периода использования и необходимость повторного посещения врача. По этим причинам такой барьер использовался реже. В основном решение об использовании данного барьера принималось интраоперационно, в случаях проведенного обширного адгезиолизиса в полости матки и невозможности применения геля (поливалентная аллергия у пациенток). В большинстве же случаев использовался противоспаечный гель с гиалуроновой кислотой и карбоксиметилцеллюлозой. Применение геля более эргономично и комфортно для пациентки в сравнении с катетером Foley, но экономически более затратно. Немаловажно, что все описанные случаи проводились в условиях fast-track хирургии, что направлено на ускоренную реабилитацию и максимально быстрое восстановление репродуктивной функции. На основании практического опыта, комбинация хирургических техник и применение противоспаечного геля, имеет максимальный эффект. Так как они оказывают прямое влияние на этиопатогенетические факторы развития синдрома Ашермана, имеют возможность использование в протоколе fast-track и достаточны просты в использовании. Авторами рекомендовано рутинное применение данных методик и их комбинаций. В перспективе проведение более обширных мультицентровых рандомизированных клинических исследований с последующим мета-анализом.
