Temperature dependences of electrode and redox potentials of gallium in melts based 3LiCl–2KCl and 6NaCl–9KCl–5CsCl on eutectic mixtures
Temperature dependences of electrode and redox potentials of gallium in melts based 3LiCl–2KCl and 6NaCl–9KCl–5CsCl on eutectic mixtures
Abstract
This work was aimed at determining temperature dependences of formal standard electrode and redox potentials of gallium for Ga3+/Ga, Ga3+/Ga+, Ga+/Ga redox couples in chloride melts. The electrochemical properties of gallium were studied in melts based on 3LiCl–2KCl and 6NaCl–9KCl–5CsCl eutectic mixtures in the temperature range of 430–700 and 500–760 oC, respectively. The measurements were performed using zero current potentiometry. In molten chloride electrolytes in contact with metallic gallium, the presence of gallium ions in two oxidation states, Ga(III) and Ga(I), were found. As a result of the analysis of the experimentally measured potentials, the formal standard electrode and redox potentials of gallium, E*(Ga/Ga(III)), E*(Ga/Ga(I)) and E*(Ga(I)/Ga(III)), in molten mixtures of alkali metal chlorides.
1. Введение
В настоящее время для промышленной переработки отработавшего ядерного топлива (ОЯТ) используют метод жидкостной экстракции, который обладает рядом недостатков. В частности данная технология не позволяет перерабатывать маловыдержанное ОЯТ с высокой глубиной выгорания. Одним из альтернативных подходов к переработке ОЯТ является использование неводных процессов, где в качестве рабочих сред выступают расплавы солей или металлов. Данные среды обладают очень высокой радиационной стойкостью. Кроме того, они не содержат замедлителей нейтронов, что позволяет работать с высококонцентрированными по делящимся материалам системами.
Одним из перспективных неводных методов переработки ОЯТ является селекция компонентов ОЯТ в системе «солевой расплав – жидкий металл (сплав)». Процессы распределения компонентов в данных системах имеют электрохимическую природу. Одним из предпочтительных жидкометаллических электродов является металлический галлий, или же сплавы на его основе . Для прогнозирования поведения рассматриваемой системы необходимо обладать достоверной информацией об электрохимических свойствах всех элементов, участвующих в процессе, в том числе и компонентов металлических сплавов, включая галлий.
В настоящее время наибольшее предпочтение при выборе солевого электролита отдают относительно легкоплавкой эвтектической смеси хлоридов лития и калия, 3LiCl–2KCl. Альтернативным солевым электролитом является более дорогая, но менее гигроскопичная тройная эвтектическая смесь хлоридов натрия калия и цезия.
Представленные в открытой литературе исследования электрохимических свойств галлия содержат противоречивую информацию. Результаты измерения ЭДС гальванического элемента Ga(ж)│расплGaClz, LiCl–KCl║расплLiCl│Cl2, C, при 923–1067 К согласно выводам авторов показали наличие двух типов ионов галлия. Данные выводы согласуются с результатами циклических вольтамперометрических измерений, выполненных в расплавах (3LiCl–2KCl)–GaCl3 в работах , . Исследование термодинамики образования хлоридов галлия в эвтектическом расплаве LiCl–KCl–CsCl при 300–400 °C также показало присутствие в расплаве, контактирующем с металлическим галлием, двух ионных форм галлия, Ga3+ и Ga+ . Однако полярографические измерения, выполненные в расплаве (3LiCl–2KCl)–GaCl3, показали одностадийный процесс восстановления .
Неопределенность имеющихся в литературе мнений относительно механизма восстановления ионов галлия в хлоридных расплавах привела к проведению нами дополнительных исследований , , . По итогу данных работ можно однозначно говорить о наличии в системах (3LiCl–2KCl)–GaCl3 и (6NaCl–9KCl–5CsCl)–GaCl3, контактирующих с металлическим галлием, ионов Ga3+ и Ga+. Полученные в указанных работах циклические вольтамперограммы и катодные поляризационные кривые позволяют говорить о протекании в данных системах трех электрохимических процессов, протекающих при близких значениях потенциалов и соответствующих перезаряду Ga3+/Ga, Ga3+/Ga+, Ga+/Ga. Однако в литературе отсутствуют достоверные непротиворечивые сведения о величинах условных стандартных электродных и окислительно-восстановительных потенциалов для данных электрохимических процессов.
Поэтому целью настоящей работы являлось установление температурных зависимостей условных стандартных электродных и окислительно-восстановительных потенциалов для электрохимических процессов Ga3+/Ga, Ga3+/Ga+, Ga+/Ga в расплавах на основе эвтектических смесей 3LiCl–2KCl и 6NaCl–9KCl–5CsCl.
2. Методы и принципы исследования
Эксперименты проводили в расплавах на основе эвтектических смесей 3LiCl–2KCl (58 моль. % LiCl, Tпл. = 352 oC) и 6NaCl–9KCl–5CsCl (30 мол. % NaCl, 24,5 моль. % KCl, Tпл. = 480 oC). Смеси требуемого состава были приготовлены из сплавлением навесок индивидуальных хлоридов щелочных металлов. Хлориды лития, натрия, калия и цезия квалификации х.ч. или ос.ч. предварительно подвергали дополнительной очистке по методике, описанной ранее . Расплавы, содержащие хлорид галлия, были получены взаимодействием металлического галлия (чистотой 99,999%) с хлористым водородом в среде соответствующей расплавленной соли.
Хронопотенциометрические измерения проводили с использованием потенциостата/гальваностата AUTOLAB PG302N. Эксперименты выполняли в стандартных двухэлектродных ячейках в атмосфере аргона (99,998 %). Конструкция электрохимической ячейки схематически представлена на рисунке 1. Рабочим электродом выступал металлический галлий. В качестве токоподвода к галлию использовали вольфрамовую проволоку, которую защищали от контакта с солевым электролитом керамической соломкой. Хлорный электрод сравнения состоял из графитовой трубки, погруженной в исследуемый расплав, находящийся в кварцевом чехле, закрытом с нижнего конца диафрагмой из асбеста. Асбест предварительно прокаливали при 700 oC. В графитовую трубку поступал непрерывный ток хлора, который получали электролизом расплавленного хлорида свинца.
Эксперименты в расплаве на основе эвтектической смеси 3LiCl–2KCl проводили в диапазоне температур 430–700 oC. Для расплавов на основе тройной эвтектической смеси 6NaCl–9KCl–5CsCl измерения проводили в интервале 500–760 oC.
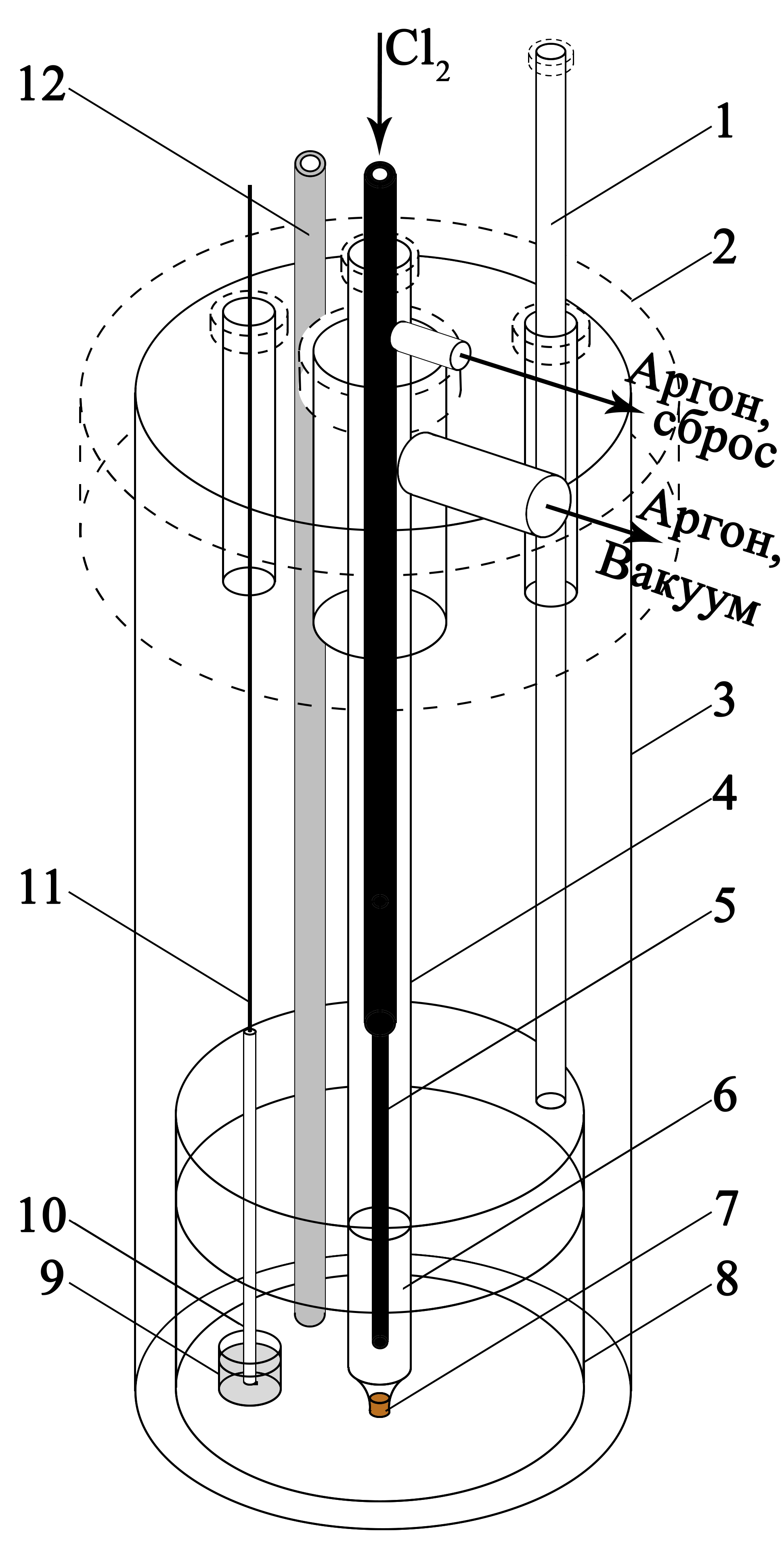
Рисунок 1 - Конструкция электрохимической ячейки для хронопотенциометрических измерений:
1 – кварцевый капилляр для пробоотбора; 2 – пробка из вакуумной резины; 3 – кварцевая ячейка; 4 – чехол хлорного электрода; 5 – графитовая трубка для подачи Cl2; 6 – соль-растворитель; 7 – диафрагма из асбеста; 8 – тигель из оксида алюминия с солевым электролитом; 9 – тигель из оксида бериллия с Ga; 10 – алундовый чехол для токоподвода рабочего электрода; 11 – вольфрамовый токоподвод рабочего электрода; 12 – чехол из оксида алюминия для термопары
3. Основные результаты
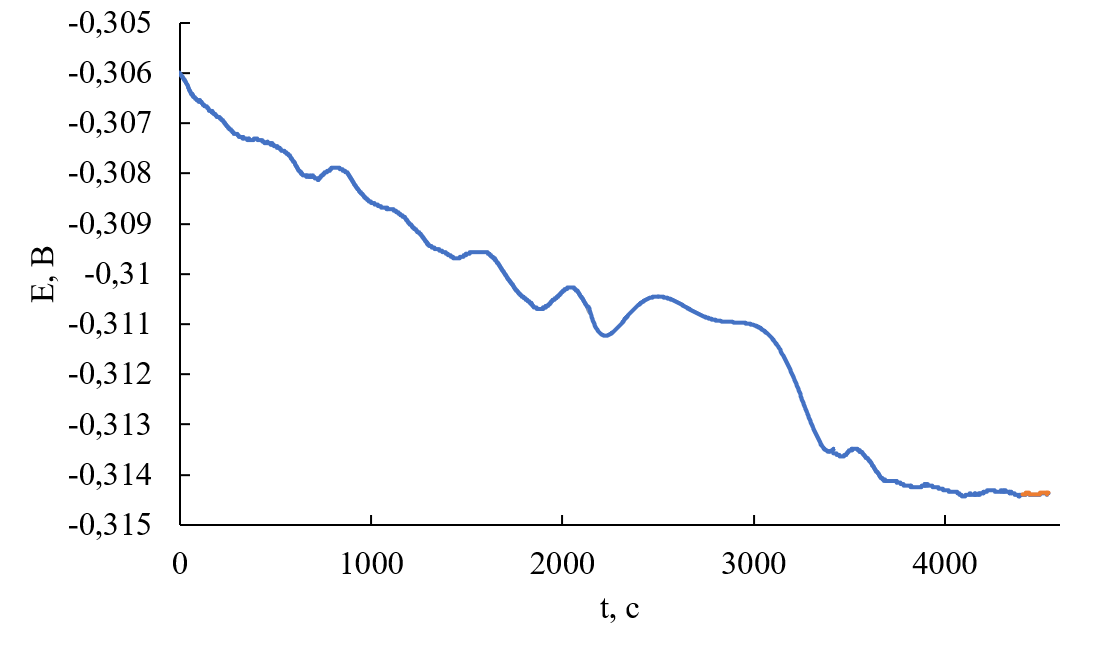
Рисунок 2 - Пример хронопотенциометрической кривой для электролита (3LiCl–2KCl)–GaCl3 измеренной при температуре 550 oC
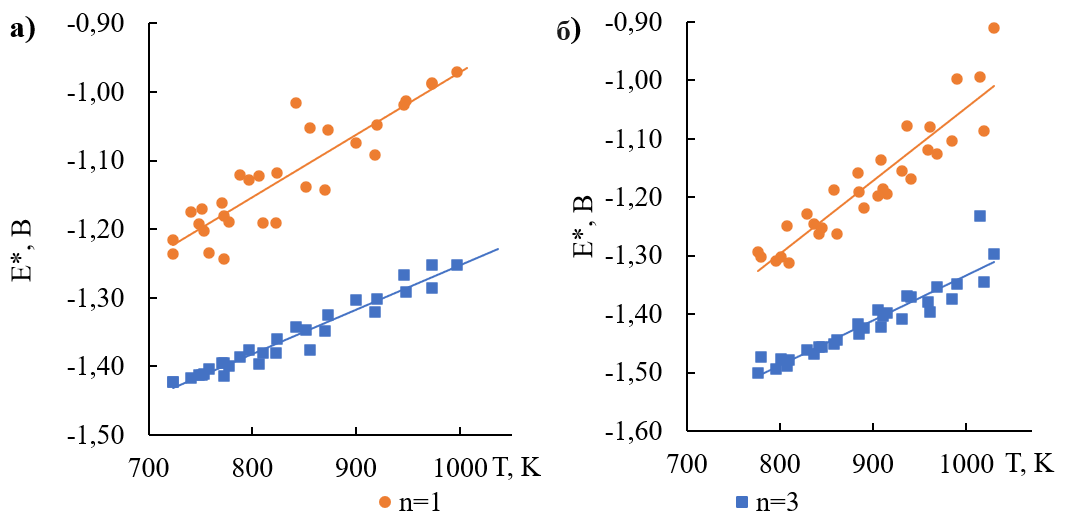
Рисунок 3 - Температурные зависимости условного стандартного электродного потенциала галлия для электролитов на основе 3LiCl–2KCl (а) и 6NaCl–9KCl–5CsCl (б) относительно хлорного электрода сравнения, рассчитанные в предположении присутствия в расплаве ионов Ga+ и Ga3+
где X – доля ионов Gan+, .
В случае сравнения равновесных электродных потенциалов двух параллельных измерений, выполненных при одинаковой температуре, из уравнения Нернста следует:
Совершив необходимые преобразования получим:
Объединив данные, полученные в ходе различных измерений, выполненных в рамках данного исследования, а также результаты предыдущих работ
, , , , , был получен массив значений потенциалов при различных температурах и концентрациях галлия в системе. Приняв погрешность определения температуры расплава 10 оC, данный массив был разбит на группы по температуре. Для каждой группы были рассчитаны Xi/X1.Поскольку зависимости ,
имеют линейный характер коэффициент корреляции истинных значений условных стандартных электродных потенциалов и температуры равен единице. Отсюда целесообразно сделать вывод, что чем ближе коэффициенты корреляции получаемых зависимостей к единице, тем ближе они к идеальному случаю.
С помощью функции поиска решения в программном обеспечении Excel, были подобраны значения X1, при которых коэффициенты корреляции зависимостей получаемых условных стандартных электродных потенциалов максимальны. Исходя из высказанного ранее предположения, следует что найденные зависимости максимально близки к истинным с учетом погрешностей измерения, расчетов, объема выборки, а также всех принятых допущений. Данные зависимости для электролитов (3LiCl–2KCl)–GaCl3 и (6NaCl–9KCl–5CsCl)–GaCl3 представлены на рисунках 4a и 4b, соответственно.
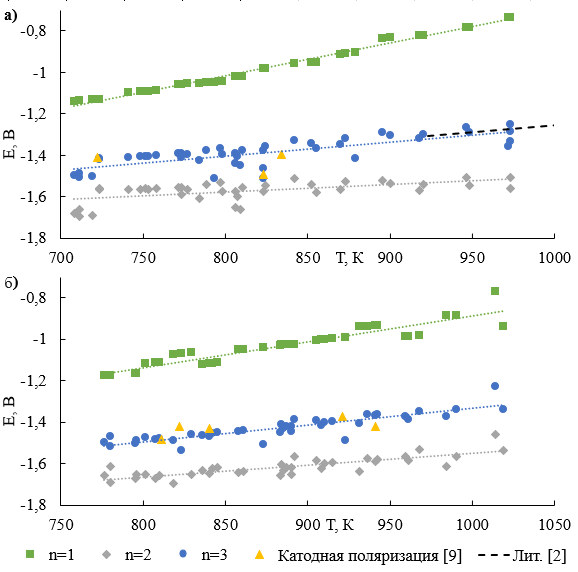
Рисунок 4 - Зависимости условного стандартного электродного потенциала галлия от температуры, для электролитов (3LiCl–2KCl)–GaCl3 (а) и (6NaCl–9KCl–5CsCl)–GaCl3 (б) относительно хлорного электрода сравнения
Примечание: литературные данные для расплава (3LiCl–2KCl)–GaCl3 [2] показаны пунктирными линиями; треугольные метки указывают на результаты, полученные в результате анализа катодных поляризационных кривых [9]
и для электролита (6NaCl–9KCl–5CsCl)–GaCl3:
4. Заключение
Определены значения электродных и окислительно-восстановительных потенциалов галлия в расплавах на основе эвтектических смесей 3LiCl–2KCl и 6NaCl–9KCl–5CsCl. Получены температурные зависимости условных стандартных потенциалов для пар Ga/Ga3+, Ga+/Ga3+ и Ga/Ga+. Повышение температуры или уменьшение среднего катионного радиуса соли-растворителя приводит к сдвигу значения потенциала в положительную область, указывая на снижение устойчивости комплексных хлоридных ионов галлия в исследованных расплавах.
