INFLUENCE OF ELECTROCHEMICAL DEPOSITION MODES ON THE STRUCTURE AND MORPHOLOGY OF THE Ni – In SYSTEM
INFLUENCE OF ELECTROCHEMICAL DEPOSITION MODES ON THE STRUCTURE AND MORPHOLOGY OF THE Ni – In SYSTEM
Abstract
Structural and morphological changes were carried out in the Ni-In electrochemical system to form structural traps in the form of indium intermetallides.
The influence of the basic characteristics of electrolysis (the composition of the structural components of the elements of the electrochemical system – Ni and In and the density of the cathode current) in the direction of the formation of topology, morphology, microstructure, including nanostructures, and their phase components to ensure appropriate properties has been.
The presence of structural traps in the Ni-In electrochemical system served as an indicator of the required structure to be built. In particular, in the system under study, the synthesis of indium intermetallides acting as traps for hydrogen atoms was realized in the Ni-In system, which is not predisposed to its accumulation.
The analyzed and generalized information on complex structural studies of the coating allowed us to determine the quantitative composition of the electrolyte. In fact, in this work, the concept is practically implemented: the formed structure of the system – the composition of the nickel plating electrolyte according to the basic structural components – the necessary properties.
One of the most important results of the research in the presented article can be considered:
1. The studied accumulation of In in the Ni-In system is 15 wt. %. with an increase in In2(SO4)3 from 1 to 12 g/l in solution.
2. The concentration of In2(SO4)3 = 4 g/l in solution was selected for the implementation of electrosynthesis of Ni-In composites.
3. At a concentration of In2(SO4)3 = 4 g/l, intermetallic phases of the composition InNi2, InNi3, In3Ni2 and η–In27Ni10 are generated, fixed by the diffractometric approach.
4. The synthesis of the Ni70In30 composite from an electrolyte with a concentration of In2(SO4)3 = 4 g/l has been realized, which has a distinctive feature of a structure that creates conditions for hydrogen retention, with potential subsequent doping.
5. Topological surveys of the Ni70In30 coating indicate the development of its surface due to the formation of insular nuclei during the growth of the film at the initial phase of formation.
1. Введение
Легированные материалы и металлические композиции с индием демонстрируют разноплановую заинтересованность и потребность в них индустриальной сферы и техносферы разнообразной профильности.
Легирование никеля индием повышает его пластичность, износостойкость, предел прочности при растяжении, облегчает обрабатываемость, повышает коррозионную стойкость, придает способность к пайке и свариваемости с токопроводящими элементами , , . Электрохимически синтезированные композиты Ni-In с содержанием индия менее 9 мас. % не склонны к накоплению водорода , . При концентрации индия более 10 мас. % образуются интерметаллические фазы, которые могут действовать как структурные ловушки для атомов водорода, если фаза имеет некогерентное связывание с матрицей Ni через сетку дислокаций.
Основная стратегия работы заключается в изменении структуры и топологии электрохимических систем с целью формирования структурных и примесных ловушек для накопления водорода. Реализация такого утверждения осуществляется на системах, которые не склонны к поглощению водорода, в частности для композита Ni-In, синтезируемого гальваническим способом , .
Цель конкретной публикации заключается в отражении итогов изыскания взаимосвязи: формируемая структура и топология системы Ni-In – состав электролита никелирования по базовым структурным компонентам (Ni и In) – необходимые свойства (способность накапливать водород , ).
2. Методы и принципы исследования
Соединения Ni-In (далее электрохимические композиты) синтезировали из электролита с базовыми ингредиентами, г/л: NiSO4·7H2O = 140, Na2SO4·10H2O = 20, Н2Маl = 52 г/л (малоновая кислота); In2(SO4)3 = 0; 0,5; 1; 2; 4; 8; 12 и композицией добавок, гальваническим способом , . Анод – Pt, катод – Cu.
С точки зрения технологической практики наиболее целесообразные режимы электролиза Ni основы: плотность катодного тока, ik – 2-3 А/дм2, температура электролита – 20 °C, pH – 4,0-5,0. Приведенные технологические параметры удовлетворяют необходимым условиям электролиза: скорость роста (υ) Ni-In-пленки, выход по току (ВТNi-In), и предоставляют возможность синтеза однотипных, идентичных по толщине образцов при достаточной, соответствующей требованиям техпроцесса коррозионной стойкости и прочности. Для учета воздействия критериев электролиза по отдельности, то есть индивидуально на формирование пленки образца, менялась одна конкретная характеристика.
В конкретной публикации описано воздействие только ik и СIn2(SO4)3 (концентрация In2(SO4)3 в электролите). Основополагающий принцип изыскания – учет взаимовлияния базовых характеристик электролиза (состав структурных составляющих элементов электрохимической системы – Ni и In и ik) в направлении формирования топологии, морфологии, микроструктуры, и их фазовых составляющих для обеспечения соответствующих свойств. Конечный итог изыскания – базовый состав раствора электролита по информации об исследованной структуре формируемого образца Ni-In.
Микроструктура образцов на атомном уровне проверялась на сканирующем зондовом микроскопе Solver P47 , , , . Фазовый состав оценивался на приборе ДРОН 2.0 принципами рентгеновской дифракции , , , .
3. Результаты исследований
При варьировании ik от 0,5 до 3 А/дм2, наблюдается уменьшение содержания In в системе от 14 до 1,5 вес. % (рис. 1а), а содержание Ni возрастает от 24 до 96 вес. % (рис. 1б). Полученная закономерность обусловлена большей скоростью разряда катионов Ni2+, чем катионов In3+, и соответственно различными наклонами парциальных кривых выделения Ni2+ и In3+, согласно изысканиям в , .
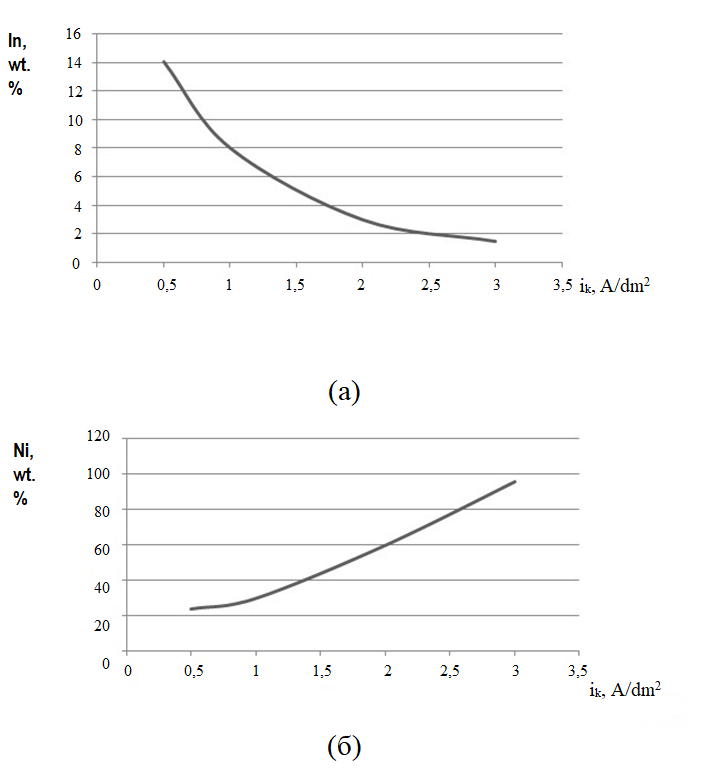
Рисунок 1 - Зависимость элементного состава образцов Ni-In от ik:
(а) – содержание In; (б) – содержание Ni
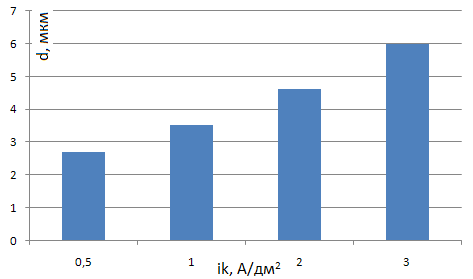
Рисунок 2 - Зависимость d от ik
Примечание: время электролиза 60 минут
Влияние содержания In2(SO4)3 в растворе на элементный состав образцов Ni-In иллюстрирует рисунок 3 (а и б).
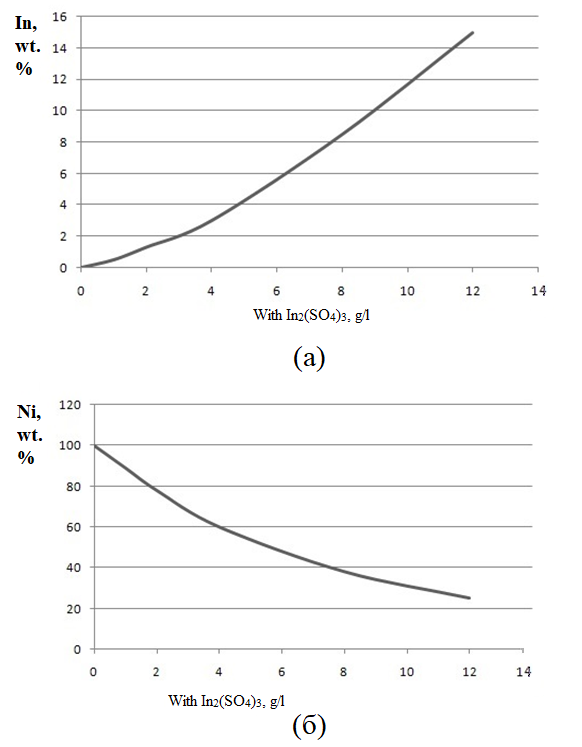
Рисунок 3 - Зависимость кумуляции Ni и In от концентрации в электролите In2(SO4)3, г/л:
(а) – процентное содержание In; (б) – процентное содержание Ni
Зависимость изменения толщины покрытия при следующем режиме осаждения: концентрация In2(SO4)3 варьируется от 0 до 12 г/л, iк = 2 А/дм2, время электролиза 1 час (рис. 4).
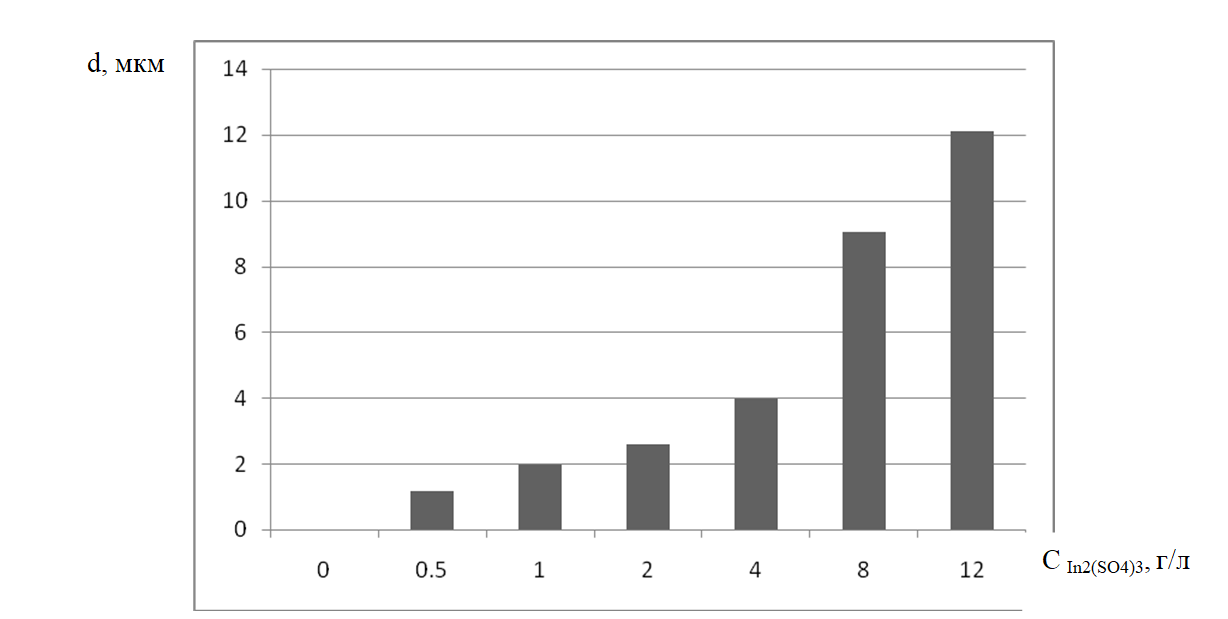
Рисунок 4 - Зависимость d от концентрации In2(SO4)3 в электролите
Топологические исследования показаны на примере состава с In2(SO4)3 = 8 г/л на рисунке 5.
Из результатов исследования следует, что топология поверхности полученных пленок развитая, каковая связана с островковыми зародышами в начальные моменты времени. Напряженность электрического поля на выступающих участках - островками выше, чем над свободными участками от осадка катода. Рост катодной пленки в островковой части начинает опережать рост основной пленки, что приводит к появлению развитой поверхности. Закономерность размера кристаллитов Ni–In от содержания In2(SO4)3 проиллюстрирована на рис. 6. Максимального размер кристаллитов 75-170 нм, то есть формируется мелкодисперсная структура наноразмера. Установленная зависимость представляет собой результирующую огибающую кривую, согласно данным трехмерной топологической диаграммы поверхности пленок Ni–In.
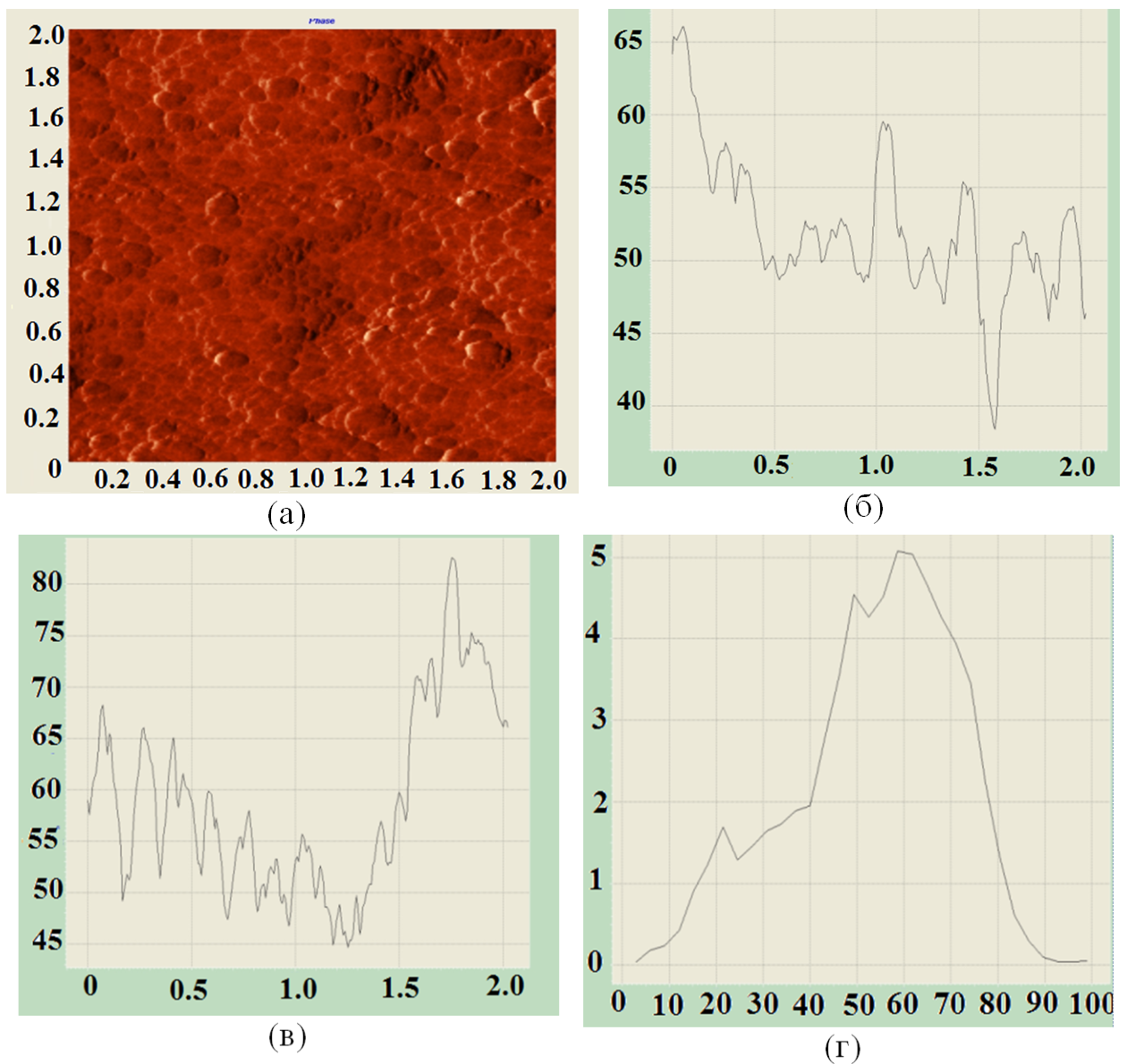
Рисунок 5 - Профилограммы поверхности покрытия Ni-In:
(a) – изображение поверхности в виде фазового контраста; (б) – профилограмма поверхности по оси x; (в) – профилограмма поверхности по оси y; (г) – гистограмма распределения неровностей поверхности
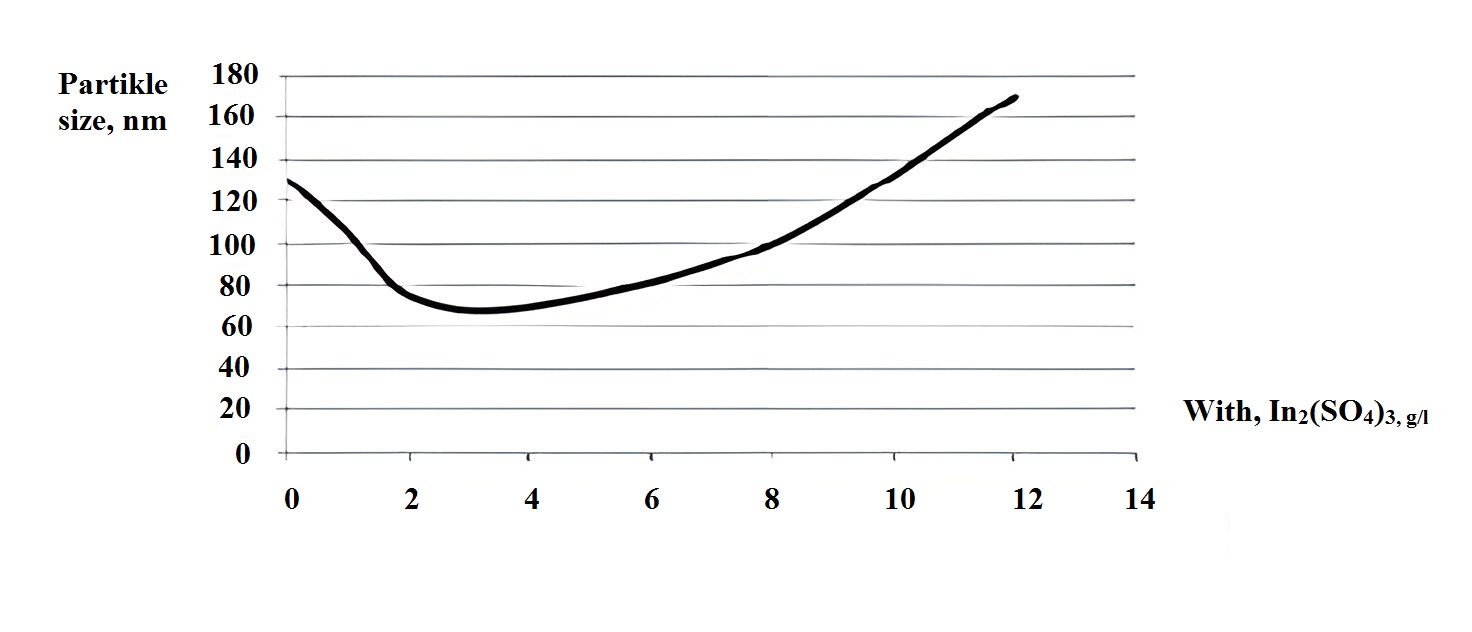
Рисунок 6 - Зависимость размера частиц от концентрации In2(SO4)3 в электролите
Таким образом, результаты эксперимента выявили, что из всех изученных составов электролита, оптимальной концентрацией является In2(SO4)3 = 4 г/л.
Электролит никелирования с данным содержанием сульфата индия (III) позволяет получать зернистые и более однородные по размеру кристаллитов Ni–In покрытия, это обеспечивает лучшие физико-механические свойства (свариваемость, коррозионную стойкость), более подробно в работе , , .
Анализ результатов показывает, что при содержании In2(SO4)3 менее 2 г/л на катоде осаждается только Ni пленка. При увеличении содержания In2(SO4)3 до 2 г/л на катоде осаждаются чистый Ni и интерметаллиды: InNi2, InNi3, In3Ni2, η–In27Ni10 , .
В осажденных электролитическим способом пленках с содержанием In2(SO4)3 – 8 г/л появляется дополнительная фаза ε-InNi. Увеличение содержания сульфата индия (III) до 12 г/л полностью связывает никель в химические соединения; линия, соответствующая чистому никелю, отсутствует.
Диаграммы состояния равновесия , не содержат фазу η-In27Ni10, однако, согласно американской международной добровольной организации, разрабатывающей стандарты для материалов ASTM (Американское общество испытаний и материалов), в системе Ni–In указана интерметаллическая фаза η–In27Ni10 с тетрагональной решеткой . Более подробно рентгенофазовые исследования в других публикациях.
Рентгеноструктурный анализ выявил данную фазу в системах, синтезированных в электролитах с содержанием In2(SO4)3 от 2 г/л и более. По-видимому, зафиксированная фаза носит неравновесный характер, и, ее присутствие зависит от способа изготовления сплава Ni-In. В представленном материале система Ni-In синтезировалась электролитическим путем при комнатной температуре. Отсутствие высоких температур при синтезе композита Ni–In, очевидно способствует стабилизации фазы η–In27Ni10. Можно предположить, что η – фаза должна образовываться при любых методах синтеза, исключающих нагрев , , .
4. Заключение
Основываясь на экспериментальных результатах, можно сделать выводы:
1. Толщина композита Ni–In пропорциональна содержанию In2(SO4)3 в электролите и ik.
2. Топология поверхности и размер зерен имеют сложную взаимосвязь от содержания сульфата индия (III) в электролите.
3. Выявлено присутствие фазы η–In27Ni10, ее существование отражено в таблицах ASTM, но она не представлена на диаграммах равновесного состояния системы Ni-In. Ее отсутствие можно объяснить тем фактом, что зафиксированная фаза является метастабильной.
Можно отметить еще одну особенность: согласно данным работы
, , синтезирован электрохимический композит Ni–In с фазовым составом – Ni70In30, с микроструктурой и топологией поверхности, обеспечивающей удержание водорода с возможным дальнейшим его допированием.Содержание водорода в экспериментальных образцах композита Ni(x) – In(y) – H(z), определенное методом термодесорбции, составляет 5,3 мас. %, что подтверждает, что гальванический композит обладает способностью накапливать водород и в дальнейшем сохранять его в виде металлических гидридов
, . Конечно, не стоит говорить о массовом использовании никель–индиевых композитов для накопления водорода, в соответствии с его индексом Кларка. Речь идет о потенциальной способности электрохимических систем, даже тех, которые не склонны к накоплению водорода, гибко изменять свою структуру по отношению к содержанию в них водорода .