STUDY OF ANTI-INFLAMMATORY ACTIVITY OF CYANOTHIOACETAMIDE DERIVATIVES IN DRUG-INDUCED OSTEOMYELITIS OF THE MANDIBLE
STUDY OF ANTI-INFLAMMATORY ACTIVITY OF CYANOTHIOACETAMIDE DERIVATIVES IN DRUG-INDUCED OSTEOMYELITIS OF THE MANDIBLE
Abstract
New cyanothioacetamide derivatives represent a potentially promising class of compounds with anti-inflammatory properties that may be effective in the treatment of osteomyelitis, which remains one of the urgent problems in the practice of dentists and maxillofacial surgeons. The choice of the bisphosphonate-associated osteomyelitis model is due to the wide use of bisphosphonates for the treatment of skeletal diseases characterised by increased bone resorption, the presence of the risk of osteonecrosis of the jaw as a complication of bisphosphonate therapy after any surgical dental procedure and the importance of inflammation in the pathogenesis of this complication.
The results of our experimental studies on the model of bisphosphonate-mediated osteomyelitis showed a distinctly pronounced anti-inflammatory activity of the new cyanothioacetamide derivatives synthesised by us, exceeding that of nimesulide. Radiographic research of the mandible showed the ability of new heterocyclic compounds derivatives of dihydropyridine, thiodiazine and thienopyridine, used at a dose of 2.5 mg/kg intragastrically for 2 weeks, to prevent the appearance of foci of bone tissue destruction after bisphosphonate-mediated osteomyelitis.
The most significant anti-inflammatory properties in the drug-induced osteomyelitis model were found for cyanothioacetamide derivatives under the codes CV-131, TD-0331, AZ-023 and Mar-075.
1. Введение
Целью работы являлся анализ клинической картины медикаментозного бисфосфонат-обусловленного остеомиелита нижней челюсти, а также изучение противовоспалительной активности новых производных цианотиоацетамида.
Бисфосфонаты (БФ) являются ведущими препаратами для лечения заболеваний скелета, характеризующихся повышенной резорбцией костей, включая метастатические заболевания костей, множественную миелому, болезнь Педжета, остеопороз и другие , . БФ прочно связываются с кристаллами гидроксиапатита, ингибируют его распад, усиливают апоптоз остеокластов, эффективно подавляя резорбцию костной ткани, особенно в местах активного ремоделирования . Длительное применение препаратов данной группы сопряжено с возможностью развития ряда патологических состояний, среди которых одним из наиболее серьезных является медикаментозный остеонекроз челюсти, который может возникнуть после любой хирургической стоматологической процедуры; наибольший риск имеют пациенты, получающие высокие дозы БФ внутривенно , .
Остеонекроз развивается в челюсти, поскольку эта кость имеет более высокую скорость ремоделирования, что делает ее более подверженной воздействию БФ . Чрезмерное подавление БФ ремоделирования в челюсти, наряду с их антиангиогенными эффектами, приводит к постарению кости, гиперминерализации, накоплению микроповреждений, повышенной хрупкости . Кроме того, БФ косвенно нарушают функцию остеобластов, препятствуя дифференцировке последних, что в конечном итоге ухудшает способность кости к заживлению, особенно в области, которая была травмирована или подвергнута хирургическому лечению и увеличивает риск остеонекроза , .
БФ также оказывают прямое токсическое действие на мягкие ткани , вызывая старение кератиноцитов полости рта, подавляя жизнеспособность клеток и миграцию кератиноцитов и фибробластов, апоптоз и некроз . BP нарушает иммунный гомеостаз слизистой оболочки полости рта, что приводит к длительному воспалению и замедленному восстановлению тканей . Многочисленными исследованиями было подтверждено, что воспаление – это патологическая характеристика бисфосфонат-обусловленного остеомиелита челюсти , , , что, наряду с широким применением бисфосфонатов для лечения заболеваний скелета, характеризующихся повышенной резорбцией костей, послужило основанием для выбора экспериментальной модели. По мере увеличения числа пожилых людей увеличивается распространенность заболеваний костей, и ожидается, что назначение бисфосфонатов и осложнения, возникающие в результате их использования, останутся высокими.
Производные цианотиоацетамида представляют собой перспективный класс органических соединений, которые могут иметь разнообразные химические структуры и свойства , , , . Что касается биологических свойств производных цианотиоацетамида, то некоторые из них, по данным литературы и наших исследований, могут обладать болеутоляющей, антимикробной, противовоспалительной, гепатопротекторной, антитоксической и противоопухолевой активностью, что делает их интересными для медицинского применения и исследований в области фармацевтики. На эти эффекты разнообразных дериватов цианотиоацетамида указывают и результаты виртуального биоскрининга и предикторного анализа. В ходе проведенных скрининговых исследований in silico были выявлены потенциальные биологические мишени для 5 новых исследуемых дигидропиридинов. Их перечень достаточно обширен, среди них: фосфолипаза А2 (sPLA2); фосфодиэстеразы (PDE10A, PDE1A); тирозин-протеинкиназы (JAK1, JAK2, JAK3, TNK2); аденозиновые (A1 и A2) рецепторы; арахидонат-5-липоксигеназа (ALOX5); циклооксигеназа-2 (PTGS2). Важно подчеркнуть, что органические соединения указанной химической структуру близки к природным веществам, поэтому обладают низкой токсичностью как в опытах in siilico, так и in vivo.
Побочные эффекты со стороны желудочно-кишечного тракта являются наиболее распространенной причиной прекращения приема пероральных бисфосфонатов. Риск увеличивается у пациентов, которые принимают сопутствующие НПВП.
2. Методы и принципы исследования
Эксперимент реализован на 70 белых беспородных крысах-самцах массой 270-300 г. в зимне-весенний период в лаборатории кафедры фундаментальной и клинической фармакологии ФГБОУ ВО «Луганский государственный медицинский университет имени Святителя Луки» МЗ РФ. Животные получены из вивария вуза, где находились под карантинным наблюдением в течение 2 недель до начала эксперимента. Условия содержания крыс соответствовали стандартным требованиям: температура окружающей среды – 22-24º С; режим освещения – естественный; относительная влажность воздуха – 40-50% свободный доступ к воде и пище. Исследования проводили в соответствии с правилами качественной лабораторной практики при проведении доклинических исследований в РФ (Приказ Министерства здравоохранения и социального развития Российской Федерации от 23 августа 2010 г. №708н), а также правилами и Международными рекомендациями Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997) и были одобрены локальным этическим комитетом. Перед началом опыта все лабораторные животные были тщательно осмотрены, учитывались их вес, возраст, двигательная активность и состояние шерстяного покрова. После взвешивания на электронных весах были сформированы однородные по массе (разница не более 10%), поведению и состоянию контрольная и 6 опытных групп методом случайной выборки:
- Контрольная группа №1, животные, которые получали еженедельно в течение месяца внутрибрюшинно 0,9% раствор NaCl в объеме 0,5 мл.
- Опытные группы № 2-7, животным которых еженедельно в течение месяца внутрибрюшинно вводился препарат золедроновой кислоты в дозировке 0,017мг/ 300г. Доза золедроновой кислоты была рассчитана методом прямого межвидового переноса доз, выраженных в мг/кг. При переносе были учтены все аспекты ФК, включая абсорбцию, распределение, метаболизм, экскрецию, а также имеющиеся данные по фармакологическим и токсическим эффектам препарата.
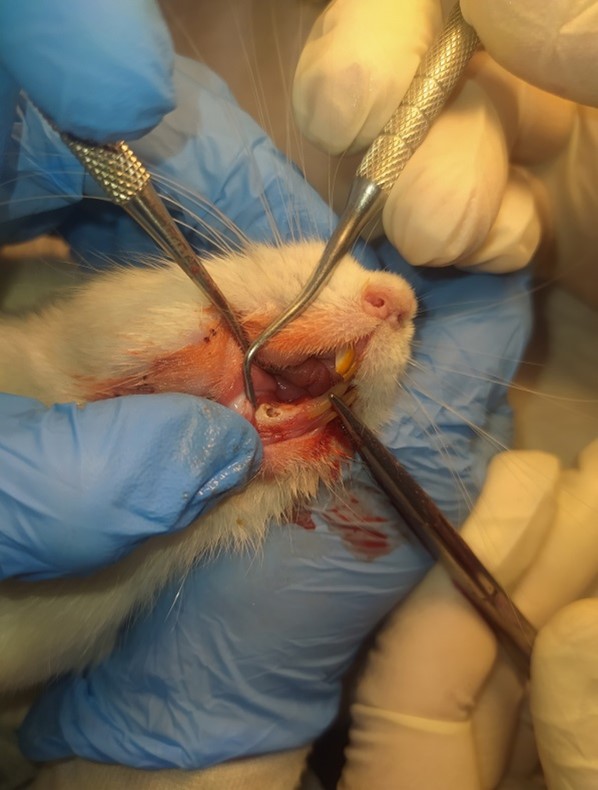
Рисунок 1 - Моделирование на начальных этапах медикаментозного остеомиелита крысам опытных групп
Примечание: операция по препарированию сегмента нижней челюсти с целью развития бисфосфонат-обусловленного остеомиелита и анализа противовоспалительных свойств новых производных цианотиоацетамида
Спустя две недели после хирургического вмешательства с появлением первых симптомов остеомиелита была начата фармакологическая коррекция смоделированного патологического состояния, которая проводилась в опытных группах № 2-6 различными производными α-цианотиоацетамида, синтезированными нами на базе научно-исследовательской лаборатории «ХимЭкс» ФГБОУ ВО «Луганский государственный университет им. Владимира Даля» МОН РФ, а в группе № 7 – препаратом сравнения нимесулид. Дозы производных α-цианотиоацетамида (изучаемых дериватов дигидропиридина и тиенопиридина) и нимесулида в нашем исследовании составили 2,5 мг/кг. В ранее проведенных исследованиях именно в диапазоне доз от 1 до 5 мг соединения этой структуры оказывали выраженный противовоспалительный и анальгетический эффекты. И это составляет от 1/100 от LD50. Исследуемые соединения и препарат сравнения вводились ежедневно в течение двух недель интрагастрально с помощью шприцев объемом 1 мл (минимальный объем для снижения потерь дисперсной фазы во время введения) через зонд размером 1,2 мм на 65 мм. Животные контрольной группы получали внутригастрально 0,9% раствор NaCl в объеме 1 мл. Для приготовления растворов были использованы лабораторные принадлежности и посуда, предварительно простерилизованные термически или химически, в том числе ступки и пестики различных размеров, мерные цилиндры, шпатели, колбы и т.д.
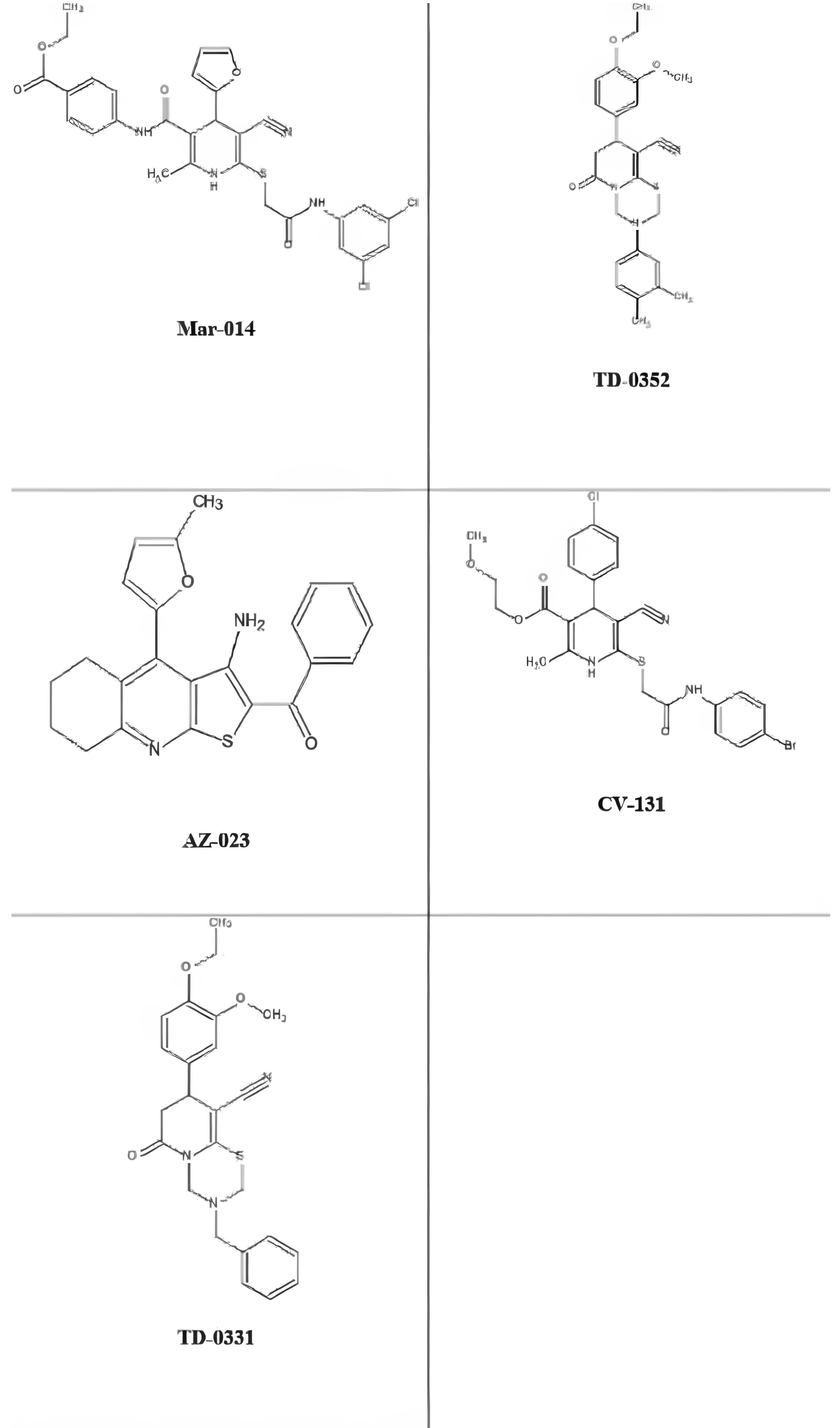
Рисунок 2 - Строение молекул изучаемых новых оригинальных производных цианотиоацетамида
Примечание: химическая структура производных цианотиоацетамида
Достоверность различий экспериментальных данных для групп (n<20) определялась с помощью среднего арифметического a; дисперсии значений Ϭ2 вокруг среднего арифметического, среднеквадратического отклонения S в онлайн-калькуляторе allcalc.ru, а также средние значения разности групп сравнения и исследуемых образцов. Однородность полученных экспериментальных данных оценивалась коэффициентом вариации V (при V<33% совокупность данных считалась однородной). В непараметрической статистике применялся критерий Уилкоксона (Wilcoxon matched-pairs signed rank test), который применяется в зависимости от числа групп исследования, связанности выборок и необходимости внесения поправки на множественные сравнения. Статистический критерий Уилкоксона позволял сравнить две связанные (зависимые) выборки по количественному и порядковому признаку.
3. Основные результаты
В динамике наблюдения за животными при оценке массы тела крыс всех исследуемых групп были получены результаты, представленные в таблице 1.
Таблица 1 - Результаты еженедельного взвешивания животных в ходе эксперимента
№ группы | Вес в начале эксперимента, гр. | 1 неделя, гр. | 2 неделя,гр. | 3 неделя,гр. | 4 неделя, гр. | 5 неделя, гр. | 6 неделя, гр. | 7 неделя, гр. | 8 неделя, гр. | аср - среднее арифметическое веса каждой группы, гр. | Дисперсия σ2 | Среднеквадратическое отклонение q | Ошибка среднего арифметического m | V-коэффициент вариации |
№1 Контроль | 322 | 326 | 332 | 340 | 343 | 336 | 332 | 334 | 341 | 334,0 | 48,3 | 6,9 | 2,3 | 2% |
№2 CV-131 | 282 | 290 | 290 | 294 | 300 | 287 | 275 | 272 | 270 | 284,4 | 107,5 | 10,4 | 3,5 | 4% |
№3 TD-0331 | 287 | 291 | 296 | 300 | 302 | 291 | 284 | 277 | 269 | 288,6 | 114,8 | 10,7 | 3,6 | 4% |
№4 TD-0352 | 274 | 280 | 284 | 290 | 292 | 283 | 276 | 274 | 271 | 280,4 | 54,5 | 7,4 | 2,5 | 3% |
№5 AZ-023 | 295 | 301 | 304 | 309 | 312 | 303 | 297 | 294 | 296 | 301,2 | 40,4 | 6,4 | 2,1 | 2% |
№6 Mar-075 | 269 | 276 | 280 | 284 | 287 | 283 | 277 | 275 | 277 | 278,7 | 29,8 | 5,5 | 1,8 | 2% |
№7 Нимесулид | 291 | 297 | 299 | 304 | 306 | 300 | 291 | 282 | 269 | 293,2 | 136,9 | 11,7 | 3,9 | 4% |
Примечание: статистическая обработка данных, полученных в течение эксперимента, проводилась стандартными методами математической статистики; в ходе однофакторного дисперсионного анализа определялись среднее арифметическое веса каждой группы аср; дисперсия ( в статистике -это мера, которая показывает разброс между результатами) σ2 ; среднеквадратическое отклонение (мера статистического разброса, характеризующая степень вариабельности значений в выборке) q; ошибка среднего арифметического ( характеризует изменчивость среднего арифметического выборки) m; несмотря на однородность полученных данных, в связи с индивидуальными характеристиками животных в пределах одной группы, был рассчитан коэффициент вариации V, показатель, который характеризует степень колебания показателей относительно среднего значения выборки
Первые различия между состоянием крыс контрольной и опытных групп стали проявляться на седьмые сутки: приживление слизистого лоскута в области оперативного вмешательства у животных 2-7 групп было замедлено, его цвет был белым, поверхность – матовая, сухая, наблюдалось обильное отложение зубного налета под отслоенной слизистой и в самом костном дефекте. У животных контрольной группы слизистая оболочка десны в области хирургического вмешательства была прикреплена к альвеолярному отростку, место препарирования костной ткани было закрыто, цвет лоскута не отличался от окружающих мягких тканей, был бледно-розовым, его поверхность была блестящая, увлажненная.
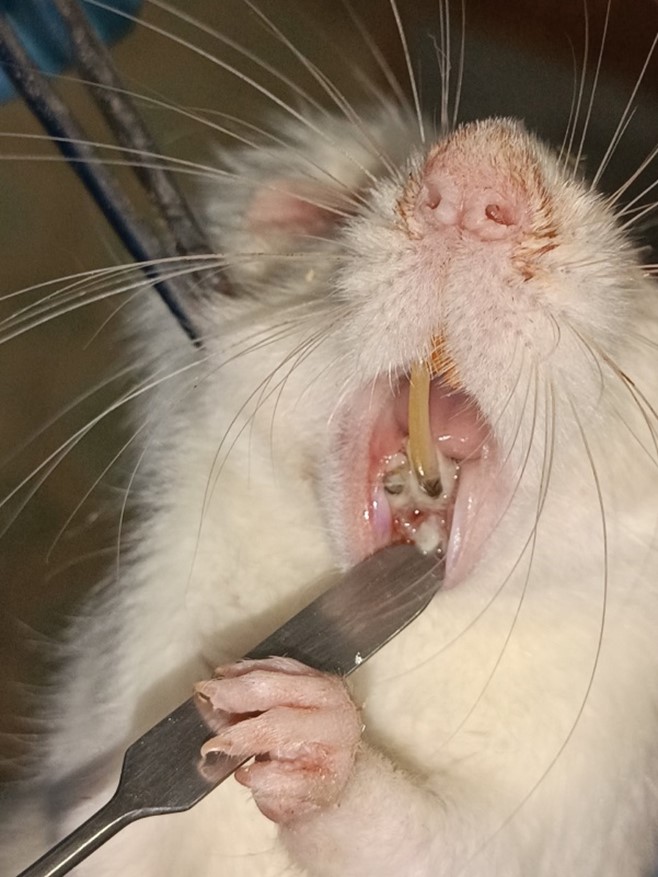
Рисунок 3 - Состояние области оперативного вмешательства на 14-е сутки эксперимента
Примечание: первые симптомы остеомиелита: костная ткань в области оперативного вмешательства пигментирована, размягчена, обильное отложение зубного налёта, неприятный, гнилостный запах у животных
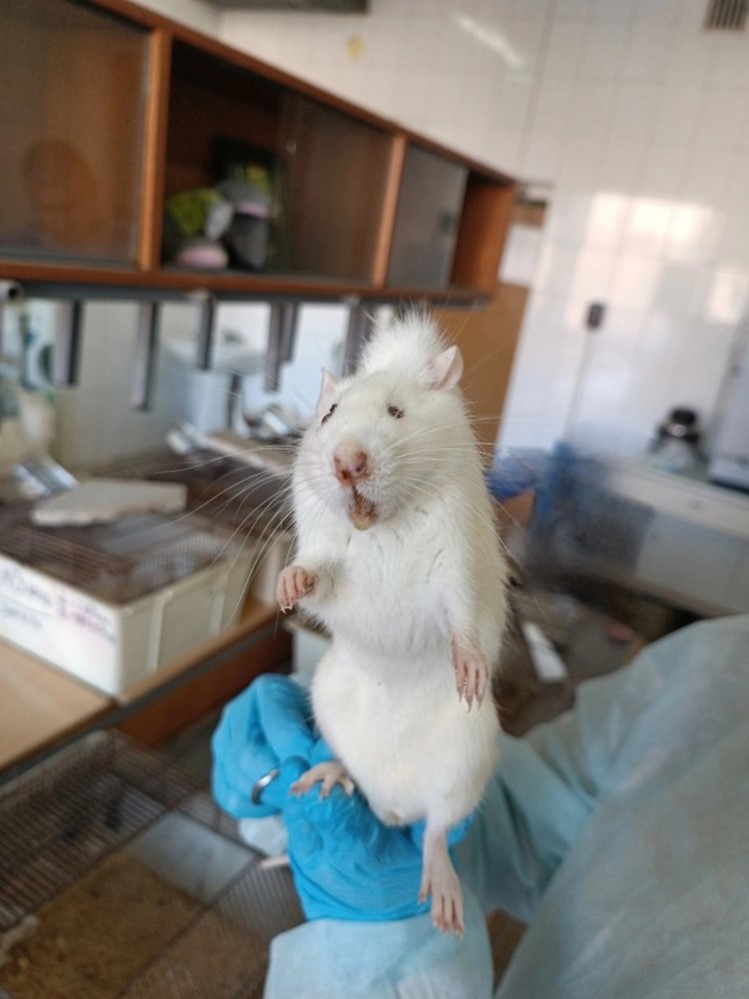
Рисунок 4 - Внешний вид крысы опытной группы №3 до фармакологической коррекции медикаментозного остеомиелита
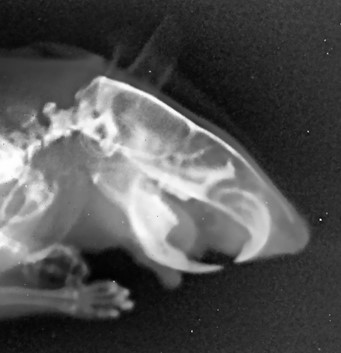
Рисунок 5 - Рентгенологический снимок челюстно-лицевой области крысы контрольной группы в боковой проекции
Примечание: на рентгенологическом снимке челюстно-лицевой области в боковой проекции замыкающая пластинка ранее выполненного дефекта разрушена с дистального края в маргинальной области; структура костных тканей в периапикальных областях и межзубных перегородках не нарушена; очагов деструкции нет; патологических очагов гнойной инфильтрации не обнаружено
Таблица 2 - Результаты исследования общего количества лейкоцитов в клиническом анализе крови животных, произведенного по окончании эксперимента
Группа | Показатели ( 10^9/л) | аср — среднее значение | Дисперсия σ2 | среднеквадратическое отклонение q | ошибка среднего арифметического m | V — коэффициент вариации, % | |||||||||
№1 контроль | 5,7 | 6,1 | 6,5 | 6,1 | 5,9 | 6,3 | 5,8 | 6,6 | 6,2 | 6,0 | 6,12 | 0,08 | 0,29 | 0,09 | 5 |
№2 CV-131 | 7,0 | 7,4 | 5,2 | 9,2 | 7,1 | 7,3 | 7,0 | 7,4 | - | - | 7,20 | 1,17 | 1,08 | 0,38 | 15 |
№3 TD-0331 | 7,2 | 7,2 | 6,9 | 7,5 | 6,4 | 8,0 | 7,1 | 7,3 | - | - | 7,20 | 0,21 | 0,46 | 0,16 | 6 |
№4 TD-0352 | 8,7 | 6,7 | 7,0 | 8,4 | 9,1 | 6,4 | - | - | - | - | 7,72 | 1,33 | 1,15 | 0,47 | 15 |
№5 AZ-023 | 7,2 | 6,8 | 7,4 | 7,1 | 7,3 | 6,9 | 7,5 | - | - | - | 7,17 | 0,07 | 0,26 | 0,10 | 4 |
№6 Mar-075 | 6,8 | 6,1 | 7,5 | 6,5 | 7,1 | 5,8 | 7,8 | - | - | - | 6,8 | 0,53 | 0,73 | 0,27 | 11 |
№7 Нимесулид | 8,2 | 13,4 | 10,8 | - | - | - | - | - | - | - | 10,8 | 6,76 | 2,60 | 1,50 | 243 |
Таблица 3 - Результаты исследования общего количества лейкоцитов в клиническом анализе крови животных, произведенного по окончании эксперимента
Группа | а ср — среднее значение | Дисперсия σ2 | среднеквадратическое отклонение q | ошибка среднего арифметического m | V — коэффициент вариации, % | p (критерий Уилкоксона) | |
p1 | p2 | ||||||
№1 Контроль | 6,12 | 0,08 | 0,29 | 0,09 | 5 | - | |
№2 CV-131 | 7,20 | 1,17 | 1,08 | 0,38 | 15 | 0,037* | 0,031* |
№3 TD-0331 | 7,20 | 0,21 | 0,46 | 0,16 | 6 | 0,006* | 0,031* |
№4 TD-0352 | 7,72 | 1,33 | 1,15 | 0,47 | 15 | 0,002* | 0,063 |
№5 AZ-023 | 7,17 | 0,07 | 0,26 | 0,10 | 4 | 0,016* | 0,031* |
№6 Mar-075 | 6,8 | 0,53 | 0,73 | 0,27 | 11 | 0,094 | 0,031* |
№7 Нимесу-лид | 10,8 | 6,76 | 2,60 | 1,50 | 24 | 0,031* | - |
Примечание: аср - среднее арифметическое общего количества лейкоцитов в крови крыс каждой группы; σ2 – дисперсия; q- среднеквадратическое отклонение; m- ошибка среднего арифметического; V-коэффициент вариации; p1 - c контролем; * - отличия достоверны (если р≤0,05); p2 - с нимесулидом
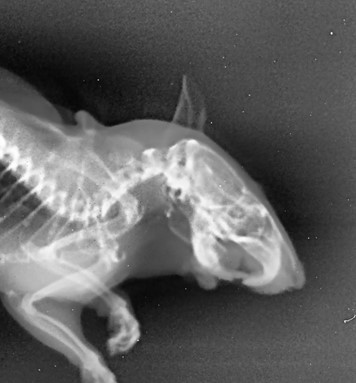
Рисунок 6 - Рентгенологический снимок челюстно-лицевой области крысы опытной группы, получавшей фармакологическую коррекцию бисфосфонатобусловленного остеомиелита производным цианотиоацетамида с шифром CV-131 в боковой проекции
Примечание: на рентгенограмме замыкающая пластинка выполненного раннее дефекта разрушена с дистального края в маргинальной области; межзубная перегородка дистальнее правого нижнего резца разрушена, имеет негомогенную структуру; размеры очага резорбции верхушки альвеолярного гребня составили 0,5х0,5 мм; патологических очагов гнойной инфильтрации мягких тканей не обнаружено
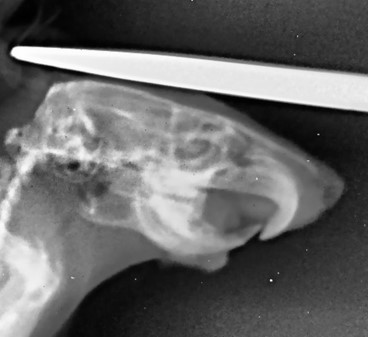
Рисунок 7 - Рентгенологический снимок челюстно-лицевой области крысы опытной группы, получавшей фармакологическую коррекцию бисфосфонатобусловленного остеомиелита производным тиодиазина с шифром TD-0331, в боковой проекции
Примечание: на рентгенологической картине выявлялся очаг деструкции костной ткани; межзубная перегородка дистальнее правого нижнего резца разрушена, имела негомогенную структуру; выявлен очаг резорбции верхушки альвеолярного гребня диаметром 1,5х1,5 мм; зарегистрирована подвижность нижнего правого резца; морфологические изменения кости проявлялись в её некротическом набухании, а также образовании секвестров; у животных этой группы был минимальный отёк мягких тканей
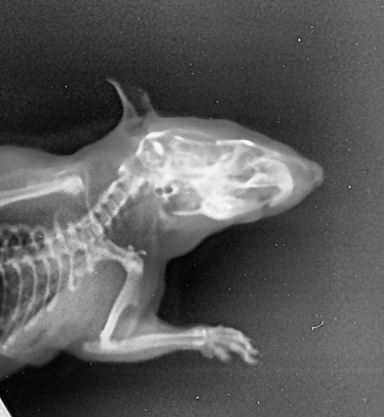
Рисунок 8 - Рентгенологический снимок челюстно-лицевой области крысы опытной группы, получавшей фармакологическую коррекцию бисфосфонатобусловленного остеомиелита производным тиодиазина с шифром TD-0352 в боковой проекции
Примечание: замыкающая пластинка выполненного раннее дефекта разрушена с дистального края в маргинальной области; межзубная перегородка дистальнее правого нижнего резца разрушена, имеет негомогенную структуру; в подчелюстном клетчаточном пространстве обнаружена инфильтрация диаметром 0,5х0,7 см, границы нечеткие; после вскрытия получен гнойный экссудат; рентгенологическое исследование выявило деструкцию костной ткани в области препарированного сегмента
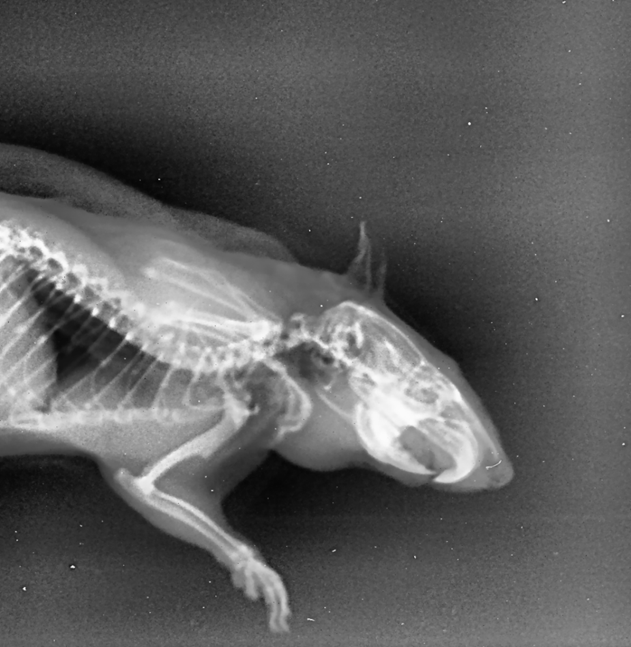
Рисунок 9 - Рентгенологический снимок челюстно-лицевой области крысы опытной группы, получавшей фармакологическую коррекцию бисфосфонатобусловленного остеомиелита производным тиенопиридина с шифром AZ-023 в боковой проекции
Примечание: на рентгенологической картине выявляется очаг деструкции костной ткани в области препарированного сегмента; морфологические изменения кости проявлялись в её некротическом набухании, а также образовании секвестров; у одного животного из этой группы был обнаружен очаг инфильтрации мягких тканей
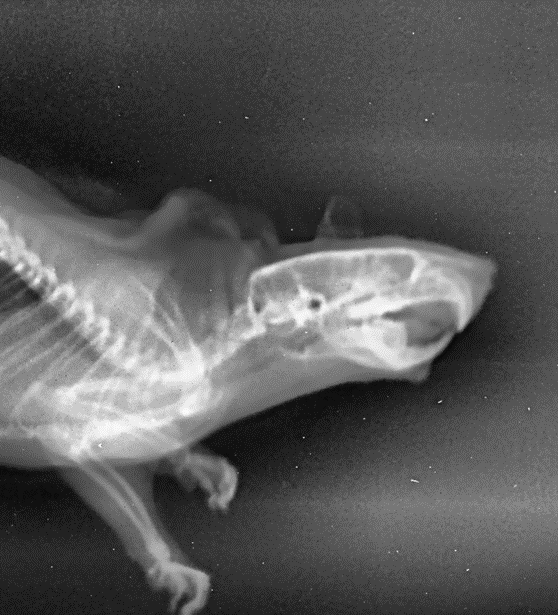
Рисунок 10 - Рентгенологический снимок челюстно-лицевой области крысы опытной группы, получавшей фармакологическую коррекцию бисфосфонатобусловленного остеомиелита производным цианотиоацетамида с шифром Mar-075 в боковой проекции
Примечание: замыкающая пластинка выполненного раннее дефекта разрушена с дистального края в маргинальной области; межзубная перегородка дистальнее правого нижнего резца разрушена, имеет негомогенную структуру; резорбция верхушки альвеолярного гребня диаметром 0,7х0,7 мм; морфологические изменения кости проявлялись в образовании секвестров, значительного увеличения объема костных тканей не выявлено
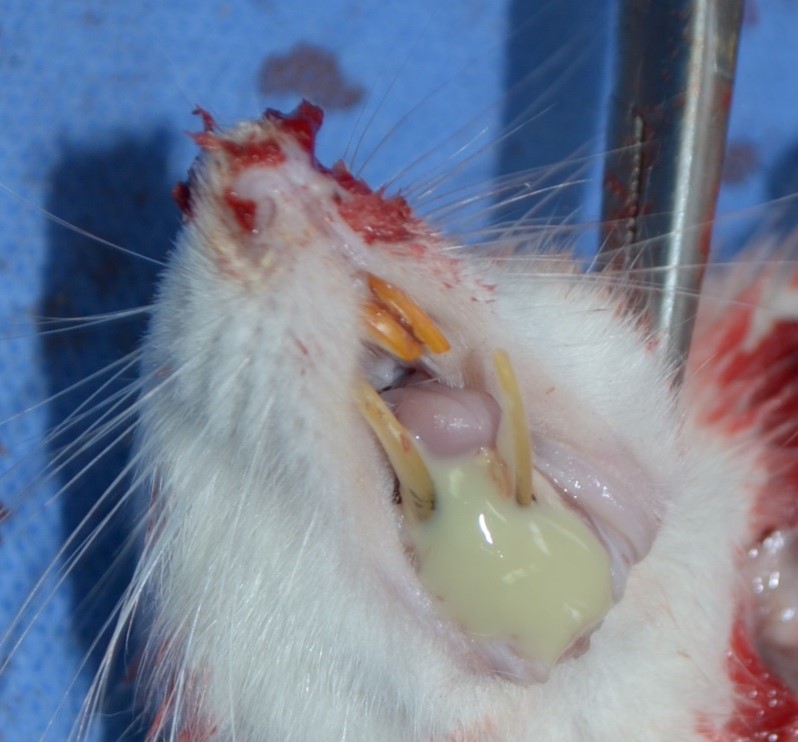
Рисунок 11 - Участок нижней челюсти крысы группы сравнения с медикаментозным остеомиелитом и двухнедельной фармакотерапией нимесулидом
Примечание: гнойное воспаление мягких тканей свидетельствует о распространении патологии за пределы оперированного сегмента, снижении антигенных сил организма и возможности присоединения вторичной инфекции, источником которой может стать собственная микрофлора полости рта
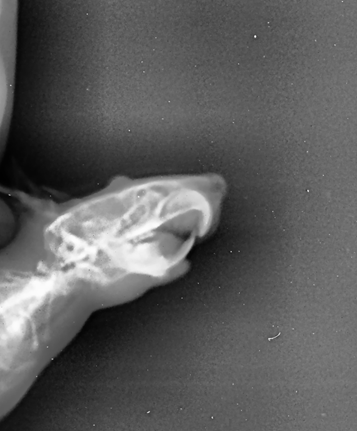
Рисунок 12 - Рентгенологический снимок челюстно-лицевой области крысы опытной группы, получавшей фармакокоррекцию бисфосфонатобусловленного остеомиелита нимесулидом в боковой проекции
4. Заключение
Таким образом, полученные нами результаты экспериментальных исследований на модели бисфосфонатобусловленного остеомиелита показали отчетливо выраженную противовоспалительную активность синтезированных нами новых производных цианотиоацетамиада. Все пять исследуемых образцов в 2-3 раза превосходили нимесулид по противовоспалительной эффективности, что выражалось в более низком проценте смертности экспериментальных животных и менее выраженной лейкоцитарной реакции. Рентгенографическое исследование нижней челюсти выявило способность новых гетероциклических соединений – дериватов дигидропиридина, тиодиазина и тиенопидина, применяемых в дозе 2,5 мг/кг внутрижелудочно на протяжении 2 недель, предотвращать появление очагов деструкции костной ткани при бисфосфонатобусловленном остеомиелите.
Наиболее выраженные противовоспалительные свойства на модели медикаментозного остеомиелита обнаружены у производных цианотиоацетамида под шифрами CV-131, TD-0331, AZ-023 и Mar-075.
Практически стопроцентная вероятность развития медикаментозного остеомиелита при хирургических вмешательствах на фоне приема бисфосфонатов, обнаруженная при моделировании патологического состояния, а также тяжесть течения данной патологии, высокая частота встречаемости гнойных осложнений должны обращать особое внимание практикующих стоматологов-хирургов и челюстно-лицевых хирургов на тщательный сбор анамнеза, применение профилактических и терапевтических подходов, которые могут улучшить результаты лечения пациентов, получающих бисфосфонаты.
В свою очередь, терапия экспериментального медикаментозного остеомиелита новыми производными цианотиоацетамида показала наличие у последних противовоспалительных свойств, превышающих таковые нимесулида. Данный результат свидетельствует о целесообразности дальнейшего экспериментального исследования новых производных цианотиоацетамида.
