THE EFFECTIVENESS OF MEMBERS OF THE FAMILY BACILLACEAE AGAINST SOYBEAN FUNGAL PATHOGENS
THE EFFECTIVENESS OF MEMBERS OF THE FAMILY BACILLACEAE AGAINST SOYBEAN FUNGAL PATHOGENS
Abstract
The aim of the work was to study the antibiotic activity of representatives of the Bacillaceae family against pathogens of fungal diseases of soybean that are relevant for the Krasnoyarsk Territory. As representatives of the Bacillaceae family, we used 22 strains of Bacillus altitudinis, B. atrophaeus, B. cereus, B. megaterium, B. simplex, B. subtilis, Peribacillus simplex and Bacillus sp., isolated by us from agricultural soils of the region. As test cultures, we used 2 isolates of Alternaria sp., 2 isolates of Fusarium sp. and 1 isolate of Sclerotinia sclerotiorum, isolated from soybean plants affected by diseases. The antibiotic activity was tested using the opposite culture method. The area of colonies of the test culture in the presence of the antagonist strain in % of the control variant (without the antagonist) was used as an indicator. It was found that the antibiotic activity of the studied strains varied from the absence of antagonism (the colony area of the test culture did not differ from the control variant) to almost complete suppression of the test culture (the colony area was 5,4% of the control) depending on the antagonist strain and the test culture. Two-factor analysis of variance confirmed the statistical significance (p<0.001) of the influence of the factors "Strain-antagonist", "Test culture" and the effect of the interaction of the factors "Strain-antagonist" x "Test culture" on the antibiotic activity with the effect sizes of 57,33%, 15,87% and 26,16%, respectively. Correlation analysis with subsequent factor analysis of the correlation matrix showed that the studied strains produce at least two independent antifungal factors. The first factor is active against representatives of the genera Alternaria and Fusarium, the second – against Sclerotinia sclerotiorum. Based on the obtained results, a combination of Bacillus atrophaeus CX6 and Pa2 Bacillus sp. strains was proposed to protect soybeans from fungal diseases.
1. Введение
Сою выращивают по всему миру, ведущими странами являются США, Аргентина, Бразилия, Индия. Мировое производство сои с каждым годом увеличивается , . В России также наблюдается ежегодное увеличение посевных площадей под соей, что свидетельствует о растущем интересе к данной культуре. Так, согласно данным Росстат, только за последние пять лет (2020-2024 г.г.) посевные площади под этой культурой выросли в 1,5 раза, достигнув в 2024 г. 4,3 млн. га. .
По результатам мониторинга, проведённого в 2023 г., и охватившего 64,6% посевной площади под соей, на 13,8% обследованных площадей были распространены заболевания, наиболее вредоносными из которых были грибные болезни: септориоз (возбудитель – Septoria glycines), аскохитоз (возбудитель – Ascochyta sojaecola), пероноспороз (возбудитель – Peronospora manshurica) и фузариоз (возбудители – комплекс грибов р. Fusarium), а также бактериоз .
Несмотря на то, что основную долю рынка средств защиты растений от грибных болезней в России и за рубежом занимают химические фунгициды, в последние десятилетия во всём мире наблюдается устойчивая тенденция к внедрению в систему защитных мероприятий биофунгицидов, представляющих собой препараты на основе живых микроорганизмов и/или их метаболитов. Данные препараты являются относительно дешёвыми и (в отличие от химических фунгицидов) экологически безопасными. Однако широкое внедрение биофунгицидов тормозится нехваткой эффективных штаммов, особенно – адаптированных к почвенно-климатическим условиям конкретных регионов.
Текущий (на 18.09.2024 г.) перечень биологических препаратов, согласно Государственному каталогу пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, включает всего 9 фунгицидов на основе бактерий р. Bacillus, р. Pseudomonas и грибов р. Trichoderma. Данные препараты направлены на предотвращение развития таких болезней как церкоспороз, пероноспороз, фузариозные корневые гнили, фузариозное увядание, антракноз, аскохитоз, фузариоз, плесневение семян, альтернариоз при слабом развитии болезни . В связи с этим поиск новых агентов для разработки биопрепаратов для защиты посевов сои от грибных болезней является актуальной задачей.
Цель исследования – изучить антибиотическую активность представителей семейства Bacillaceae в отношении актуальных для Красноярского края возбудителей грибных болезней сои.
2. Объекты и методы
В работе изучали антибиотическую активность 22 штаммов-антагонистов, выделенных из почв Красноярского края (Bacillus altitudinis, B. atrophaeus, B. cereus, B. megaterium, B. simplex, B. subtilis, Peribacillus simplex и Bacillus sp.) в отношении возбудителей грибных болезней сои. Один из штаммов (RSA 1 (B-13893) B. atrophaeus) ранее был запатентован авторами в качестве основы для биопрепарата против грибных болезней сои (Патент на изобретение RU 2791332 C1 07.03.2023), остальные штаммы на антагонизм против возбудителей болезней сои не тестировались. В качестве тест-культур использовали 2 изолята Alternaria sp. (Alt C20, Alt C24), 2 изолята Fusarium sp. (Fus C7, Fus C15) и 1 изолят Sclerotinia sclerotiorum (Scler C16). Идентификацию бактерий проводили методами MALDI-TOF масс-спектрометрии, по нуклеотидной последовательности гена 16SpРНК; идентификацию грибов проводили по характеру спороношения и совокупности других культурально-морфологических признаков.
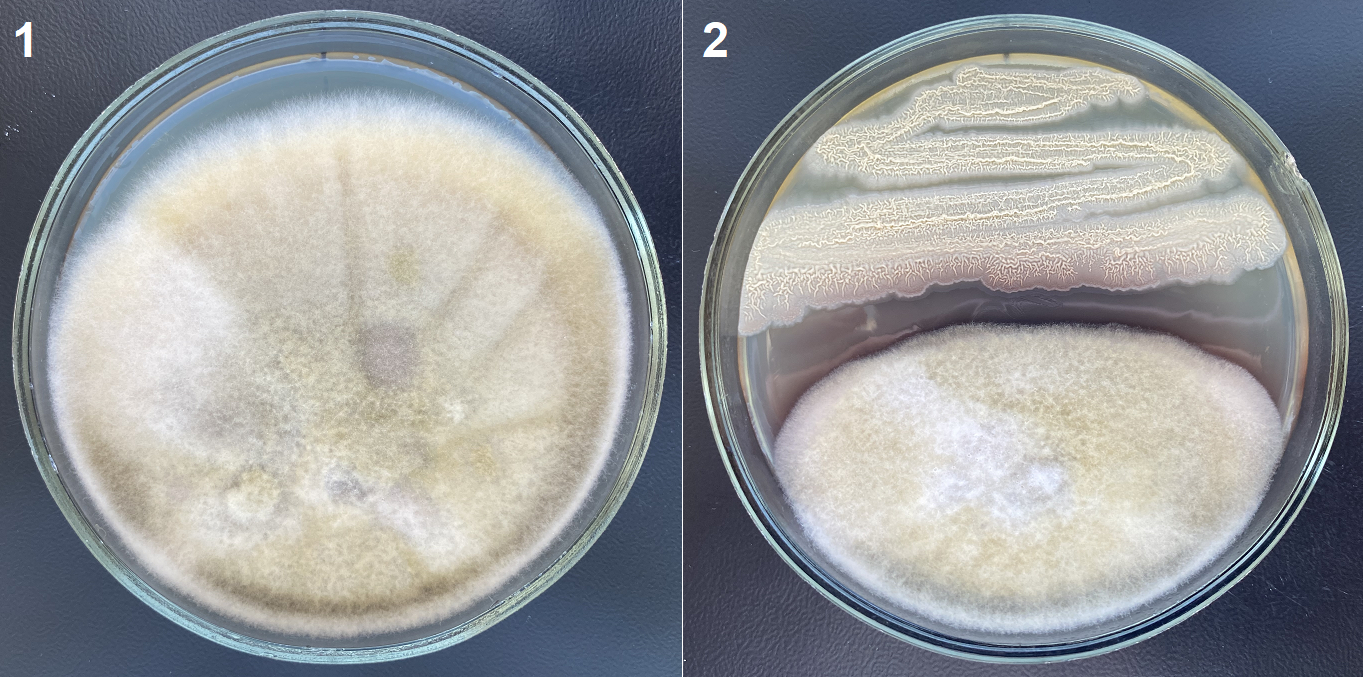
Рисунок 1 - Метод встречных культур на примере Alt C20:
1 – рост тест-культуры в контроле; 2 – рост тест-культуры в присутствии штамма СХ5
3. Результаты и их обсуждение
Зафиксированный в эксперименте антибиотический эффект штаммов-антагонистов варьировал от практически полного подавления роста тест-культуры до отсутствия антибиотического воздействия (табл. 1, рис. 2, 3).
Таблица 1 - Усреднённые по трём повторностям площади колоний тест-культур в присутствии изучаемых штаммов-антагонистов
Штамм, таксономическая принадлежность | Площади колоний тест-культур (в % к контролю) | ||||
Alt C20 | Alt C24 | Fus C7 | Fus C15 | Scler C16 | |
Pa1, Bacillus thuringiensis | 44,4 | 57,6 | 51,1 | 55,4 | 39,2 |
Pa2, Bacillus sp. | 48,6 | 39,6 | 62,3 | 75,9 | 5,4 |
Pa3, Bacillus sp. | 31,9 | 24,5 | 45,8 | 64,4 | 44,9 |
RSA1, (B-13893), Bacillus atrophaeus | 30,1 | 15,0 | 15,8 | 57,6 | 60,7 |
RSA11, Bacillus subtilis/ Bacillus atrophaeus | 28,4 | 40,2 | 49,9 | 53,3 | 43,6 |
RSA12, Peribacillus simplex | 82,3 | 90,5 | 100,0 | 100,0 | 90,2 |
RSA15, Bacillus simplex | 51,3 | 39,7 | 56,0 | 59,1 | 47,1 |
RSA16(1), Bacillus atrophaeus | 39,7 | 33,2 | 51,6 | 56,7 | 33,1 |
RSA16(2), Bacillus atrophaeus | 35,3 | 37,1 | 34,9 | 48,5 | 38,5 |
RSA17, Bacillus cereus group/ Bacillus subtilis | 42,9 | 39,1 | 50,8 | 55,1 | 51,0 |
RSA18, Bacillus atrophaeus | 47,7 | 39,7 | 56,1 | 55,2 | 52,1 |
RSA19, Bacillus atrophaeus | 39,4 | 39,5 | 46,7 | 51,4 | 37,0 |
RSA2, Bacillus altitudinis | 35,2 | 50,8 | 59,4 | 85,9 | 34,0 |
RSA20(1), Bacillus subtilis | 42,5 | 38,7 | 50,5 | 53,8 | 54,7 |
RSA20(2), Bacillus subtilis | 29,1 | 41,9 | 44,1 | 47,8 | 17,6 |
RSA4, Bacillus megaterium | 81,2 | 57,8 | 100,0 | 100,0 | 55,7 |
RSA8, Bacillus atrophaeus | 46,5 | 36,5 | 45,3 | 52,3 | 10,9 |
RSA9, Bacillus atrophaeus | 47,4 | 38,7 | 44,9 | 52,7 | 49,0 |
АЛ3, Bacillus atrophaeus | 43,4 | 33,9 | 46,6 | 55,2 | 32,2 |
АЛ4, Bacillus sp. | 39,5 | 36,6 | 48,6 | 46,9 | 54,6 |
СХ5, Bacillus cereus | 49,2 | 46,2 | 33,1 | 51,8 | 65,6 |
СХ6, Bacillus atrophaeus | 7,2 | 15,2 | 38,0 | 40,3 | 6,2 |

Рисунок 2 - Пример зависимости антибиотического эффекта от штамма-антагониста при использовании одной и той же тест-культуры (Fus C15):
1 – штамм RSA9, подавление роста тест-культуры ярко выражено; 2 – штамм RSA4, подавление роста тест-культуры отсутствует
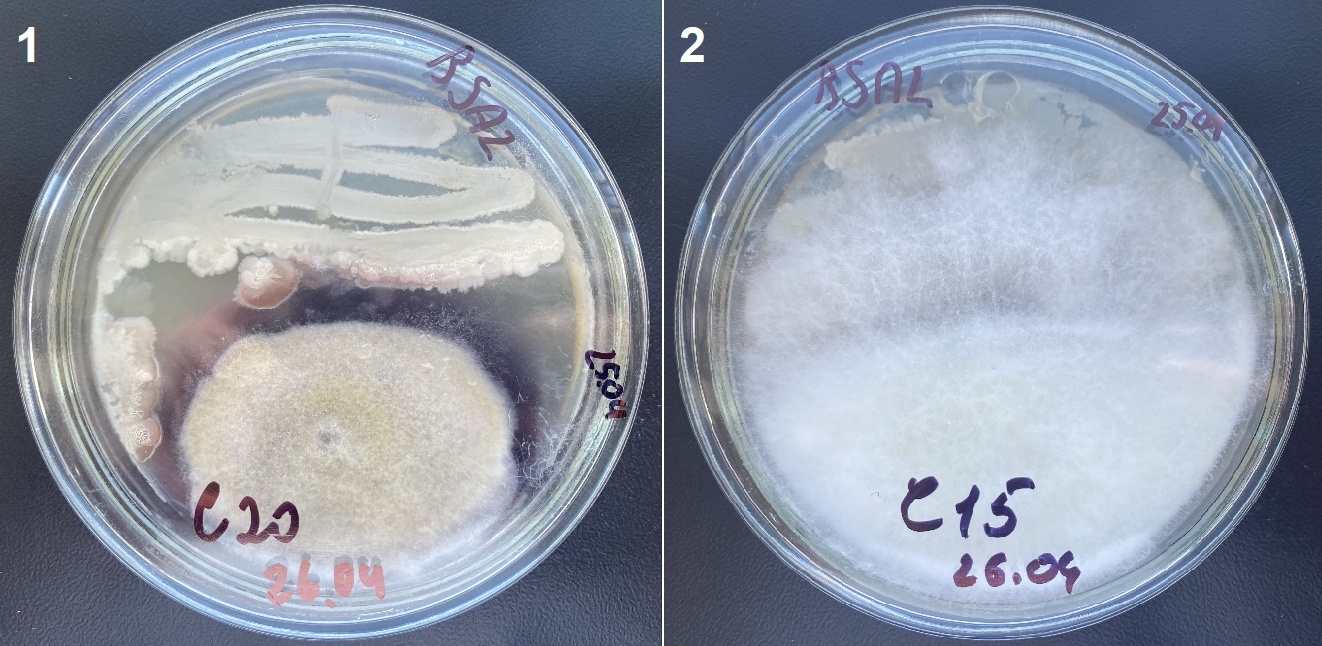
Рисунок 3 - Пример зависимости антибиотического эффекта от тест-культуры при использовании одного и того же штамма-антагониста (RSA2):
1 – тест-культура Alt C20, подавление роста тест-культуры ярко выражено; 2 – тест-культура Fus C15, подавление роста тест-культуры выражено слабо
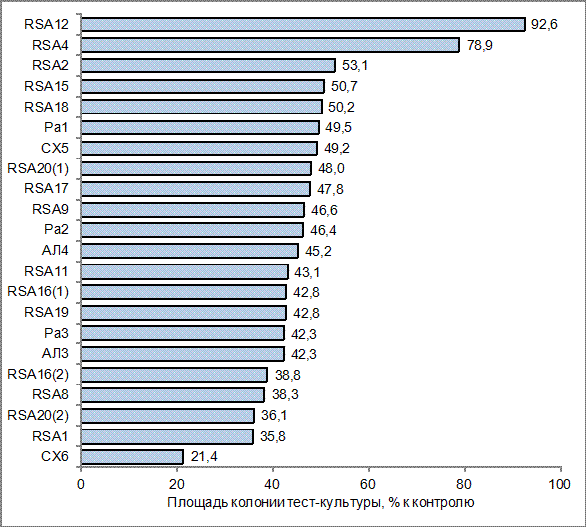
Рисунок 4 - Антибиотический эффект изучаемых штаммов в среднем по тест-культурам
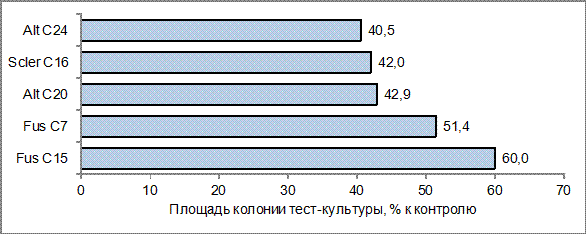
Рисунок 5 - Площадь колоний тест-культур в % к контролю в присутствии антагонистов с усреднением по штаммам
Таблица 2 - Статистическая значимость попарных различий между тест-культурами по средней чувствительности к набору изученных штаммов-антагонистов
Тест-культура | Alt C20 | Alt C24 | Fus C7 | Fus C15 |
Alt C20 | - | <0,001 | <0,001 | <0,001 |
Alt C24 | <0,001 | - | <0,001 | <0,001 |
Fus C7 | <0,001 | <0,001 | - | <0,001 |
Fus C15 | <0,001 | <0,001 | <0,001 | - |
Scler C16 | нет | 0,001 | <0,001 | <0,001 |
Примечание: тест Шеффе
Таблица 3 - Статистическая значимость попарных различий между тест-культурами по средней чувствительности к набору изученных штаммов-антагонистов
Тест-культура | Alt C20 | Alt C24 | Fus C7 | Fus C15 |
Alt C20 | - | <0,001 | <0,001 | <0,001 |
Alt C24 | <0,001 | - | <0,001 | <0,001 |
Fus C7 | <0,001 | <0,001 | - | <0,001 |
Fus C15 | <0,001 | <0,001 | <0,001 | - |
Scler C16 | <0,05 | <0,001 | <0,001 | <0,001 |
Примечание: тест Тьюки
Между тест-культурами выявлены статистически значимые положительные корреляции по чувствительности к изучаемым штаммам-антагонистам. Особенно высокая корреляция (r= 0,832) наблюдалась между Fus C7 и Fus C15. В то же время чувствительность Scler C16 к изучаемым штаммам относительно слабо коррелировала с чувствительностью Alt C20 и Alt C24, и практически не коррелировала с чувствительностью Fus C7 и Fus C15 (табл. 4).
Таблица 4 - Коэффициенты корреляции Пирсона между тест-культурами по чувствительности к антибиотическому действию изучаемых штаммов
Тест-культура | Alt C20 | Alt C24 | Fus C7 | Fus C15 | Scler C16 |
Alt C20 | 1,000 | 0,786 | 0,796 | 0,739 | 0,561 |
Alt C24 | 0,786 | 1,000 | 0,787 | 0,679 | 0,495 |
Fus C7 | 0,796 | 0,787 | 1,000 | 0,832 | 0,304 |
Fus C15 | 0,739 | 0,679 | 0,832 | 1,000 | 0,366 |
Scler C16 | 0,561 | 0,495 | 0,304 | 0,366 | 1,000 |
Примечание: коэффициенты корреляции, статистически значимые на уровне p<0,05, выделены жирным шрифтом
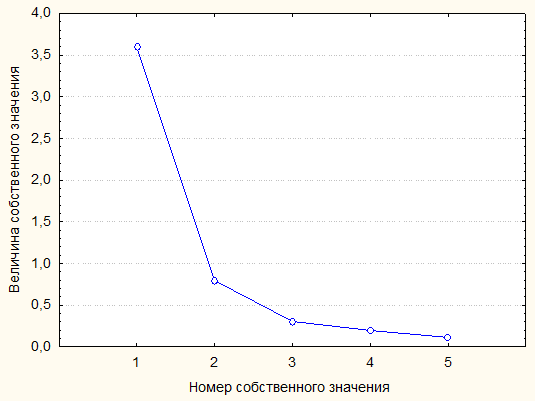
Рисунок 6 - Диаграмма величин собственных значений матрицы коэффициентов корреляции, представленной в таблице 4
Таблица 5 - Главные факторы, выделенные при анализе представленной в таблице 4 матрицы коэффициентов корреляции
Тест-культура | Без вращения | Варимаксное вращение | ||
Фактор 1 | Фактор 2 | Фактор 1 | Фактор 2 | |
Alt C20 | -0,926 | -0,056 | 0,799 | 0,472 |
Alt C24 | -0,896 | 0,003 | 0,799 | 0,406 |
Fus C7 | -0,904 | 0,328 | 0,955 | 0,120 |
Fus C15 | -0,872 | 0,255 | 0,892 | 0,170 |
Scler C16 | -0,599 | -0,785 | 0,176 | 0,972 |
Собственное значение | 3,597 | 0,792 | 3,015 | 1,375 |
% вариации | 71,9 | 15,8 | 60,3 | 27,5 |
Примечание: факторные нагрузки больше 0,70 выделены жирным шрифтом
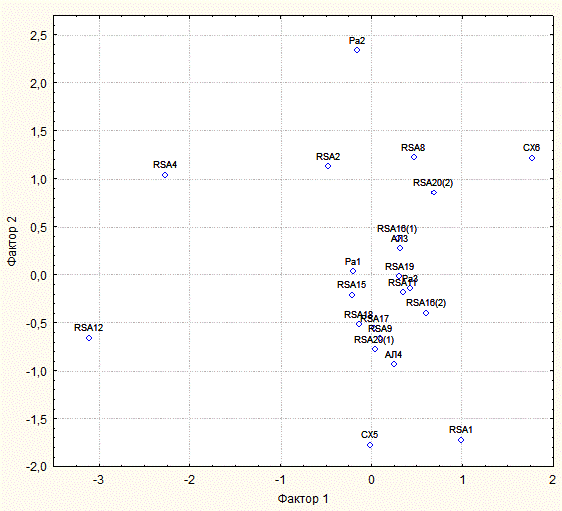
Рисунок 7 - Проекция штаммов-антагонистов на оси, представляющие Фактор 1 и Фактор 2
Примечание: см. табл. 5, без вращения
4. Заключение
Проверка антибиотической активности 22 штаммов Bacillus altitudinis, B. atrophaeus, B. cereus, B. megaterium, B. simplex, B. subtilis, Peribacillus simplex и Bacillus sp., выделенных из почв Красноярского края, в отношении актуальных для региона возбудителей грибных болезней сои р.р. Alternaria и Fusarium, а также Sclerotinia sclerotiorum, показала, что эта активность статистически значимо зависит как от штамма бактерий, так и от таксономического положения возбудителя. В среднем по штаммам-антагонистам максимальную чувствительность к их антибиотическому действию проявил изолят Sclerotinia sclerotiorum, минимальную – представители р. Fusarium. Среди штаммов-антагонистов максимальную антифунгальную активность в среднем по изолятам фитопатогенных грибов проявил штамм Bacillus atrophaeus СХ6. В то же время спектр чувствительности фитопатогенных грибов к штаммам-антагонистам, равно как и спектр антифунгальной активности антагонистов, различается. Это подтверждается наличием статистически значимого эффекта взаимодействия факторов «штамм-антагонист» и «тест-культура гриба». Корреляционный анализ с последующим факторным анализом матрицы корреляций показал, что изучаемые штаммы продуцируют как минимум два антигрибных антибиотика, различающихся спектром действия. При этом интенсивность продуцирования этих антибиотиков у разных штаммов различается. В этой связи для защиты сои от грибных болезней необходимо использовать комбинации штаммов, различающихся по спектру антифунгальной активности. На основании результатов нашего исследования, для почвенно-климатических условий Красноярского края можно рекомендовать комбинацию штаммов Bacillus atrophaeus СХ6 и Pa2 Bacillus sp.
