GENETIC GENE POLYMORPHISM OF PLASMINOGEN ACTIVATOR INHIBITOR 1 (РAI-1 4G5G) IN PREGNANT WITH OBESITY
Булык Т.С.
Кандидат медицинских наук, асистент, Буковинский государственный медицинский университет
ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ ГЕНА ИНГИБИТОРА АКТИВАТОРА ПЛАЗМИНОГЕНА 1 (РАI-1 4G / 5G) У БЕРЕМЕННЫХ С ОЖИРЕНИЕМ
Аннотация
Проанализированы частота аллелей и генотипов инсерционно-делецийнного полиморфизма (4G/5G) гена ингибитора активатора плазминогена 1-го типа (РАІ-1) в структуре беременных с ожирением и без ожирения. Среди беременных с ожирением мутация в 675 позиции промоторной зоны гена PAI-1 встречается в 26,4% случаев. У беременных с ожирением "мутантный" 4G-аллель гена PAI-1 встречается на 6,4% чаще, чем в контроле. По аллельной частоте 4G/5G полиморфизма гена РАІ-1 преобладает "дикий" 5G-аллель.
Ключевые слова: беременность, ожирение, ген РАІ-1 (4G/5G).
Bulyk T.S.
MD, Bukovinian State Medical University
GENETIC GENE POLYMORPHISM OF PLASMINOGEN ACTIVATOR INHIBITOR 1 (РAI-1 4G5G) IN PREGNANT WITH OBESITY
Abstract
Analyzed the frequency of alleles and genotypes of insertion-deletion polymorphism (4G / 5G) of the gene plasminogen activator inhibitor type 1 (PAI-1) in the structure of pregnant women with and without obesity. Among pregnant women with obesity, mutation at position 675 of the gene promoter areas PAI-1 is found in 26,4% of cases. In pregnant women with obesity, "mutant" 4G-allele of PAI-1 gene occurs by 6,4% more than in controls. Among allele frequency of 4G / 5G polymorphism of genePAI-1 prevails "wild" 5G-allele.
Keywords: pregnancy, obesity, gene PAI-1 (4G / 5G).
Пандемический характер ожирения в последние годы весомой долей обусловлен образом жизни населения. Движущей силой является чрезмерная калорийность питания при уменьшении физической нагрузки. Влияние факторов окружающей среды реализуется в связи с генотипом отдельного индивидуума. Проблема заключается еще и в том, что генотип, который ранее при определенном образе жизни себя не проявлял, в изменившихся социально-бытовых условиях начинает реализовывать свое потенциально патогенетическое назначения и становится индивидуальным фактором риска.
В структуре женщин фертильного возраста ожирение занимает примерно 30-41% [2] и сопровождается в 2-3 раза чаще развитием гестоза, внутриутробной задержкой роста, преждевременных родов, преждевременным разрывом плодных оболочек, самопроизвольного аборта и отслойки плаценты. Все эти осложнения ассоциируются с нарушением глубины инвазии трофобласта [9].
Одним из генов-кандидатов, принимающих участие в регуляции процессов инвазии трофобласта на ранних сроках беременности является ген ингибитора активатора плазминогена 1-го типа (PAI-1). PAI-1 считают ключевым фактором формирования маточно-плацентарной кровообращения [3], плазменный уровень которого определяется генетическими, метаболическими (дислипидемия), эндокринными, диетическими факторами и физической активностью [1].
"Мутацию" в 675 позиции промотора гена PAI-1 связывают с повышением уровня PAI-1 и тромбофилиями [9]. По данным ряда исследований [4,5,6], гомозиготный 4G4G вариант наблюдается у 82-85% женщин с привычным невынашиванием. Отдельные исследователи установили, что наличие 4G-аллеля ассоциируется с повышенной плазменной и плацентарной концентрацией PAI-1 при ожирении [2,8] и метаболическом синдроме [5].
Поскольку полиморфизм 4G / 5G гена РАI-1 может быть одной из главных причин генетически обусловленной дисрегуляции фибринолитической активности и нарушения плацентации у беременных с ожирением, было проведено определение частоты аллелей 4G5G гена РАІ-1 у беременных с ожирением и без ожирения.
Цель исследования. Установить частоту аллелей и генотипов инсерционные-делецийного (4G / 5G) полиморфизма гена РАI-1 в структуре беременных с ожирением и без ожирения.
Материал и методы
В проспективном исследовании приняло участие 72 беременных с ожирением (основная группа) и 21 практически здоровая беременная без избыточной массы тела (контрольная группа), которые подписали информированное согласие на участие в исследовании. По возрасту обследованных и паритету родов группы достоверно не отличались. Забор венозной крови для проведения лабораторно-генетических исследований проводили на 6-10-й неделе беременности (эмбриональный период гестации). Аллель гена PAI-1 изучали путем выделения геномной ДНК из лейкоцитов периферической крови. Амплифицировали полиморфный участок с помощью полимеразной цепной реакции (ПЦР) на амплификаторе "Amply-4L" (Россия). Фрагменты амплифицированной ДНК разделяли методом гель-электрофореза, окрашивали этидием бромида, визуализировали с помощью транслюминатора в присутствии маркера молекулярных масс (100-1000 bp).
Также все беременные проходили комплекс обязательных акушерских обследований, консультации узких специалистов (эндокринолога, кардиолога), общеклинические и биохимические исследования, на TORCH - инфекции, в соответствии с Приказом Министерства здравоохранения Украины 15.07.2011, № 417 «Об организации амбулаторной акушерско-гинекологической помощи в Украине ».
Статистическую обработку проводили с помощью прикладных программ MS® Excel® 2 003 ™, PrimerofBiostatistics® 6.05 и Statistica® 7.0 (StatSoftInc., США). Достоверность полученных данных рассчитывали методом парного теста с применением t-критерия Стьюдента (распределение по тесту Колмогорова-Смирнова был близким к нормальному), корреляционные связи - по коэффициентам Pearson и ранговой корреляции Spearman; анализ качественных признаков - по критерию χ2 (при частоте менее 5 - точный тест Фишера). Разницу считали вероятной при р <0,05.
Результаты исследования и их обсуждение
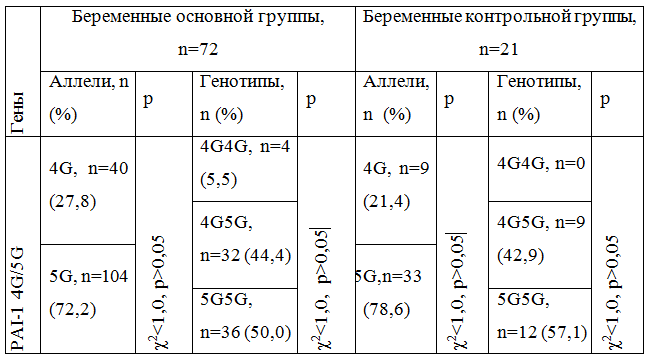
В таблице 1 приведена дистрибуция аллелей и генотипов 4G / 5G полиморфизма гена РАІ-1. "Дикий" 5G-аллель гена РАІ-1 наблюдали в 104 (72,2%) случаях из 186 выделенных аллелей, где в 7 хромосоме промоторной зоне гена РАІ-1 q21.3-q22 в позиции -675bp была выявлена однонуклеотидная инсерция гуанозина (rs1799768). Неблагоприятный аллель делеции 4G выявляли в 2,6 раза реже - 40 случаев (27,8%) (р <0,05).
Таблица 1 - Дистрибуция аллелей и генотипов гена РАІ-1 (4G/5G полиморфизм)
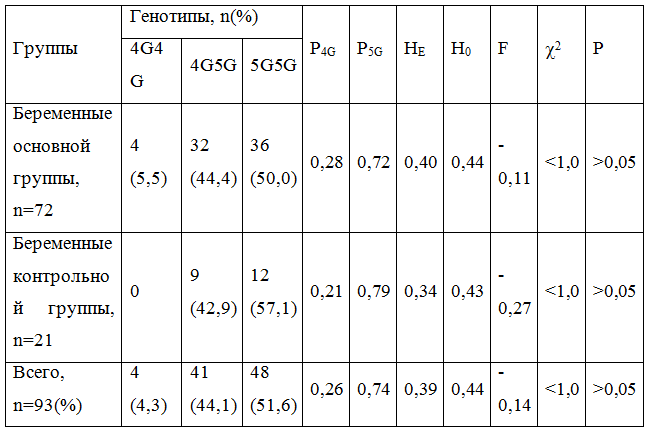
Достоверных различий в распределении генотипов в гена РАI-1 не обнаружили (р> 0,05). При этом доля неблагоприятного 4G-аллеля, как в опытной, так и контрольной группах была меньше (P4G = 0,28 и P4G = 0,21, соответственно), чем у лиц европеоидной (P4G = 0,58) и монголоидной (P4G = 0,54) рас, однако превышала таковую в экваториальной расе (P4G = 0,13) [3]. Частота встречаемости 4G4G-генотипа совпадала, к примеру, с таковой у жителей Саудовской Аравии больных хронической почечной недостаточностью, находящихся на гемодиализе, однако была весомо меньше, чем в популяции в целом [1]. У беременных с ожирением частота "мутантного" аллеля была на 6,4% больше (c2 = 5,81, р = 0,016), чем в группе контроля, без достоверных различий по количеству гетерозигот, и меньшей частотой 5G гомозигот на 7,1 % (c2 = 9,61, р = 0,002). Распределение генотипов среди обследуемых отвечал ожидаемой равновесии Харди-Вайнберга (табл. 2) при незначительной тенденции к увеличению гетерозиготности (p> 0,05).
Таблица 2 - Анализ гетерозиготности и аллельного состояния 4G/5G полиморфизма гена PAI-1
Примечания: 1. Р4G – относительная частота аллеля 4G; Р5G – относительная частота аллеля 5G. 2. Н0 – фактическая гетерозиготность (heterozygosityobserved); НЕ – ожидаемая гетерозиготность (heterozygosityexpected); F – коэффициент инбридинга (относительное отклонение частот генотипов от панмиксии (случайного скрещивания) частот в пределах гетерозиготного дефицита, или избытка. 3. c2p – критерий справедливости «нулевой» гипотезы между фактической и ожидаемой гетерозиготностью. 4. n (%) – количество (процент) наблюдений.
Среди лиц основной группы частота встречаемости гомозигот по доминантному 5G-аллелю (50,0%) достоверно не отличалась от количества гетерозигот (44,4%). В контрольной группе распределение генотипов по гену РАI-1 тоже отвечал равновесию Харди-Вайнберга (табл. 2) и имел недостоверную тенденцию к росту гетерозиготности, без статистически значимой разницы с таковой в основной группе.
Таким образом, среди обследованных женщин мутация в 675 позиции промоторной зоны гена PAI-1 встречается в 26,4% случаев. У беременных с ожирением "мутантный" 4G-аллель гена PAI-1 наблюдается на 6,4% чаще, чем в контроле (c2 = 5,81, р = 0,016). По аллельным частотам 4G5G полиморфизма гена РАI-1 преобладает "дикий" 5G-аллель (73,6% против 26,3% случаев минорного 4G-аллеля).
Литературные сообщение об особенностях распределения генотипических вариантов полиморфизма гена РАI-1 носят противоречивый характер и весомо отличаются в отдельных популяциях, этнических группах [3] и рас. В многочисленных исследованиях носительство 4G-аллеля ассоциируется с частым развитием преклампсии, привычного невынашивания [5], синдрома задержки развития плода [7], послеродовыми осложнениями и тому др. Отдельные исследователи наоборот отрицают связь 4G аллеля с развитием акушерских осложнений [10].
Среди обследованных беременных мутация в 675 позиции промоторной зоны гена PAI-1 встречается в 26,4% случаев. У беременных с ожирением "мутантный" 4G-аллель гена PAI-1 наблюдается на 6,4% чаще, чем в контроле (c2 = 5,81, р = 0,016). По аллельной частоте 4G / 5G полиморфизма гена РАI-1 преобладает "дикий" 5G-аллель (73,6% против 26,3% случаев минорного 4G-аллеля).
Литература
- Differential localization and expression of urokinase plasminogen activator (uPA), itsreceptor (uPAR), and its inhibitor (PAI-1) mRNA and protein in endometrial tissue during the menstrual cycle / J. Nordengren, R. Pilka, V. Noskova [ etal.] // Mol. Hum. Reprod. - 2004. - Vol. 10. - P. 655-663.
- Fernandes KS4G / 5G polymorphism modulates PAI-1 circulating levels in obese women / KSFernandes, VC Sandrim // Mol. Cell.Biochem.- 2012. - Vol. 364, № 1-2. - Р. 299-301.
- Naran N.H. The influence of metabolic syndrome components on plasma PAI-1 concentrations is modified by the PAI-1 4G / 5G genotype and ethnicity / NH Naran, N. Chetty, NJ Crowther // Atherosclerosis. - 2008.-Vol.196, N1.- P.155-163.
- Plasminogen activator inhibitor 1 4G / 5G polymorphism and coagulation factor XIII Val34Leu polymorphism: impaired fibrinolysis and early pregnancy loss / A. Dossenbach-Glaninger, M. van Trotsenburg, M. Dossenbach [et al.] // Clin. Chem. - 2003. -Vol.49, № 7. - Р. 1081-1086.
- Polymorphisms in the ACE and PAI-1 genes are associated with recurrent spontaneous miscarriages / T. Buchholz, P. Lohse, N. Rogenhofer [et al.] // Hum. Reprod. - 2003. - Vol.18, № 11. - Р. 2473-2477.
- Polymorphisms of plasminogen activator inhibitor-1, angiotensin converting enzyme and coagulation factor XIII genes in patients with recurrent spontaneous abortion / M. Aarabi, T. Memariani, S. Arefi [et al.] // J.Matern. Fetal. Neonatal. Med.- 2011. - Vol.24, №3. - Р. 545-548.
- Recurrent pregnancy loss and its relation to combined parental thrombophilic gene mutations / O.Ozdemir, GIYenicesu, F. Silan // Genet. Test. Mol. Biomarkers. - 2012. - Vol.16, № 4. - Р.279 - 286.
- Role of the 4G / 5G polymorphism of PaI-1 gene promoter on PaI-1 levels in obesepatients: influence off at distribution and insulin-resistance / MTSartori, R.Vettor, G.DePergola [etal.] // Thromb. Haemost. - 2001. - Vol.86, № 5. - Р. 1161-1169.
- The "Great Obstetrical Syndromes" are associated with disorders of deep placentation / I. Brosens, R. Pijnenborg, L. Vercruysse [et al.] // Am. J. Obstet. Gynecol. - 2011. -Vol. 204, №3. - Р. 193-201.
- The PAI-1 4G / 5G polymorphism is not associated with an increased risk of adverse pregnancy outcomein asymptomatic nulliparous women / JM Said, R. Tsui, A.J. Borg [etal.] // Thromb. Haemost. - 2012. - Vol. 10 № 5. - Р. 881-886.