EVALUATION OF ACACIA NILOTICA APPLICATION ON GLYCAEMIC LEVELS, HISTOPATHOLOGICAL CHANGES IN THE PANCREAS AND SOME IMMUNOLOGICAL CHANGES OBSERVED IN ALLOXAN DIABETIC RATS
EVALUATION OF ACACIA NILOTICA APPLICATION ON GLYCAEMIC LEVELS, HISTOPATHOLOGICAL CHANGES IN THE PANCREAS AND SOME IMMUNOLOGICAL CHANGES OBSERVED IN ALLOXAN DIABETIC RATS
Abstract
Objective of the study: to evaluate the application of Acacia nilotica on the level of glycemia, histopathological changes in the pancreas and some immunological changes observed in alloxan diabetic rats. By day 21, we recorded a statistically significant 13.4% reduction in body weight in group 3. In group 3, TNF-α level, on the 7th day was 32.5 ± 0.84 pg/ml, which was statistically significantly lower compared to group 2 by 19.7%. AN administration modulates pro- and anti-inflammatory pathways and exerts a protective effect. Summarising our results, it can be said that the use of AN in the complex therapy of diabetes to reduce inflammation and hyperglycemic damage is appropriate.
1. Введение
Лекарственное растительное сырье является огромным ресурсом для производства лекарств, и действительно, лекарственные растения обладают низкой токсичностью, а также превосходной биологической активностью. Acacia nilotica (AN) содержит множество биоактивных компонентов, таких как эллаговая кислота, изокверцитин, лейкоцианадин, кемпферол-7-диглюкозид, производные катехина, производные апигенина и т. д. Растительные фенолы и полифенолы все больше привлекают внимание из-за своих полезных терапевтических свойств, включая антиоксидантные, противовоспалительные и многие др.
, . AN обладает иммуномодулирующим действием для минимизации воспаления , . Воспаление и окислительный стресс опосредуют различные патофизиологические механизмы многих заболеваний. Воспаление – это сложная биологическая реакция, опосредованная провоспалительными цитокинами, такими как фактор некроза опухолей-альфа (TNF-α) и интерлейкин-10 (IL-10) , , . Баланс между титрами TNF-α и титрами IL-10 играет важную роль в поддержании гомеостаза воспаления. Цель исследования – оценка применения AN на уровень гликемии, гистопатологические изменения в поджелудочной железе и некоторые иммунологические изменения, наблюдаемые у крыс с аллоксановым диабетом.2. Методы и принципы исследования
Приготовление водного экстракта AN проводилось по общепринятой и ранее опубликованной методике . В данном исследовании приняли участие 36 беспородных крыс обоего пола (вес 158-201г.). Группы – 2, 3 (диабетические крысы) получили однократную дозу подкожного (п\к) введения раствора аллоксана-тетрагидрата (АЛТТ) из расчета 30 мг/ на 100 г массы тела. Крысы были поделены на 3 группы по 12 крыс в каждой группе: группа 1 – интактные животные (контроль 1); группа 2 – диабет без лечения; группа 3 – диабет + AN перорально (0,25 г/кг массы/день) в течение 21 дня.
Образцы крови забирались из хвостовой вены по стандартной методике, анализ уровня гликемии проводился на анализаторе HUMASTAR 600. Контроль массы тела проводился до эксперимента, на 7-е и 21-е сутки. Экспериментальные крысы (по 6 крыс в группе) были выведены из эксперимента путем эвтаназии на 7-е и 21-е сутки. Поджелудочная железа была быстро препарирована. Ткани поджелудочной железы были быстро извлечены, зафиксированы в течение 24 ч в 10% нейтральном формалине, обезвожены, обработаны ксилолом и залиты в парафин. Ткани были окрашены гематоксилином и эозином для оценки общей гистологической структуры.
В ходе данного исследования мы также оценивали сывороточные уровни TNF-α и IL-10 (уровень данных цитокинов мы оценивали иммуноферментным методом в сыворотке с помощью тест-систем фирмы Bender MedSystems на иммуноферментном автоматическом анализаторе «Personal lab»). Данные были обработаны с помощью программы SPSS (Statistical Analyses for Social Science, Version 8). Для статистической обработки был применен t-критерия Стьюдента и критерий Манна-Уитни. Результаты продемонстрированы следующим образом: М ± m (М – среднее, m – ошибка среднего). Данные значимы при р<0,05.
3. Результаты и их обсуждение
Введение AN животным в группе 3 способствовало снижению веса в сравнении с группой 2. К 21-ому дню нами зафиксировано статистически значимое снижение массы тела в группе 3 на 13,4% в сравнении с контролем 1, что составило 134,6±8,17г., р<0,05. В группе 2 уровень глюкозы на 7-е и 21-е сутки составил 14,71 ± 0,43 ммоль/л и 14,76 ± 0,36 ммоль/л соответственно, р<0,05. Применение AN перорально (0,25 г/кг массы/день) способствовало снижению уровня гликемии, так, уровень гликемии на 7-е сутки был статистически значимо ниже на 66,4% в сравнении с группой 2, уровень гликемии на 21-е сутки был статистически значимо ниже на 66,9% в сравнении с группой 2, р<0,05. Воспаление и окислительный стресс опосредуют различные патофизиологические механизмы многих заболеваний. Баланс между титрами TNF-α и титрами IL-10 играет важную роль в поддержании гомеостаза воспаления. При оценке титров TNF-α и IL-10, выявлена следующая закономерность: так, уровень TNF-α в группе 1 составил 27,3 ± 0,63 пг/мл и 27,1 ± 0,62 пг/мл на 7-е и на 21-е сутки соответственно, p<0,01. В группе 3 уровень TNF-α, на 7-е сутки составил 32,5 ± 0,84 пг/мл, что статистически значимо ниже в сравнении с группой 2 на 19,7%, p<0,01; на 21-е сутки данный показатель в группе 3 составил 29,3 ± 0,82 пг/мл, что статистически значимо ниже в сравнении с группой 2 на 26,1%, p<0,01. Уровень IL-10 на фоне применения AN в группе 3 на 7-е сутки составил 704,5 ± 2,27 пг/мл, что статистически значимо ниже в сравнении с группой 2 на 21,7%, p<0,01; титры IL-10 на фоне применения AN в группе 3 на 21-е сутки составили 687,6 ± 2,49 пг/мл, что статистически значимо ниже в сравнении с группой 2 на 20,8%, p<0,01. Способность AN снижать провоспалительные цитокины и медиаторы окислительного стресса, может иметь большое практическое значение.
Гистологическое исследование тканей поджелудочной железы показало, что инъекция аллоксана через 7 дней вызвала сильное утолщение артериальной стенки с гипертрофией ядер клеток интимы, слабо окрашенными ядрами мышечных клеток средней оболочки и сильно деформированной соединительной тканью адвентициальной оболочки, гемолизированными клетками крови внутри артерии в дополнение к наличию отечных участков вокруг панкреатических ацинусов. На 21-е сутки в группе 2 у животных были обнаружены сильно атрофированные и деформированные островки Лангерганса. У животных в группе 3 (рис. 1), в срезах поджелудочной железы отмечалось улучшение архитектуры островков Лангерганса и панкреатических ацинусов через 7 дней по сравнению с группой 2 с небольшим увеличением отложения коллагеновых волокон между экзокринными ацинусами и вокруг островков Лангерганса. На 21-е сутки островки Лангерганса и экзокринные ацинусы практически полностью восстановили свою нормальную структуру, но отмечались тонкие разбросанные коллагеновые волокна, поддерживающие стенки артерии и вены, вокруг островков Лангерганса и между панкреатическими ацинусами.
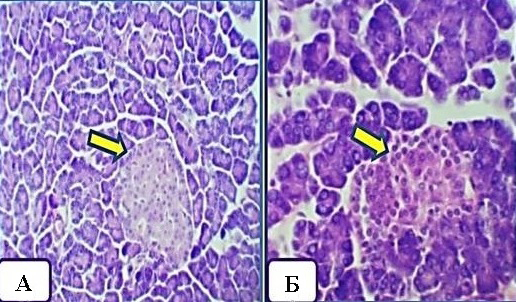
Рисунок 1 - Пример срезов ткани поджелудочной железы у животных в группе 3 на 21-е сутки от начала эксперимента
Примечание: стрелками указаны островки Лангерганса (восстановление клеточной архитектоники на фоне применения A. nilotica). Окраска гематоксилин и эозин; а) увеличение: х250; б) увеличение: х400
4. Заключение
Гипергликемия – катализатор многих процессов, особенно окислительного стресса, воспаления и апоптоза, и все это ускоряет развитие резистентности к инсулину и деградации β-клеток. В ходе данного исследования мы отметили признаки улучшения гистопатологических изменений и состояния островков Лангерганса, а также ацинусов поджелудочной железы, наблюдаемых у животных в группе 3 после лечения AN. Можно предположить, что AN оказывает свое гипогликемическое действие, активируя инсулиновые рецепторы. Многие компоненты, включая полифенолы, танины и флавоноиды (такие как кверцетин), обнаружены в AN
, .Танины улучшают функцию β-клеток поджелудочной железы и способствуют секреции инсулина. Кверцетин является антиоксидантом, следовательно, он защищает от перекисного окисления липидов
, , . Введение AN модулирует про- и противовоспалительные цитокины, поэтому AN может применяться в комплексной терапии диабета для уменьшения воспаления и гипергликемического повреждения. Проделанная нами работа создает парадигму для будущих исследований по изучению экспрессии генов/маркеров воспалительных клеток, которые модулируют и регулируют механизм действия и взаимосвязь между AN и различными реакциями клеток, для получения оптимизированного терапевтического эффекта AN.