Comprehensive physical rehabilitation with high-protein nutrition and heliox inhalations in patients with ischaemic stroke in the intensive care unit
Comprehensive physical rehabilitation with high-protein nutrition and heliox inhalations in patients with ischaemic stroke in the intensive care unit
Abstract
Research objective. To evaluate the effectiveness of rehabilitation using high-protein nutrition and heliox inhalations in patients with acute ischaemic stroke in the intensive care unit in terms of key clinical outcomes.
Materials and methods. Two comparable groups of patients with ischaemic stroke underwent physical rehabilitation: in the main group, patients received a high-protein diet calculated based on the level of urea in daily urine and inhaled helium-oxygen mixtures during rehabilitation sessions; the control group received a diet without a priority for high-protein intake and routine respiratory support during rehabilitation sessions (oxygen through nasal cannulas). The duration and number of rehabilitation sessions were evaluated, as well as the outcome on the modified Rankine scale at discharge from the hospital.
Results and conclusion. The main group managed to conduct, on average, one more rehabilitation session per day, and the sessions themselves lasted 22 minutes longer than in the control group; the main group also had a lower NIHSS score at discharge. Thus, a complex approach involving high-protein nutrition and heliox inhalation during rehabilitation sessions increases the tolerability of physical rehabilitation and reduces the degree of disability in ischaemic stroke.
1. Введение
1.1. Роль нутритивной поддержки при ишемическом инсульте
На данный момент заболеваемость и смертность от ишемического инсульта, несмотря на некоторые положительные тенденции, остается весьма значительной
, , а врачи по-прежнему прикладывают максимальные усилия по всем направлениям ведения пациента с ишемическим инсультом. В том числе, ведется поиск оптимального нутритивного обеспечения. За последние десятилетия проводимые исследования в данной области все больше фокусировались на возможных вмешательствах в процессы, происходящие при ишемическом повреждении мозга, в частности — в процессы, происходящие при нарушении синтеза белка в головном мозге , . Исследователи обнаружили, что при ишемическом инсульте восстановление нейрокогнитивных функций действительно может быть ускорено посредством нутритивной поддержки, что особенно важно с учетом следующих факторов:Во-первых, в клинической практике нет лекарств, достоверно действующих непосредственно на поврежденные структуры мозга при ишемическом инсульте.
Во-вторых, 80% восстановления неврологических нарушений происходит в течение первых 30 дней после острой ишемии (Hata R. и др. Lee J.M. и др.)
, , что говорит о том, что наибольшие усилия для достижения наилучших функциональных результатов должны быть приложены именно в это время.В-третьих, у значительной части пациентов с инсультом может быть катаболический статус (Aquilani R. и др.)
.В-четвертых, через 30–35 дней после начала инсульта пациенты, как правило, испытывают такой же дефицит нутриентов, что и при поступлении в реабилитационный центр
.В-пятых, значимая белково-энергетическая недостаточность была обнаружена даже через 6 месяцев после острого инсульта (Perry L.)
.Экспериментальные исследования подтвердили, что острая ишемия вызывает ранние и глубокие изменения в процессах синтеза белка в головном мозге: синтез белка полностью подавлен в ишемической полутени (Xie Y. и др.)
, что имеет огромное клиническое значение. Во-первых, если данное состояние не купировать, оно, в конечном итоге, приводит к гибели клеток, восстановление же синтеза белка может позволить клеткам нивелировать ишемическое повреждение и вернуть утраченные ранее функции . Во-вторых, подавление синтеза белка сопровождается прогрессированием зоны инфаркта. Было обнаружено, что подавление синтеза белка приводит к разрушению нейронов в ишемической полутени . Даже изолированная блокада синтеза белка является летальной для клеток. У людей важность синтеза белка в головном мозге для выживания нейронов была впервые подтверждена в исследованиях, которые показали нарастание процессов блокирования и повреждения ДНК в ишемическом очаге с последующими осложнениями в виде угнетения синтеза белка и репарации ДНК (White F. и др.) . Нарушение процесса синтеза белка негативно влияет на функцию мозга у пациентов, даже интактных в остальных отношениях. Это было показано в эпидемиологическом исследовании по изучению неврологических заболеваний у людей с низким потреблением белка (Roman G.C. и др.) .Особенно важным представляется тот факт, что несколько исследований по реабилитации, проведенных для изучения эффектов противодействия или ограничения снижения синтеза белка путем обеспечения белковыми нутриентами, показали, что пациенты, получающие такую поддержку, лучше восстанавливают нейрокогнитивные функции. Например, пациенты, получавшие дополнительно 20 г белка перорально в день в течение 21 дня, имели лучшее восстановление неврологического дефицита по сравнению с пациентами, которые получали плацебо
, что подтверждалось оценкой по шкале NIHSS — среднее улучшение показателя NIHSS составило 4,4 балла у пациентов, которые получали добавку белка, и 3 балла в контрольной группе (p <0,01). Более того, прием белка достоверно и положительно коррелировал с улучшением показателя NIHSS; наблюдался выраженный контраст с отношением суточного потребления углеводов (г в день) к потреблению белка (г в день). В другом исследовании у пациентов с подострым инсультом после 21 дня ежедневной добавки к питанию, обеспечивающей 20 г белка и 250 ккал (углеводы 28,2 г, липиды 7 г в дополнение к 20 г белка) значительно улучшилось когнитивное восстановление (+3,9 балла по шкале Mini Mental State Examination — MMSE), в то время как исходное значение по MMSE практически не изменилось у контрольных пациентов (Aquilani R. и др.) .Соответственно, нутритивная поддержка высокобелковым питанием у пациентов с ишемическим инсультом с самых первых дней заболевания имеет крайне важное значение для последующего неврологического восстановления.
Потенциальные преимущества ингаляций гелий-кислородных смесей во время реабилитации при ишемическом инсульте
С момента своего открытия в 1868 году гелий нашел множество применений в медицине. Низкая плотность позволяет использовать его во множестве клинических ситуаций, например, гелий-кислородная дыхательная смесь (гелиокс) таким образом создает совершенно другие параметры потока через дыхательные пути
, , , , , а также , , . В условиях турбулентного потока газа с более низкой плотностью (гелиокс) выгоднее воздуха тем, что мы получаем либо увеличение потока, либо уменьшение требуемого градиента давления. Другими словами, поток газа через препятствие, например, сужение дыхательных путей, увеличивается, если плотность газа уменьшается (как это происходит при использовании гелиокса).Кроме непосредственного облегчения потока воздуха через дыхательные пути, улучшение газообмена достигается также за счет изменения свойств диффузии газов, поскольку, согласно закону Грэма, при уменьшении плотности газов, облегчается процесс их взаимной диффузии и достигается более высокая скорость взаимообмена кислорода и углекислого газа в альвеолярном пространстве за счет замены азота на гелий, который имеет меньшую плотность.
Таким образом, можно утверждать, что применение гелиокса значительно облегчает работу дыхательной системы в любой ситуации, особенно широко кислород-гелиевые смеси применяются при респираторных заболеваниях, в первую очередь, при ХОБЛ, где существует обширнейшая доказательная база. Кроме различных гипоксических состояний, гелий-кислородные также используются и для повышения переносимости физических нагрузок.
Касательно использования гелиокса в первые сутки ишемического ОНМК на текущий момент имеется крайне мало достоверных данных. Из имеющихся исследований стоит упомянуть опыт Y Pan и соавт., которые проводили сравнение различных дыхательных смесей при индуцированной очаговой ишемии головного мозга крыс
. В данном опыте взрослым самцам крыс проводились ингаляции 30% кислорода и 70% азота (контрольная группа), 100% кислорода (группа гипероксии) или 30% кислорода и 70% гелия (группа гелиокса) во время окклюзии средней мозговой артерии в течение 2 часов с последующей реперфузией в течение часа (n = 6 в каждой группе). Неврологический дефицит оценивался через 3 и 24 часа после начала ишемии. По результатам трехчасового наблюдения ни физиологические параметры (температура тела, артериальное давление, частота сердечных сокращений, SpO2 и параметры церебрального кровотока), ни показатели неврологического дефицита не имели достоверных различий между группами. Однако спустя 24 часа неврологические показатели дали статистически значимое улучшение в группе гелиокса (p <0,05). Кроме того, объем инфаркта (среднее значение ± стандартное отклонение), измеренный посредством окрашивания 2,3,5-трифенилтетразолием, составил 36 ± 17% пораженного полушария в контрольной группе, 16 ± 14% в группе гипероксии и всего 4 ± 2% в группе, где использовался гелиокс (р <0,01). По результатам исследования был сделан вывод, что, в то время как гипероксия уменьшала объем инфаркта, гелиокс, кроме этого, также улучшал 24-часовые показатели неврологического дефицита.Таким образом, касательно применения гелий-кислородных смесей, можно сделать вывод, что их использование при ишемическом инсульте несет ряд потенциальных преимуществ по сравнению даже с дыханием 100% кислородом. Несмотря на то, что пока имеется недостаточно данных для активного использования гелиокса в первые сутки ОНМК, возможности его применения с целью повышения переносимости физических нагрузок, в том числе во время реабилитационным мероприятий, представляются весьма перспективными.
2. Методы и принципы исследования
В проспективное одноцентровое когортное исследование были включены 112 пациентов, получавших лечение по поводу острого ишемического инсульта с 2017 по 2022 годы на базе Федерального государственного бюджетного учреждения (ФГБУ) «Центральная клиническая больница с поликлиникой». Критерии включения в исследование:
– ишемический инсульт, подтвержденный путем визуализации головного мозга;
– неврологический дефицит при поступлении в стационар по шкале NIHSS от 5 до 15 баллов.
Критерии исключения: исходно тяжелый неврологический дефицит, не позволяющий проводить активную реабилитацию; пациенты с исходно высокой вероятностью смертельного исхода; пациенты старше 80 лет.
На первом этапе были отобраны пациенты с подтвержденным ишемическим инсультом, с неврологическим дефицитом при поступлении в стационар по шкале NIHSS от 5 до 15 баллов. Отобранные пациенты были распределены случайным образом в две группы, основная группа (1 группа; n = 58) и контрольная группа (2 группа; n = 54). Группы были сопоставимы по возрасту, полу, среднему баллу по шкале NIHHS, локализации инсульта, сопутствующим заболеваниям (таблица 1). В контрольной группе нутритивную поддержку проводили на основании общепринятых методов, где достижение высоких показателей поступления белка с пищей не было приоритетной задачей. В основной группе при поступлении, а также 1 раз в неделю проводили анализ суточной мочи с подсчетом ее объема и содержания мочевины, производили расчет суточной потребности в белке, по формуле: Потребность в белке (г) = [Азот мочевины (г/л) х Объем мочи (л) + 4] х 6,25 один раз в неделю, но не менее 1,3 гр белка/кг массы тела в сутки (при зондовом питании применяли суппортан; при возможности самостоятельного питания больничный стол ВБД + сипинги Nutridrink Compact Protein, 18 г белка/125 мл). В контрольной группе зондовое питание осуществляли с использованием Isosource Standard 1000 мл в сутки, при самостоятельном питании-базисная диета.
Таблица 1 - Клинико-демографические показатели пациентов
Параметры | Основная группа n=58 | Контрольная группа n=54 | р | ||
Возраст (среднее, лет) | 65,4 | 67,2 | 0,216 | ||
Мужской пол, % | 32 | 31 | 0,831 | ||
Женский пол, % | 26 | 23 | 0,872 | ||
Индекс массы тела (ИМТ) (среднее, кг/м2) | 28,2 | 29,5 | 0,584 | ||
Балл по шкале NIHSS (среднее) | 9 | 8 | 1,00 | ||
Локализация инсульта | |||||
В средней мозговой артерии | абс. | % | абс. | % | 1,00 |
44 | 75,86 | 45 | 83,33 | ||
Другая локализация | 14 | 24,14 | 9 | 16,7 | 0,352 |
Сопутствующие заболевания | |||||
Артериальная гипертония 1 степени | абс. | % | абс. | % | 1,00 |
2 | 3,4 | 3 | 5,5 | ||
Артериальная гипертония 2 степени | 6 | 10,3 | 4 | 7,4 | 0,831 |
Артериальная гипертония 3 степени | 45 | 77,6 | 41 | 75,9 | 0,711 |
Ищемическая болезнь сердца | 41 | 70,6 | 36 | 66,6 | 0,352 |
Хроническая сердечная недостаточность | 31 | 53,4 | 33 | 61,1 | 0,831 |
Сахарный диабет 2 типа | 14 | 24,1 | 15 | 27,7 | 1,00 |
Касательно реабилитационных мероприятий, в обеих группах их начало приходилось не ранее чем на вторые сутки заболевания с целью минимизации количества возможных осложнений, что является стандартной практикой. Длительность и объем процедур подбирались индивидуально совместно с реабилитологом в каждом конкретном случае независимо от группы.
Однако, несмотря на большую гетерогенность объема и длительности реабилитационных мероприятий по всем пациентам независимо от группы лечения, ключевым отличием в группе комплексного вмешательства являлась первичная цель: максимально раннее начало и максимально активное вовлечение пациента в процесс реабилитации. Минимально необходимые критерии состояния пациента для начала физической реабилитации были следующие:
1. Стабильная гемодинамика.
2. Компенсированная дыхательная недостаточность.
3. Отсутствиие ортостатических нарушений.
4. Толерантность к физической нагрузке.
Основным критерием прекращения реабилитации было развитие у пациента одного из следующих состояний:
1) субъективная непереносимость, отказ пациента;
2) повышение ЧДД до 28 в минуту и более;
3) выраженная АГ (САД более 180 мм рт. ст.) или ЧСС более 120/мин;
4) SpO2 менее 92%.
При удовлетворительной переносимости объем и длительность повышались (независимо от группы лечения), добавлялось больше активных упражнений. В аспекте проведения реабилитации отличием основной группы от контрольной комплексного вмешательства было проведение ингаляций гелий-кислородной смеси (30% кислорода/70% гелия) одновременно с упражнениями.
Данный метод поддержки пациентов во время реабилитации был выбран нами на основании того, что во время реабилитации основной причиной ее прекращения являлась декомпенсация дыхательной недостаточности, а данный метод является доступным и имеет повышение переносимости физических нагрузок в качестве одного из показаний.
В группах сравнения оценивали длительность и количество сеансов реабилитации, а также результат по модифицированной шкале Рэнкина при выписке из стационара:
0 — отсутствие симптомов;
1 — Отсутствие существенных нарушений жизнедеятельности, способен выполнять обычные повседневные обязанности;
2 — Легкое нарушение жизнедеятельности, справляется с собственными делами без посторонней помощи;
3 — Умеренное нарушение жизнедеятельности; потребность в некоторой помощи, но ходит самостоятельно;
4 — Выраженное нарушение жизнедеятельности; неспособен ходить без посторонней помощи;
5 — Грубое нарушение жизнедеятельности; прикован к постели; 6 — Смерть пациента).
Статистическую обработку проводили с помощью программного обеспечения IBM SPSS Statistics. В статистической обработке использованы точный критерий Фишера для определения значимой связи между категориальными переменными. Непараметрическая оценка и сравнение значений показателей между группами пациентов была проведена при помощи критерия Манна-Уитни. Нулевая гипотеза h0 об отсутствии статистически значимыми различия отвергалась при уровне p<0,05. числовое значение вероятности (p) менее 0,05 (двусторонняя проверка значимости) демонстрировало статистическую значимость различий.
Исследование одобрено Этическим комитетом учреждения всеми участниками (или близкими родственниками) подписано добровольное информированное согласие.
3. Основные результаты
При анализе длительности и количества переносимых сеансов реабилитации в сутки было установлено, что длительность сеанса реабилитации в основной группе в среднем составило 41±13 минут (Min — Max 20 — 46), а в контрольной группе — 19±7 минут (Min — Max 16–24), данное отличие являлось статистически значимым (p = 4,441e-16; 95% CI [-19444404,13, -19444401.01]; MOE — 1,5614; SE — 0,7879; Sp — 4,1665; df — 110) (таблица 2).
Таблица 2 - Длительность и количество сеансов реабилитации в сутки в группах сравнения
Параметры | Основная группа (n=58) | Контрольная группа (n= 54) | р |
Количество сеансов в сутки, n | 3±1 | 2±1 | p=0,089 |
Длительность одного сеанса, мин | 41,4±5,5 | 19,4±2,6 | p<0,001 |
При оценке общего реабилитационного потенциала и степени инвалидизации при выписке пациента (шкала mRS) следует отметить, в обеих группах были пациенты как с высоким потенциалом (0–1 балл), так и пациенты с меньшим реабилитационным потенциалом (высокая степень инвалидизации и социальных ограничений, 3–4 балла), однако в группе вмешательства пациентов с низкой степенью инвалидизации было больше, что видно по таблицам 3, 4 и рисунку 1, представленным ниже.
Таблица 3 - Клиническая характеристика пациентов по шкале mRS при поступлении в ОРИТ
Показатели | Число больных при поступлении в ОРИТ | ||||
Основная группа (n=58) | Контрольная группа (n= 54) | р | |||
mRS 0 баллов | - | - | - | ||
mRS 1 балл | |||||
mRS 2 балла | абс. | % | абс. | % | 0,317 |
14 | 24,1 | 16 | 24,1 | ||
mRS 3 балла | 33 | 56,9 | 29 | 56,9 | 0,712 |
mRS 4 балла | 11 | 19,0 | 9 | 19,0 | 0,231 |
Таблица 4 - Клиническая характеристика пациентов по шкале mRS при выписке из стационара
Показатели | Число больных при выписке | ||
Основная группа (n=58) | Контрольная группа (n= 54) | р | |
mRS 0 баллов, % | 8 | 1 | 0,038 |
mRS 1 балл, % | 19 | 7 | 0,05 |
mRS 2 балла, % | 15 | 17 | 0,69 |
mRS 3 балла, % | 17,3 | 38,9 | 0,06 |
mRS 3 балла, абс. | 10 | 21 | |
mRS 4 балла, % | 10,3 | 14,8 | 0,58 |
mRS 4 балла, абс. | 6 | 8 | |
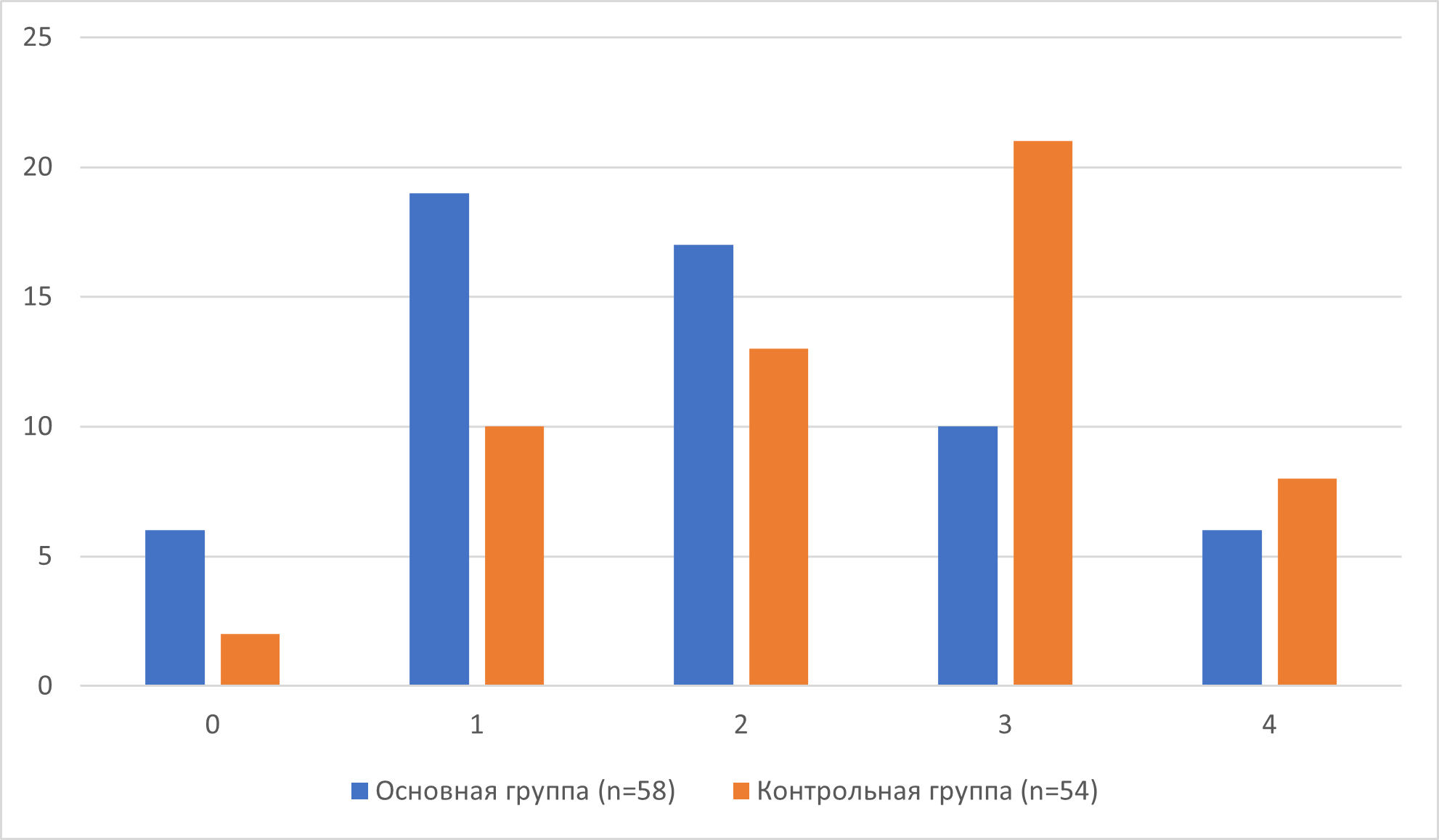
Рисунок 1 - Количество пациентов (по вертикали), имеющих определенный балл по шкале mRS (по горизонтали) к моменту выписки, по группам лечения
4. Обсуждение
В настоящее время продолжается поиск путей улучшения клинических исходов пациентов с ишемическим инсультом. В силу различных факторов, в том числе потому, что в клинической практике нет лекарств, достоверно действующих непосредственно на поврежденные структуры мозга при ишемическом инсульте, а частота вмешательств по реваскуляризации до сих пор находится на достаточно низком уровне, в настоящее время уделяется большое внимание поиску методов улучшения эффективности методов физической реабилитации. Уже проведенные исследования обнаружили, что при ишемическом инсульте восстановление нейрокогнитивных функций может быть ускорено посредством нутритивной поддержки с высоким содержанием белка. Кроме того, применение ингаляций гелий-кислородной дыхательной смеси непосредственно во время реабилитационных мероприятий позволяет отсрочить главную причину их прекращения — декомпенсацию дыхательной недостаточности, тем самым, дополнительно к нутритивной поддержке, улучшая переносимость сеансов реабилитации.
При анализе результатов исследования указанные предположения подтвердились — было выявлено, что в основной группе реабилитация проводилась дольше и чаще (более высокое количество сеансов в день и длительность одного сеанса, статистически значимые различия).
Что касается результатов, в основной группе наблюдалось статистически значимое отличие в лучшую сторону по конечному уровню инвалидизации пациентов при выписке из больницы. Ограничениями данного исследования является отсутствие регистрации долгосрочного результата спустя 6–12 месяцев, что служит предметом будущих исследований. Другим ограничением является невозможность сопоставление результатов с данными аналогичных исследований, поскольку все опубликованные работы в данном направлении имеют экспериментальный характер.
5. Заключение
Применение высокобелковой нутритивной поддержки и ингаляций гелий-кислородных смесей во время сеансов физической реабилитации у пациентов, поступивших в ОРИТ с острым ишемическим инсультом, способствует улучшению переносимости проводимой реабилитации, увеличивая длительность сеансов и их количество, чем при использовании стандартной нутритивной поддержки и ингаляций кислорода без добавления гелия.
Указанные меры по коррекции дыхательной недостаточности во время физической реабилитации совместно с нутритивной поддержкой высокобелковым питанием могут улучшить отдаленные исходы в виде снижения степени инвалидизации и социальной зависимости у пациентов с ишемическим инсультом.
