Interaction of Detonated Nanodiamonds with Nonsteroidal Anti-Inflammatory Drugs
Interaction of Detonated Nanodiamonds with Nonsteroidal Anti-Inflammatory Drugs
Abstract
Two types of commercial detonation synthesis nanodiamonds (DNA) having different surface charge in suspensions were modified to reduce impurities and give the particles high colloidal stability. Physical adsorption was used to produce conjugates of modified DHAs and the non-steroidal anti-inflammatory drugs (NSAIDs) diclofenac and ketorolac. Adsorption and desorption studies showed high binding capacity of DNA towards the studied NSAIDs, as well as a pronounced prolongation effect of the modified particles in drug release. The results obtained indicate the potential of detonation nanodiamonds as a carrier for transdermal delivery of NSAIDs.
1. Введение
В настоящее время наноалмазы детонационного синтеза нашли широкое применение для разнообразных практических целей: в защитных покрытиях металлов, диагностических тест-системах, микро-электромеханических устройствах, в качестве добавок к полимерным и смазочным материалам , , , . Возможность модификации поверхности, высокая адсорбционная способность, нетоксичность и малый размер частиц ДНА предполагает большой потенциал их применения в биомедицинской области, особенно в системах доставки лекарственных средств , , , . Различные механизмы, включая адсорбцию и ковалентное связывание, могут быть использованы для иммобилизации лечебных субстанций на частицы ДНА, в зависимости от свойств конкретного лекарственного препарата. В отличие от других типов синтетический наноалмазов, ДНА обладает выраженной полифункциональной поверхностью, что делает его универсальным адсорбентом для многих видов биологически активных веществ .
Для использования в биомедицинских целях большинство коммерческих ДНА малопригодны и требуют дальнейшей их обработки, поскольку наночастицы содержат большое количество поверхностных примесей, обладают низкой седиментационной устойчивостью в суспензиях и выраженной полидисперсностью , . При высыхании суспензий частицы ДНА агрегируют и теряют коллоидную устойчивость, что делает невозможным их последующее ресуспендирование в дисперсионных средах и фракционирование. Существует несколько способов преодоления агрегации и повышения седиментационной устойчивости ДНА, включая обработку поверхностно активными веществами, удаление примесей ионообменными смолами, окисление при повышенных температурах, ультразвуковую обработку и т.д. , .
В настоящее время нестероидные противовоспалительные препараты широко применяют в разных областях клинической медицины (хирургия, травматология, неврология, гинекология, урология, онкология) в качестве эффективных обезболивающих и противовоспалительных средств для лечения острых и хронических заболеваний. Лечебный эффект НПВП связан с ингибированием фермента циклооксигеназы, что препятствует образованию простагландинов и тромбоксанов из арахидоновой кислоты . Существуют разные способы применения НПВП в терапевтических целях – наружно, перорально и в виде внутримышечных и внутривенных инъекций. С практической точки зрения наружный способ применения медицинских пластырей, содержащих НПВП, наиболее прост, так как осуществляется пациентом самостоятельно и обеспечивает пролонгированную трансдермальную доставку препарата в организм . Кроме того, при пероральном приеме НПВП могут наблюдаться нежелательные побочные эффекты со стороны ЖКТ и почек.
В предлагаемом исследовании мы используем эффективный метод модификации коммерческих ДНА с целью придания им свойств, необходимых для применения в качестве носителей НПВП и обеспечивающих пролонгированный выход лекарственных препаратов из конъюгатов ДНА/НПВП.
2. Материалы и методы исследования
В работе использовали: порошок ДНА (далее РНА) российского производства (ООО «Реал-Дзержинск») и порошок, полученный после высушивания 5%-ой водной суспензии ДНА (далее СНА) зарубежного производства (Carbodeon Ltd Oy, Финляндия). Водорастворимые соли НПВП – кеторолак трометамин и диклофенак натрия приобретены у Sigma-Aldrich Co. LLC (Германия) и использованы в исследованиях без дополнительной очистки.
Исходные ДНА модифицировали для получения наночастиц, обладающих высокой коллоидной стабильностью и чистотой, необходимой для биомедицинского применения . Процедуру модификации начинали с приготовления исходных суспензий наночастиц, содержащих: деионизированную (ДИ) воду (сопротивление 18 Мом · см), полученную с помощью системы Milli-Q (Millipore, США), порошок ДНА в концентрации 5 масс.% и модифицирующий реагент. Приготовленные суспензии инкубировали в течение 5 часов при комнатной температуре. В ходе инкубации наблюдалась преципитация ДНА с образованием осадка, а продукты реакции модификатора с поверхностными примесями частиц переходили в надосадочную жидкость, которую затем удаляли. К осадкам добавляли ДИ воду, ресуспендировали частицы ДНА перемешиванием на магнитной мешалке, после чего суспензии центрифугировали при 5000 g (Centrifuge 5415 R, Eppendorf AG, Германия) в течение 5 мин при 10°С. К полученным осадкам добавляли ДИ воду и перемешивали до получения однородных суспензий. Суспензии повторно центрифугировали при 16000 g (Centrifuge 5415 R) в течение 20 мин при 10°С и удаляли полученный супернатант. Такой цикл обработки повторяли до удаления избытка модификатора, что проявлялось изменением цвета надосадочной жидкости за счет появления в ней коллоидно-устойчивых частиц ДНА.
Распределение модифицированных ДНА по размерам определяли методом динамического светорассеяния с использованием Zetasizer Nano ZS (Malvern Instruments Ltd., Великобритания). Этот прибор использовали также для измерения дзета (электрокинетического) потенциала частиц. В работе представлены средние данные трех измерений, каждое из которых включало 20 опытов, проведенных на водных суспензиях ДНА (концентрация ~0,1 масс.%) при 25°С. Элементный состав ДНА оценивали с помощью сканирующего электронного микроскопа TM-1000 (Hitachi, Япония).
Для получения комплексов ДНА/НПВП 100 мкл суспензии, содержащей 5 мг модифицированных частиц РНА (или СНА), добавляли к 1000 мкл водных растворов НПВП известных концентраций. Образцы перемешивали при комнатной температуре в течение 10 мин для обеспечения равновесной адсорбции. Затем в образцы добавляли 2 мкл 1 М раствора CaCl2 или 0,25 М NaCl и инкубировали 5 мин при постоянном перемешивании. После этого из образцов удаляли ДНА центрифугированием при 16000 g (Centrifuge 5415 R) в течение 10 мин при 10°С. В полученных супернатантах спектральным методом оценивали количество несвязавшегося с наночастицами диклофенака и кеторолака по величине остаточного поглощения при длинах волн 276 и 323 нм, соответственно. Для анализа супернатанты предварительно разводили ДИ водой в соотношении 1 : 400, измерения проводили на спектрофотометре UV-1800 (Shimadzu, Япония). Концентрацию неадсорбированного частицами НПВП определяли на основе линейных калибровочных кривых, полученных в серии измерений с растворами НПВП известной концентрации. Адсорбционную емкость частиц ДНА рассчитывали, как отношение массы адсорбированного лекарственного препарата к массе адсорбента.
Диффузионные профили полученных комплексов РНА/диклофенак и СНА/кеторолак оценивали in vitro при 26°С с использованием оригинальной ячейки, включающей полупроницаемую мембрану между донорной и рецепторной камерами. В качестве мембраны была использована диализная пленка 36/32 VISKING (Serva, Германия) с радиусом пор 24 Å и пределом исключения 8-15 кДа. Перед экспериментом мембрану активировали инкубацией в течение 1 часа при 50°C в 10 мМ растворе ЭДТА (Serva, Германия) с нейтральным значением рН (7,0) и последующей многократной промывкой мембраны ДИ водой. Предварительно было установлено, что частицы модифицированных ДНА не проникают через диализную мембрану. Донорная камера представляла собой пластиковое кольцо диаметром 27 мм, на одном конце которого была зафиксирована диализная мембрана. Камеру закрепляли на поплавке, погруженном в стеклянный стакан, содержащий 30 мл ДИ воды в качестве рецепторного раствора. Образцы комплексов ДНА/НПВП (2 мл) вносили в донорную камеру, диализная мембрана которой находилась в рецепторном растворе, который постоянно перемешивали с помощью магнитной мешалки в течение всего эксперимента. В ходе исследования из рецепторного раствора периодически (каждый час в течение первых 24 часов и с 12-ти часовым интервалом в дальнейшем) отбирали пробы, которые замещали добавлением равного объема ДИ воды. Наличие НПВП в пробах определяли спектрофотометрически и рассчитывали их концентрацию с использованием калибровочных кривых. В сравнительных экспериментах, проводимых в аналогичных условиях, оценивали диффузионные профили свободных НПВП, растворы которых готовили в 2 мл ДИ воды. Количество диклофенака и кеторолака в приготовленных растворах соответствовало их количеству в комплексах РНА/диклофенак и СНА/кеторолак, рассчитанному из значений адсорбционной емкости ДНА к этим НПВП.
3. Основные результаты и их обсуждение
Одной из причин низкой седиментационной устойчивости исходных ДНА (рис. 1б) могут быть металлические примеси, способствующие коагуляции отдельных частиц алмаза . Напротив, суспензии модифицированных ДНА демонстрировали прекрасную стабильность – осаждение частиц не наблюдалось в течение нескольких месяцев (рис. 1в). Все модифицированные ДНА имеют дзета-потенциал выше 30 мВ или ниже -30 мВ (табл. 1), что свидетельствует об их стабильности при диспергировании . Выделение РНА из шихты и последующая обработка приводит к образованию большого количества карбоксильных групп на поверхности частиц , . Диссоциация этих групп в воде приводит к отрицательному заряду на поверхности РНА. Положительный заряд СНА в суспензиях можно объяснить протонированием поверхностных аминогрупп , . Отметим, что проведенная модификация не меняет знак заряда частиц ДНА в суспензии, но увеличивает его значение по абсолютной величине.

Рисунок 1 - Водные суспензии наноалмазов: исходная суспезия РНА сразу после приготовления (а) и спустя 1 час (б), суспезия модифицированных РНА после 2 месяцев хранения (в)
Таблица 1 - Размер частиц и дзета-потенциал ДНА и коньюгатов ДНА/НПВП в водных суспензиях (среднее±стандартное отклонение, n=3)
Образец | Диаметр, нм | Дзета-потенциал, мВ |
РНА | 82,9±19,0 | -50,5±3,2 |
СНА | 75,5±16,5 | +39,3±4,0 |
РНА/Диклофенак | 121,5±25,8 | -35,6±6,8 |
СНА/Кеторолак | 563±184,6* | +19,9±10,7 |
Примечание: *бимодальное распределение
Модификация также существенно снижает количество неорганических примесей, содержащихся в исходных ДНА. Как показал элементный анализ, общее количество металлов (Al, Si, P, Ca, Fe, Ni, Cu и Zn) в образцах РНА, например, снизилось более чем в два раза (с 1,1% до 0,5%). Это можно объяснить использованием модификатора, связывающего ионы двухвалентных металлов.
Значения дзета-потенциала (табл. 1) РНА и их конъюгатов с диклофенаком свидетельствуют о наличии препарата на поверхности ДНА. Из-за образования комплексов РНД/диклофенак их дзета-потенциал значительно ниже (по абсолютной величине), чем у исходных ДНА. Аналогично, конъюгация кеторолака с поверхностью СНА ведет к снижению й заряда частиц примерно на 50% и, как следствие, к низкой устойчивости конъюгатов в суспензии. Адсорбция НВПВ также проявляется в увеличении размера частиц ДНД (табл. 1).
Отрицательно заряженные РНА практически не адсорбируют кеторолак, имеющий отрицательный заряд, очевидно, за счет электростатического отталкивания. При этом эти ДНА продемонстрировали высокую адсорбцию диклофенака, имеющего в растворах положительный заряд. Известно, что силы притяжения/отталкивания играют важную роль в процессе адсорбции веществ на ДНА . Однако простая электростатическая модель не может объяснить взаимодействие СНА с исследуемыми НПВП, учитывая высокую адсорбционную эффективность СНА по отношению как к кеторолоку, так и диклофенаку.
Анализ данные экспериментов показали, что адсорбция НПВП на ДНА хорошо согласуется с моделью Ленгмюра , возрастая с увеличением отношения массы препарата к массе ДНА. Максимальные полученные значения адсорбционной емкости составляют: 0,524±0,11 мг/мг при взаимодействии РНА с диклофенаком; 0,516±0,12 и 0,38±0,07 мг/мг при адсорбции на СНА кеторолака и диклофенака, соответственно.
В исследованиях диффузионных профилей с использованием комплексов РНА/диклофенак и СНА/кеторолак было установлено, что в обоих случаях высвобождение адсорбированных на частицы ДНА препаратов с их последующим трансмембранным поступлением в рецепторную камеру происходило гораздо медленнее, чем свободных НПВП, не связанных с наночастицами (рис. 2 и 3). Как видно из представленных данных, в течение первых 20 часов эксперимента около 60% молекул свободных НПВП обнаруживалось в рецепторной камере. В то же время, за аналогичный временной период из комплексов ДНА/НПВП высвобождалось и поступало в рецепторную камеру не более 15% общего количества адсорбированных частицами препаратов.
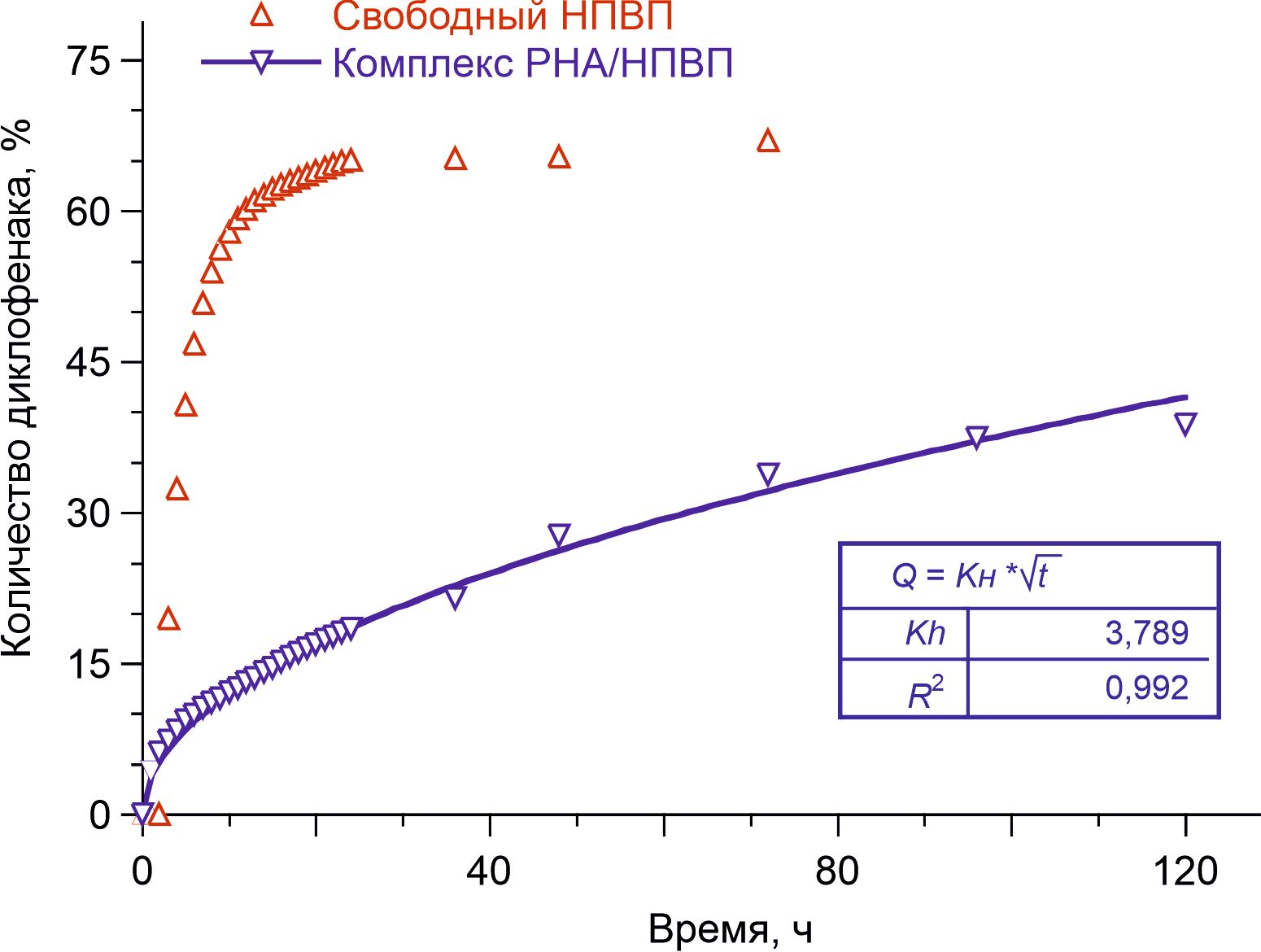
Рисунок 2 - Доля диклофенака, трансмембранно поступившего в рецепторную камеру
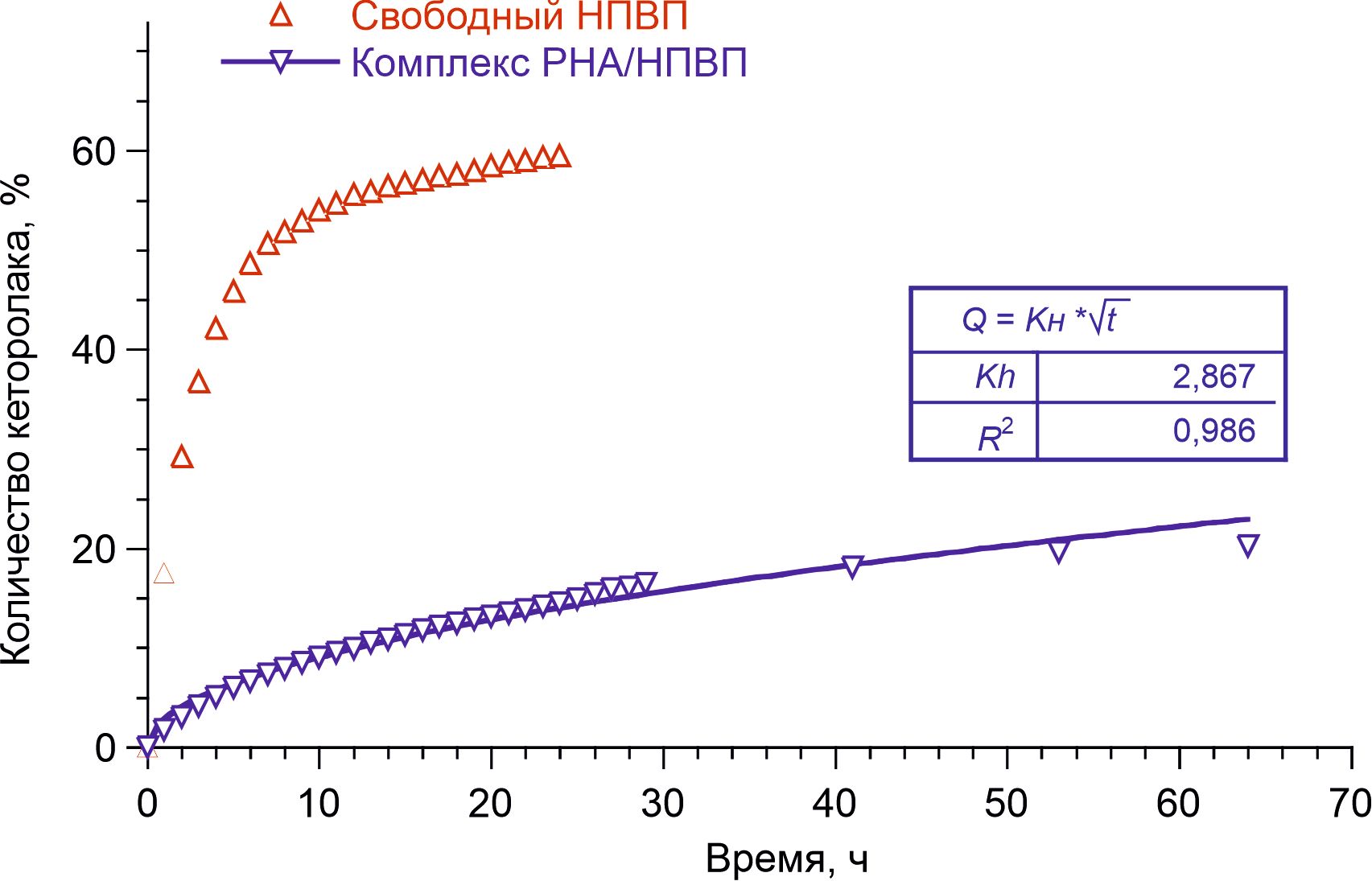
Рисунок 3 - Доля кеторолака, трансмембранно поступившего в рецепторную камеру
4. Заключение
Коммерческие ДНА были модифицированы для уменьшения количества поверхностных примесей частиц и придания им высокой седиментационной устойчивости в водных суспензиях. Методом физической адсорбции получены конъюгаты модифицированных ДНА с диклофенаком и кеторолаком. Эксперименты показали высокую связывающую способность ДНА к изучаемым НПВП. Экспериментально установлен эффект пролонгированного высвобождения адсорбированных лекарственных препаратов из комплексов ДНА/НПВП.
Результаты настоящего исследования показали перспективность применения модифицированных ДНА в качестве носителя для пролонгированной трансдермальной доставки НПВП в организм пациента.
