SYNTHESIS OF N - HETEROCYCLIC PROLIGANDS AS PROMISING NEW GENERATION OF STABILIZING LIGANDS
СИНТЕЗ N – ГЕТЕРОЦИКЛИЧЕСКИХ ПРОЛИГАНДОВ КАК ПЕРСПЕКТИВНЫЕ СТАБИЛИЗИРУЮЩИЕ ЛИГАНДЫ НОВОГО ПОКОЛЕНИЯ
Научная статья
Пасюков Д.В.1, Новикова Д.А.2, *, Андреева А.Н.3, Шумская И.Ю.4
1 ORCID: 0000-0002-1851-9017;
2 ORCID: 0000-0002-4316-4932;
1, 2, 3, 4 Южно-Российский государственный политехнический университет имени М.И. Платова, Новочеркасск, Россия
* Корреспондирующий автор (diananovikova3773[at]gmail.com)
АннотацияВ работе проведен анализ применения органометаллических катализаторов, в частности, комплексов с N-гетероциклическими карбенами. Рассматриваемые субстраты могут быть использованы как стабилизирующие лиганды для синтеза устойчивых комплексов. В свою очередь, комплексы могут применяться в качестве эффективных катализаторов нового поколения образования связей углерод-углерод, углерод-гетероатом. В большинстве случаев, активность катализаторов прямо зависит от структуры N-гетероциклических карбенов в плане стерических и электронных свойств, что представляет наибольших интерес в качестве объектов для исследования. Представленные в работе методы позволяют получить как симметричные, так и несимметричные бензимидазольные, имидазолевых и триазолевых карбенов.
Ключевые слова: N-гетероциклические карбены, алкилирование, пролиганды.
SYNTHESIS OF N - HETEROCYCLIC PROLIGANDS AS PROMISING NEW GENERATION OF STABILIZING LIGANDS
Research article
Pasyukov D.V.1, Novikova D.A.2, *, Andreeva A.N.3, Shumskaya I.Yu.4
1 ORCID: 0000-0002-1851-9017;
2 ORCID: 0000-0002-4316-4932;
1, 2, 3, 4 Platov South-Russian State Polytechnic University , Novocherkassk, Russia
* Corresponding author (diananovikova3773[at]gmail.com)
AbstractThe paper analyzes the use of organometallic catalysts, namely the complexes with N-heterocyclic carbenes. The substrates under study can be used as stabilizing ligands for the synthesis of stable complexes. In turn, the complexes can be used as effective catalysts of a new generation of carbon-carbon, carbon-heteroatom bond formation. In most cases, the activity of catalysts directly depends on the structure of N-heterocyclic carbenes in terms of steric and electronic properties, which is of the greatest interest as objects for research. The methods presented in this study allow for obtaining both symmetric and asymmetric benzimidazole, imidazole, and triazole carbenes.
Keywords: N-heterocyclic carbenes, alkylation, proligands.
ВведениеСоединения палладия широко используется в разных сферах жизни человека: в производстве автомобильных «катализаторов», электронике, ювелирных изделиях и стоматологии. Тем не менее, важнейшим практическим применением палладия можно с уверенностью считать использование его соединений в качестве катализатора органических реакций [1]. В промышленности, палладий получил широкое распространение как гетерогенный катализатор, для многих органических реакций необходимо использовать гомогенный металлокомплексный катализатор, отличающийся высокой активностью и селективностью [2]. Это позволяют проводить экологические чистые процессы, и в ряде случаев имеют значительные преимущества перед гетерогенными аналогами. Металлоорганические комплексы успешно используются для синтеза полимеров, пластических масс каучуков, лекарственных препаратов и получения сверхчистых металлов и полупроводников.
В настоящее время процесс синтеза органических веществ на основе гомогенных металл-катализируемых реакций кросс-сочетания, т.е. образования связей углерод-углерод или углерод-гетероатом (C-X, где X = S, O, N) находится в стадии интенсивного развития [3] и все более активно внедряется в промышленное производство фармацевтических препаратов [4]. Например, палладий-катализируемые реакции образования связей С-S и С-N активно используются в промышленном производстве лекарств (Рис. 1).
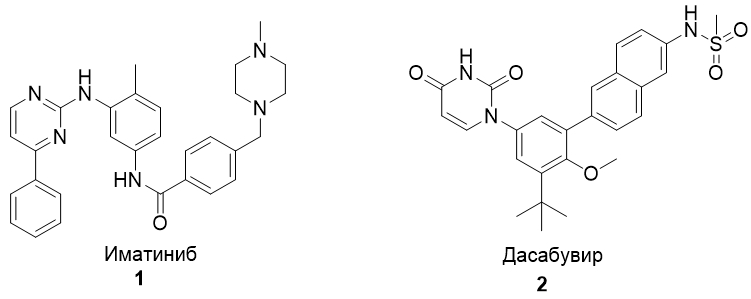
Рис. 1 – Лекарственные препараты, полученные с помощью палладий-катализаруемых реакций
Применение комплексов металлов на основе палладия позволит получать сложные органические соединения минуя множество стадий, что позволяет существенно сократить затраты. За последние пять лет опубликовано более 100 000 статей, посвященных использованию органических комплексов металла в реакциях образования связей углерод-углерод и углерод-гетероатом.
Среди органометаллических катализаторов особое место занимают комплексы палладия в частности с N-гетероциклическими карбенами (NHC), которые характеризуются высокой прочностью связи металл-NHC и широкими возможностями для варьирования электронных и пространственных характеристик путем изменения структуры NHC лигандов [5], поэтому комплексы палладия с N-гетероциклическими лигандами (Pd/NHC) получили широкое распространение как катализаторы для уникальных органических реакций образования связей углерод-углерод углерод-гетероатом [5], [6].
Наиболее распространённым методом получения комплексов является реакция прекурсора палладия (PdCl2, Pd(OAc)2 и т.п.) с N-гетероциклическими пролигандами представляющие собой соли соответствующих лигандов имеющие общую структурную формулу [NHCH]+X-. Наиболее распространённые пролиганды для синтеза Pd/NHC комплексов представленные на Рис. 2.
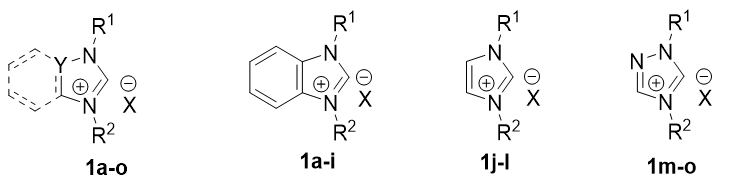
Рис. 2 – Общие структурные формулы N-гетероциклические пролигандов
Анализ представленных в данной статье показывает, что работа по детальному изучению методов синтеза NHC лигандов не потеряла своей актуальности.
Основная часть
В качестве начального этапа были проведены синтезы уже известных симметричных NHC лигандов – солей 1,3-диалкилбензимидазолия, 1,3-диарилимидазолия и 1,4-диалкилтриазолия 1a-o (табл. 1).
Таблица 1 – Полученные пролиганды
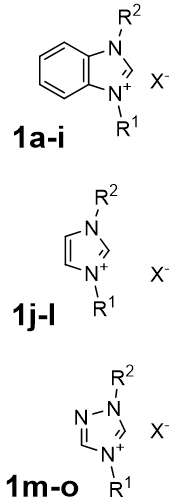
|
№ | 1a | 1b | 1c | 1d | 1e | 1f | 1g | 1h |
| R1 | Me | Et | Pr | i-Pr | Me | Me | Bu | Bn | |
| R2 | Me | Et | Pr | i-Pr | i-Pr | Bu | Bu | Bn | |
| X | I | Br | I | Br | I | I | Br | Cl | |
| № | 1i | 1j | 1k | 1l | 1m | 1n | 1o | ||
| R1 | Bn | Me | DiPP | Mes | Me | Bu | Bn | ||
| R2 | Bn | Me | DiPP | Mes | Me | Bu | Bn | ||
| X | Br | I | Cl | Cl | I | Br | Br |
Большинство азолиевых солей достаточно хорошо растворяются в воде, как и многие неорганические соли, эти обстоятельства позволяют провести реакцию обмена галогенов: Cl на Br, Br на I или другие анионы, например, BF4 или PF6. Данную процедуру совершают не только для получения нового противоиона в молекуле соли, но и для лучшей картины рентгеноструктурного анализа (Рис. 3).
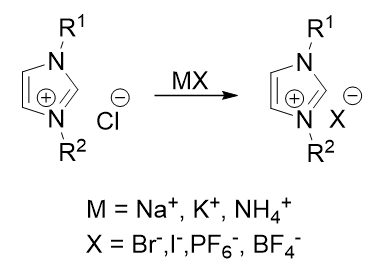
Рис. 3 – Реакция ионного обмена противоиона
Азолевые соли можно получать несколькими путями, в статье использовали самые распространненые: метод двукратного прямого алкилирования (метод А) для получения солей диалкилбензимидазола, -имидазола и -триазола и метод циклизации диимина (метод Б) для конструирования диарилимидазольных пролигандов.
Бензимидазолевые соли получали по методу А (Рис. 4). Для этого нагревали бензимидазол и алкилирующий агент с избытком поташа в соответствующем растворителе, что приводило к моноалкилбензимидазолам, которые далее обрабатывали избытком реагента в ацетонитриле.
Двухстадийный подход к синтезу позволил получить несимметричные соли 1e,f. Получение этих соединений требует особого контроля качества продукта на первой стадии реакции, т.к. даже небольшая примесь непрореагировавшего бензимидазола приводит к образованию неразделимой смеси солей.
По методу Б были синтезированны коммерчески-доступные соли 1,3-диарилимидазолия 1k,l (Рис. 4). Этот путь включает две стадии: на первой проводили конденсацию ариламина с глиоксалем с образованием 1,4-диарил-1,4-диазабутадиена, который затем циклизовали с формальдегидом (в виде параформа) в присутствии триметилсилилхлорида или минеральной кислоты.
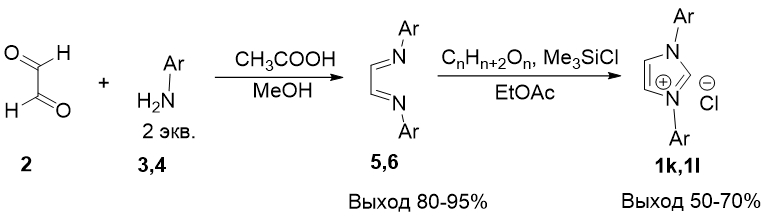
Рис. 4 – Получение имидазольных лигандов метод Б
Триазольные азолиевые соли получали по аналогии с бензимидазольными (Рис. 5) путем двукратного алкилирования.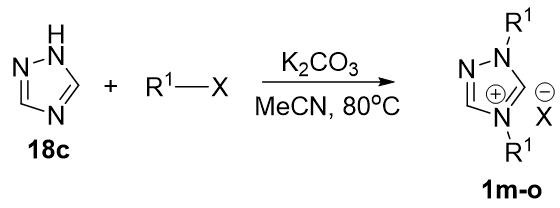
Рис. 5 – Получение триазольных лигандов метод А
Нужно отметить, что монозамещенные имидазолы и триазолы являются жидкостями или твердыми веществами с низкой температурой плавления, порядка 40оС и достаточно гигроскопичными соединениями в отличии от бензимидазольных, поэтому получение чистых лигандов этих типов затруднено.
При получении монозамещенных продуктов прямого алкилирования, чистоту продукта контролировали с помощью тонкослойной хромотографии (ТСХ) и газовой хромато-масс спектрометрией (ГХ-МС). Качество четвертичных азолиевых солей подтверждали методом высокоэффективной жидкостной хроматографии (ВЭЖХ), а также методами ядерной магнитной спектроскопии (ЯМР)
Строение полученных соединений, включая не описанные в литературе и получены впервые в лаборатории соли 1c,e,f,i, подтверждено всеми необходимыми физико-химическими исследованиями – методами ЯМР 1H, 13C и масс-спектроскопией высокого разрешения (HRMS).
Экспериментальная часть
Общая методика получения соединений 1 кроме 1е, 1f.
Бензимидазол, триазол или имидазол (1 ммоль) алкил- арилгалогенид (2.5 ммоль) K2CO3 (5 ммоль) в ацетонитриле (15 мл) при сильном перемешивании, оставляли на 16 часов при 80оС. По истечению времени суспензию отфильтровывали от неорганической части, а маточный раствор упаривали на роторном испарителе.
1,3-Диметил-1H-бензимидазолия йодит (1a) выход 2.37 g (76%) бесцветные кристаллы Физические и спектральные характеристики соответствуют литературным данным [8]
1,3-Диэтил-1H-бензимидазолия бромит (1b) выход 2.54 g (94%) бесцветные кристаллы Физические и спектральные характеристики соответствуют литературным данным [9]
1,3-Дипропил-1H-бензимидазол йодит (1c) Выход 2.94 g (89%), бесцветные кристаллы, т.пл. 103−105 °C. 1H NMR (DMSO-d6, 500 MHz): δ 0.92 (т, J = 7.4 Гц, 6H, 2CH3), 1.91−1.98 (м, 4H, 2CH2), 4.49 (т, J = 7.2 Гц, 4H, 2CH2), 7.67−7.71 (м, 2H, Ar), 8.11−8.15 (м, 2H, Ar), 9.89 (s, 1H, H-2). 13C{1H} NMR (DMSO-d6, 125 MHz): δ 10.7, 22.0, 48.1, 113.7, 126.5, 131.1, 142.0
1,3-Диизопропил-1H-бензимидазол бромид (1d) выход 2.75 g (92%) бесцветные кристаллы Физические и спектральные характеристики соответствуют литературным данным [7]
1,3-Дибутил-1H-бензимидазолия бромид (1g) выход 2.12 g (85%) бесцветные кристаллы Физические и спектральные характеристики соответствуют литературным данным [10]
1,3-Дибензил-1H-бензимидазолия хлорид (1h) выход 2.69 g (89%) бесцветные кристаллы Физические и спектральные характеристики соответствуют литературным данным [11]
1,3-Дибензил-1H-бензимидазолия бромид (1i) Выход 3.49 g (92%) бесцветные кристаллы, т.пл. 221−223 °C. 1H NMR (DMSO-d6, 500 MHz): 5.86 (с, 4H, 2CH2), 7.35−7.43 (м, 6H, Ar), 7.57−7.62 (м, 6H, Ar), 7.99−8.01 (м, 2H, Ar), 10.55 (с, 1H, H-2).13C{1H} NMR (DMSO-d6, 125 MHz): δ 49.9, 114.0, 126.7, 128.3, 128.6, 128.9, 131.0, 134.0, 142.9.
1,3-Диметил-1H-имидазолия йодит (1j) выход 2.69 g (89%) бесцветные кристаллы Физические и спектральные характеристики соответствуют литературным данным [10]
1,3-Бис-(2,6-диизопропилфенил)-1,3-имидазолия хлорид (1k) выход 1.32 g (67%) бесцветные кристаллы Физические и спектральные характеристики соответствуют литературным данным [12]98
1,3-Бис(2,4,6-триметилфенил)-1,3-имидазол хлорид (1l) выход 1.37 g (72%) бесцветные кристаллы Физические и спектральные характеристики соответствуют литературным данным [12]
1,3-Диметил-1H-триазолия йодит (1m) выход 2.69 g (89%) бесцветные кристаллы Физические и спектральные характеристики соответствуют литературным данным [10]
1,3-Дибутил-1H-триазолия бромид (1n) выход 2.37 g (82%) бесцветные кристаллы Физические и спектральные характеристики соответствуют литературным данным [10]
1,3-Дибензил-1H-триазолия бромид (1o) выход 2.69 g (89%) бесцветные кристаллы Физические и спектральные характеристики соответствуют литературным данным [10]
Метод получения несимметричных азолевых солей 1e, 1f
Бензимидазол (1 ммоль) алкил- арилгалогенид (1 ммоль) K2CO3 (5 ммоль) в ацетонитриле (15 мл) при сильном перемешивании, контролировали время протекания реакции по методу ГХ-МС (время реакции от 24-72 часов). После детектирования окончания реакции, суспензию отфильтровывали, маточный раствор упаривали до образования масла (полупродукт алкилирования), после чего растворяли его в ацетоне (20 мл), добавляли необходимый арилгалогенид (1.5 ммоль), при сильном перемешивании оставляли на 5 часов, кипятится с обратным холодильником. После чего в роторном испарителе упаривали растворитель, продукт кристаллизовали в диэтиловом эфире.
1-Метил-3-изопропил-1H-бензимидазолия йодит (1e) Выход 2.69 g (89%) бесцветные кристаллы, т.пл. 195–198 оC. 1H NMR (DMSO-d6): d 1.62–1.63 (м, 6H, 2CH3), 4.09 (с, 3H, CH3), 5.04–5.12 (м, 1H, CH), 7.67–7.71 (м, 2H, Ar), 8.02– 8.05 (м, 1H, Ar), 8.13–8.15 (м, 1H, Ar), 9.89 (с, 1H, H-2). 13C{1H} (DMSO-d6): 21.6, 33.4, 50.3, 113.5, 113.7, 126.26, 126.34, 130.2, 131.9, 141.1.
1-Метил-3-бутил-1H-бензимидазолия бромид (1f) выход 2.11 g (96%) бесцветные кристаллы, т.пл. 37−39 °C. 1H NMR (CDCl3, 500 MHz): δ 0.86−0.89 (м, 3H, CH3), 1.29−1.37 (м, 2H, CH2), 1.87−1.93 (м, 2H, CH2), 4.18 (с, 3H, CH3), 4.46−4.49 (м, 2H, CH2), 9.27 (с, 1H, H-3), 11.28 (с, 1H, H-5). 13C{1H} NMR (CDCl3, 125 MHz): δ 13.3, 19.3, 31.9, 39.5, 48.5, 143.0, 144.3.
ЗаключениеАнализ в представленной работе показывает, что необходимо более детально изучить методики синтеза NHC пролигандов, которые в дальнейшем могут быть использованы в качестве эффективных лигандов для создания улучшенных катализаторов. Структура N-гетероциклических карбенов наиболее вариативная как в плане стерических, так и электронных свойств, что представляет наибольших интерес в качестве объектов для исследования. Полученные в данной работе соединения были показаны наиболее оптимальные условия получения N-гетероциклических пролигандов.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Taccardi N. Gallium-rich Pd–Ga phases as supported liquid metal catalysts / Taccardi, M. Grabau, J. Debuschewitz et al. // Nature Chemistry. 2017. DOI: 10.1038/nchem.2822.
- Афанасьеф В.В. Перспективы использования палладий-катализируемых реакций в тонком органическом синтезе: создание связи углерод-углерод / В.В. Афанасьеф, Н.Б. Беспалова, И.П. Белецкая // Рос. Хим. Ж. (Ж. Рос. Хим. Об-ва им. Менделеева), 2006, 81-93
- O'Brien C. J. Easily Prepared Air‐ and Moisture‐Stable Pd–NHC (NHC=N‐Heterocyclic Carbene) Complexes: A Reliable, User‐Friendly, Highly Active Palladium Precatalyst for the Suzuki–Miyaura Reaction / C. J. O'Brien, E. A. Kantchev, C. Valente et al. // Chemistry – A European Journal- 2006- 12: 4743-4748. DOI: 10.1002/chem.200600251
- Dunbar K. L. Enzymatic Carbon–Sulfur Bond Formation in Natural Product Biosynthesis / K. L. Dunbar, D. H. Scharf; A. Litomska et al. // Chemical Reviews 2017, 117, p. 5521. DOI: 1021/acs.chemrev.6b00697
- Hopkinson M. N. An overview of N-heterocyclic carbenes / M. N. Hopkinson, C. Richter, M. Schedler et al. // Nature 2014, 510, p. 485.
- Ziqin S. Synthesis method of aripiprazole / S. Ziqin, X. Fubiao, J. Ersheng ; Patent CN105085394 (A)- Nov 25- 2015
- Hohloch S. Structural Characterization, Solution Dynamics, and Reactivity of Palladium Complexes with Benzimidazolin‐ 2‐ylidene N‐Heterocyclic Carbene Ligands / Hohloch, N. Deibel, D. Schweinfurth et al. // Eur. J. Inorg. Chem., 2014: 2131-2139. DOI: 10.1002/ejic.201301339
- Er J. A. Synthesis and Study of 5,5′‐Bibenzimidazolylidenes and Their Bimetallic Complexes / J. A. Er, A. G. Tennyson, J. W. Kamplain et al. // Eur. J. Inorg. Chem., 2009: 1729-1738. DOI: 10.1002/ejic.200801188
- Khazipov O. V. Fast and Slow Release of Catalytically Active Species in Metal/NHC Systems Induced by Aliphatic Amines / V. Khazipov, M. A. Shevchenko, A. Yu. Chernenko et al. // Organometallics201837 (9), 1483-1492 DOI: 10.1021/acs.organomet.8b00124.
- Chernyshev V. M. Revealing the unusual role of bases in activation/deactivation of catalytic systems: O-NHC coupling in M/NHC catalysis / V. M. Chernyshev, O. V. Khazipov, M.A. Shevchenko et al. // Sci., 2018, DOI: 10.1039/C8SC01353E
- Astakhov A. V. Facile Hydrolysis of Nickel(II) Complexes with N-Heterocyclic Carbene Ligands / V. Astakhov, O. V. Khazipov, E. S. Degtyareva et al. // Organometallics 2015, 34, 5759−5766
- Starikova O. V. Russ.Synthesis of 1,3-Dialkylimidazolium and 1,3-Dialkylbenzimidazolium Salts / V. Starikova, G. V. Dolgushin, L. I. Larina et al. // J. Org. Chem. 2003, 39, 1467−1470.
Список литературы на английском языке / References in English
- Taccardi N. Gallium-rich Pd–Ga phases as supported liquid metal catalysts / Taccardi, M. Grabau, J. Debuschewitz et al. // Nature Chemistry. 2017. DOI: 10.1038/nchem.2822.
- Afanasyev V.V. Perspektivy ispol'zovanija palladij-kataliziruemyh reakcij v tonkom organicheskom sinteze: sozdanie svjazi uglerod-uglerod [Prospects for the use of palladium-catalyzed reactions in fine organic synthesis: the creation of a carbon-carbon bond] / V.V. Afanasief, N.B. Bespalova, I.P. Beletskaya // Russian Chemical. Zh. (Zh. Russian Chemical. Ob-va im. Mendeleev), 2006, 81-93 [in Russian]
- O'Brien C. J. Easily Prepared Air‐ and Moisture‐Stable Pd–NHC (NHC=N‐Heterocyclic Carbene) Complexes: A Reliable, User‐Friendly, Highly Active Palladium Precatalyst for the Suzuki–Miyaura Reaction / C. J. O'Brien, E. A. Kantchev, C. Valente et al. // Chemistry – A European Journal- 2006- 12: 4743-4748. DOI: 10.1002/chem.200600251
- Dunbar K. L. Enzymatic Carbon–Sulfur Bond Formation in Natural Product Biosynthesis / K. L. Dunbar, D. H. Scharf; A. Litomska et al. // Chemical Reviews 2017, 117, p. 5521. DOI: 1021/acs.chemrev.6b00697
- Hopkinson M. N. An overview of N-heterocyclic carbenes / M. N. Hopkinson, C. Richter, M. Schedler et al. // Nature 2014, 510, p. 485.
- Ziqin S. Synthesis method of aripiprazole / S. Ziqin, X. Fubiao, J. Ersheng ; Patent CN105085394 (A)- Nov 25- 2015
- Hohloch S. Structural Characterization, Solution Dynamics, and Reactivity of Palladium Complexes with Benzimidazolin‐ 2‐ylidene N‐Heterocyclic Carbene Ligands / Hohloch, N. Deibel, D. Schweinfurth et al. // Eur. J. Inorg. Chem., 2014: 2131-2139. DOI: 10.1002/ejic.201301339
- Er J. A. Synthesis and Study of 5,5′‐Bibenzimidazolylidenes and Their Bimetallic Complexes / J. A. Er, A. G. Tennyson, J. W. Kamplain et al. // Eur. J. Inorg. Chem., 2009: 1729-1738. DOI: 10.1002/ejic.200801188
- Khazipov O. V. Fast and Slow Release of Catalytically Active Species in Metal/NHC Systems Induced by Aliphatic Amines / V. Khazipov, M. A. Shevchenko, A. Yu. Chernenko et al. // Organometallics201837 (9), 1483-1492 DOI: 10.1021/acs.organomet.8b00124.
- Chernyshev V. M. Revealing the unusual role of bases in activation/deactivation of catalytic systems: O-NHC coupling in M/NHC catalysis / V. M. Chernyshev, O. V. Khazipov, M.A. Shevchenko et al. // Sci., 2018, DOI: 10.1039/C8SC01353E
- Astakhov A. V. Facile Hydrolysis of Nickel(II) Complexes with N-Heterocyclic Carbene Ligands / V. Astakhov, O. V. Khazipov, E. S. Degtyareva et al. // Organometallics 2015, 34, 5759−5766
- Starikova O. V. Russ.Synthesis of 1,3-Dialkylimidazolium and 1,3-Dialkylbenzimidazolium Salts / V. Starikova, G. V. Dolgushin, L. I. Larina et al. // J. Org. Chem. 2003, 39, 1467−1470.
