APPLICATION OF TYPE-2 CYCLOOXYGENASE INHIBITORS IN AN EXPERIMENTAL ISCHAEMIA-REPERFUSION MODEL
APPLICATION OF TYPE-2 CYCLOOXYGENASE INHIBITORS IN AN EXPERIMENTAL ISCHAEMIA-REPERFUSION MODEL
Abstract
In the present work, we studied the effects of tenoxicam, a non-steroidal anti-inflammatory drug (NSAID) and an inhibitor of cyclooxygenase-2 activity, on brain damage induced by an experimental model of ischaemia-reperfusion in rats. Tenoxicam application decreased myeloperoxidase (MPO) activity to control levels, so in group 3 MPO level was 0.037 ± 0.001 units, which was statistically significantly lower compared to group 2 by 80.3%, (p<0.001). Our results showed that 24 hours after reperfusion, there is a significant increase in MPO activity. Reversal of this increase in groups 3 and 4 decreased MPO activity to control levels, supporting the hypothesis that inflammation is closely related to ischaemic injury.
1. Введение
Проблема лечения последствий ишемии головного мозга остается актуальной и сегодня. Продукты распада циклооксигеназы (ЦОГ) участвуют в механизмах, посредством которых постишемическое воспаление способствует повреждению мозга
, . Недавние данные показали, что продукты распады ЦОГ-2 и активные формы кислорода при экспериментальной церебральной ишемии усугубляют каскад ишемического повреждения , а индуцируемая изоформа ЦОГ-2 способна инициировать повреждение нейронов (в свою очередь, введение ингибиторов ЦОГ-2 уменьшает объем инфаркта при экспериментальной ишемии). Вазоактивные вещества, такие как арахидоновая кислота и тромбоксан А2, активируются рециркулирующими тромбоцитами, которые могут вторично инициировать повреждение эндотелиальных клеток , . Основной интерес к механизмам вторичного повреждения мозга после реперфузии заключается в том, что этот период является потенциальным терапевтическим окном. Доступный и эффективный метод лечения острого ишемического инсульта в настоящее время – тромболизис, может вызвать дальнейшее повреждение тканей посредством механизмов, вовлеченных в реперфузионное повреждение, которые частично или полностью устраняют преимущества самой реперфузии. Недавнее исследование показало, что в зависимый от ЦОГ-2 компонент повреждения, опосредованный, NMDA-рецепторами напрямую вовлекаются простагландины, активированные продуктами распада ЦОГ-2, а не радикалы , данная теория свидетельствует в пользу применения ингибиторов ЦОГ-2 при лечении неврологических заболеваний, связанных с нейротоксичностью. В настоящей работе мы исследовали эффекты теноксикама, нестероидного противовоспалительного средства (НПВС) и ингибитора активности ЦОГ-2, на повреждение мозга, вызванное экспериментальной моделью ишемии-реперфузии у крыс.2. Методы и принципы исследования
В эксперименте участвовали 40 животных (нелинейные белые крысы массой 220-305 г.). Все манипуляции с животными проводились в соответствии с Руководством по содержанию и использованию лабораторных животных
. Животным выполнен наркоз, включающий интраперитонеальное (и/п) введение препаратов: «Ксилазин» (0,5 мг/кг массы тела) и «Золетил 100» (8мг/кг массы тела). Животные были разделены на 4 группы: 1-ая группа (n=10) – ложнооперированные животные, оперативное пособие заключалось в обеспечении доступа к средней мозговой артерии (СМА), при этом окклюзия СМА не производилась, послеоперационная рана накрывалась стерильной салфеткой, и через 45 минут, ушивалась. 2-ая группа (n=10) – инсульт (окклюзия СМА); животным выполнялась 45-минутная окклюзия СМА по методике J. Koizumi (1986), оперативное пособие включающее окклюзию СМА на 45 минут , , с последующей реперфузией; эта процедура также проводилось в группах 3 и 4. 3-ья группа (n=10) – инсульт (окклюзия СМА) + теноксикам (2,5 мг/кг массы тела), данный препарат вводился в период реперфузии, через 45 минут от начала эксперимента. 4-я группа (n=10) – инсульт (окклюзия СМА) + теноксикам (10 мг/кг массы тела), данный препарат вводился в период реперфузии через 45 минут от начала эксперимента. Таблетки «Теноксикам» (ПРОМОМЕД РУС), предварительно таблетки измельчались до порошка, и необходимую дозу, в зависимости от веса животных разводили в растворе NaCl 0,9%-2мл и вводили и\п. Через 24 часа с момента реперфузии крыс декапитировали, мозг препарировали и удаляли гиппокамп для биохимических измерений. Проводили измерение активности миелопероксидазы (МПО), по методике, описанной Д. В. Григорьевой (2016) . Для гистологической оценки мозг фиксировали в 10% растворе формалина, проводили через спиртовую серию, ткани заливали в парафин, микротомом делали срезы и окрашивали гематоксилином и эозином, и тионином по Нисслю, делали микрофотографии, отцифровывали их и оценивали изменения. Для статистической обработки был применен t-критерия Стьюдента и критерий Манна-Уитни. Результаты представлены следующим образом, М ± m (М – среднее, m – ошибка среднего). Данные принимались за статистически значимые при р<0,01 .3. Основные результаты и их обсуждение
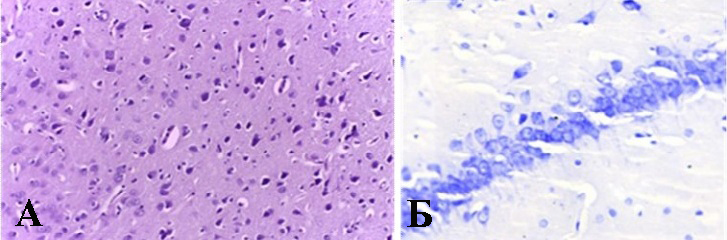
Рисунок 1 - Пример гистологического препарата головного мозга крысы из группы №2:
А - лобная доля, окраска гематоксилин+эозин, X 400; Б – СА1 область гиппокампа, окраска тионином по Нисслю, X 400
4. Заключение
Наши результаты показали, что через 24 часа после реперфузии происходит значимое повышение активности МПО. Реверсия этого повышения в группах 3 и 4 снизило активность МПО до контрольных уровней, что подтверждает гипотезу о том, что воспаление тесно связано с ишемическим повреждением. Теноксикам – тиенотиазиновое производное оксикама, ингибирует активность ЦОГ и блокирует образование продуктов распада арахидоновой кислоты (АК), косвенно снижая инфильтрацию нейтрофилов и, следовательно, влияет на ослабление продукции активных форм кислорода, фактора активации тромбоцитов, подавляет синтез простагландинов, цитокинов, хемокинов и лизосомальных ферментов, и уменьшает содержание активных радикалов в очаге воспаления. В целом полученные нами данные показывают, что ишемия мозга, безусловно, связана с воспалением и повышенным образованием свободных радикалов, и применение теноксикама с целью ингибирования ЦОГ, подавления синтеза простагландинов в условиях ишемии/реперфузии целеообразно, но требуется дальнейшее проведение исследований.
