Selective removal of activated neutrophils from the systemic bloodstream during polymyxin sorption in septic patients: a prospective cohort study
Selective removal of activated neutrophils from the systemic bloodstream during polymyxin sorption in septic patients: a prospective cohort study
Abstract
Neutrophils (NP) play a special role in the development of the infectious process. Excessive activity of neutrophils in the systemic bloodstream, mismatched activation and their location within the microcirculatory channel plays an important role in the initiation of multi-organ failure. Levelling the interaction of activated neutrophils with the vascular wall can be a promising direction of therapeutic search in the treatment of sepsis, including the use of extracorporeal techniques.
Research objective: To evaluate the selectivity of the effects of polymyxin sorption against activated neutrophils in septic patients.
Polymyxin sorption was included in the treatment of 12 patients undergoing extensive surgical interventions for malignant neoplasms, the course of the postoperative period of which was complicated by the development of sepsis. Diagnosis of sepsis was carried out according to SEPSIS-3 criteria. The components of lipid peroxidation in NP were studied: diene conjugates, malonic dialdehyde and antioxidant system: superoxide dismutase, total peroxidase activity, glutathione peroxidase and reduced glutathione. Research points – before, 30 minutes after sorption, in wash waters after cartridge washing at the end of haemoperfusion. Fixation of NP on polymyxin fibres of the cartridge was evaluated by microscopic examination with staining of preparations with haematoxylin-eosin at a magnification of 600 times. Statistical processing of data was performed using Statistica 10 software.
In morphological study, numerous neutrophils were registered on the cartridge fibres. It was found that the cells subjected to sorption were represented by their most active subpopulation. The cells in samples from washing water were characterized by a much more pronounced imbalance in the activity of lipid peroxidation processes and reduction of protective reactions on the part of antioxidant systems relative to NP in blood samples before and after sorption. Especially pronounced was the imbalance between 2.2-fold increase in the concentration of primary products of lipid peroxidation, 1.4-fold increase in the concentration of malonic dialdehyde and 2.5-fold decrease in the activity of superoxide dismutase. The ratio of superoxide dismutase activity to total peroxidase activity was reduced to 5.3 versus 22.7 in blood NP before sorption.
Conclusions: Carrying out polymyxin sorption in sepsis patients provides productivity of selective removal of the pool of the most activated neutrophils from the systemic bloodstream, which makes a certain contribution to the organoprotective effect of sorption treatment.
1. Введение
В соответствии с современными представлениями, сформулированными в результате работы 3-й консенсусной целевой рабочей группы экспертов Society of Critical Care Medicine и European Society of Intensive Care Medicine (Sepsis-3), сепсис определяется как тяжелый клинический синдром с угрожающей жизни органной дисфункцией, причиной которой является дисрегуляторный ответ организма на инфекцию. Дисбаланс реакции иммунной системы, утрачивающей в этом случае защитные функции, может в итоге приводить к повреждению органов и тканей . По объединенным данным экспертов Питтсбургского и Вашингтонского университетов сепсис ежегодно диагностируется у 48,9 млн человек и является причиной смерти 11,0 млн больных, что составляет 19,7% всех случаев смерти в мире , .
На клеточном уровне сепсис – это непрерывно развивающийся патологический процесс, сопровождающийся нарушениями гомеостаза, как следствие неконтролируемого каскада изменений, одновременно происходящих в системах воспаления, коагуляции и фибринолиза. Это цикл автоматического наложения взаимообусловленных процессов с нарушениями микроциркуляции, тканевой оксигенации, развитием метаболических расстройств и митохондриальной дисфункции. В результате уникальной комбинации клеточных, метаболических, сосудистых и воспалительных нарушений формируются органные дисфункции с исходом в полиорганную недостаточность .
Нейтрофилы (НФ) играют особую роль в развитии инфекционного процесса. Их защитная роль связана с наличием большого количества протеолитических ферментов, быстрой продукцией медиаторов воспаления и активных форм кислорода в очаге воспаления. Активация НФ в системном кровотоке инициирует развитие системной воспалительной реакции. Это сопровождается секвестрацией НФ в микроциркуляторном ложе, связыванием со стенкой кровеносных сосудов, высвобождением протеолитических ферментов, чрезмерной и неконтролируемой продукцией медиаторов воспаления с последующим повреждением эндотелиальных клеток, повышением проницаемости сосудов, развитием диссеминированной внутрисосудистой коагуляции, тканевой гипоперфузии, гипоксии, нарушением тканевого метаболизма путем ингибирования митохондриальных ферментов . Неблагоприятная чрезмерная активность нейтрофилов в системном кровотоке, несоответствующая активация и размещение их в пределах микроциркуляторного русла может быть ключевой стадией в инициации полиорганных нарушений , , , . Таким образом, возможно, нивелирование взаимодействия активированных НФ с сосудистой стенкой является перспективным направлением терапевтического поиска в лечении сепсиса, в том числе, с применением экстракорпоральных методик.
В последние десятилетия при лечении сепсиса применяют селективную гемосорбцию липополисахарида, являющегося одной из ключевых сигнальных молекул в патогенезе сепсиса, с использованием картриджа с иммобилизованным полимиксином В (полимиксиновая сорбция, polymyxin sorption – PMX). Вместе с тем в литературе имеются сообщения об избирательной сорбции при проведении PMX активированных нейтрофилов , , , в том числе посредством механизмов, в котором не участвуют липополисахарид и цитокины , .
Представленные выше данные позволяют предположить, что терапевтическое воздействие PMX при сепсисе помимо удаления эндотоксина включает и другие механизмы, в частности, специфическую сорбцию активированных нейтрофилов, что и определило цель настоящего исследования.
Оценить избирательность воздействия полимиксиновой сорбции в отношении активированных нейтрофилов у больных сепсисом.
2. Материал и методы
Все больные, включенные в исследование, дали добровольное информированное согласие на проведение экстракорпорального лечения, а также на участие в научном исследовании и публикацию полученных результатов. Критерии включения: возраст старше 18 лет; клинико-лабораторные критерии сепсиса в условиях хирургической санации очага инфекции; SOFA (sequential organ failure assessment) – > 2 баллов, прокальцитонин (РСТ) – > 2 нг/мл, при активности эндотоксина по ЕАА-тесту (endotoxin activity assay) < 0,5 у.е. Критерии невключения: возраст младше 18 лет; SOFA < 2 баллов, РСТ – < 2 нг/мл, ЕАА-тест > 0,5 у.е. PMX была включена в комплекс интенсивного лечения 12 больным (7 мужчин и 5 женщин) в возрасте от 52 до 74 лет, подвергнутым обширным хирургическим вмешательствам по поводу злокачественных новообразований билиопанкреатодуоденальной области – 4 человека (33%); торакоабдоминальной (пищевод, легкое, бронхи) – 6 человек (50%); почек и забрюшинного пространства – 2 человека (17%), течение послеоперационного периода у которых осложнилось развитием сепсиса.
Диагностику сепсиса проводили в соответствии с консенсусными критериями «The Third International Consensus definitions for sepsis and septic shock (Sepsis-3) . Тяжесть органных дисфункций по шкале SOFA составляла более 7 баллов (7; 18). По данным лабораторных исследований концентрация интерлейкина-6 в сыворотке крови составляла более 600 пг/мл (680; 1700), РСТ – более 10 нг/мл (11; 56). В целях изучения способности PMX к липополисахарид-независимой сорбции активированных нейтрофилов в исследование включены случаи её применения у больных только при клинически незначимых уровнях активности эндотоксина, определяемых по результатам ЕАА-теста – менее 0,5 у.е. (0,3; 0,5).
Гемоперфузию проводили на аппарате Plazauto Sigma с использованием картриджа ToraymyxinPMX-20 R со скоростью перфузии 150 мл/мин в течение 4-6 часов. Антикоагуляция – нефракционированный гепарин: наполнение 2 тыс. Ед на 500 мл 0,9% раствора натрия хлорида, болюс – 3 тыс. Ед, поддержание – 20 Ед/кг массы тела/час с коррекцией дозы с учетом активированного времени свертывания 150-180 сек. Уровень тромбоцитов крови во всех описываемых случаях был более 40х109/л.
Во время проведения полимиксиновой сорбции изучали функциональное состояние нейтрофилов в образцах крови, полученных из системного кровотока до входа в картридж PMX, через 30 минут после завершения PMX, а также определяли наличие и функциональные свойства нейтрофилов в промывных водах после завершения гемоперфузии и отмывания картриджа. В целях подтверждения фиксации нейтрофилов на полимиксиновых волокнах картриджа проводили их микроскопическое исследование.
Функциональное состояние нейтрофилов в образцах крови и промывных водах оценивали путем определения показателей внутриклеточных компонентов перекисного окисления липидов: диеновых конъюгатов (ДК), малонового диальдегида (МДА) и ферментативного звена антиоксидантной системы: супероксиддисмутазы (СОД), суммарной пероксидазной активности (СПА), активности глутатионпероксидазы (ГПО) и содержания восстановленного глутатиона (GSH). Для выделения нейтрофилов образцы крови и промывных вод наслаивали на два градиента плотности фиколл-урографина с р-1,077 г/см3 и р-1,119г/см3. После центрифугирования получали кольца лимфоцитов (верхнее) и нейтрофилов (нижнее). Полученные кольца НФ отбирали в чистые центрифужные пробирки и дважды отмывали раствором натрия хлорида 0,9%, центрифугируя по 20 минут при 1500 об/мин. Надосадок сливали, осадок ресуспендировали в 1 мл натрия хлорида 0,9%. Количество клеток подсчитывали в камере Горяева c последующим определением внутриклеточных продуктов перекисного окисления липидов по стандартным методикам . Содержание ДК изучали при длине волны 233 нм на микропланшетном автоматическом анализаторе INFINITE M NANO (Tecan Austria GmbH, Австрия), содержание МДА – методом с тиобарбитуровой кислотой при длине волны 535 нм на двулучевом спектрофотометре U-2900 с программным обеспечением UV Solutions (Hitachi, Япония). Активность СОД определяли по степени ингибирования восстановления нитросинего тетразолия в присутствии супероксидного радикала, генерируемого в реакции восстановления молекулярного кислорода адреналином в щелочной среде при длине волны 540 нм, на спектрофотометре APEL PD-303 UV (Япония). СПА исследовали при длине волны 602 нм по образованию окрашенных продуктов при окислении бензидина перекисью водорода, образуемой в реакции, катализируемой белками с пероксидазной активностью, на спектрофотометре U-2900 (Hitachi, Япония). Активность ГПО определяли при длине волны 412 нм в реакции расщепления гидроперекиси третичного бутила, используя в качестве субстрата восстановленный глутатион; содержание восстановленного глутатиона определяли по реакции с 5,5-дитиобис(2-нитробензойной кислотой) при 412 нм, на спектрофотометре U-2900 (Hitachi, Япония). Были использованы реактивы 96-99% чистоты фирм “Sigma-Aldrich” (США), “AppliChem” (Германия), “Fluka” (США). В качестве нормальных величин были приняты значения, полученные у 10 обследованных относительно здоровых людей (5 мужчин и 5 женщин) в возрасте от 48 до 74 лет (60,9±2,8).
После окончания сорбции картридж отмывали холодным 0,9% раствором натрия хлорида в объеме до 2 л со скоростью 150 мл/мин до чистых вод. Затем на фоне встряхивания колонки и создания сопротивления на выходе забирали пробы промывных вод для исследования клеточного состава и внутриклеточного статуса окислительно-восстановительных процессов в выделенных нейтрофилах. Далее производили вскрытие картриджа путем его распиливания и выделения участков с иммобилизованными волокнами полимиксина В с последующим изготовлением микропрепаратов. Образец проводили по методике изготовления гистологических срезов по общепринятой методике. Фиксировали в 10% растворе нейтрального забуференного формалина в течение 24 часов. Обезвоживание осуществляли в растворах этанолового спирта восходящей концентрации в течение 12 часов в гистопроцессоре Leica ASP 200. Затем проводили заливку в парафин. Парафиновые срезы депарафинировали и в дальнейшем окрашивали гематоксилином и эозином стандартным способом. Оценивали результаты на уровне световой микроскопии.
3.1. Cтатистический анализ
Результаты исследования были обработаны при помощи программы Statistica 10 по критерию Стьюдента для двух независимых выборок и непараметрическому критерию Вилкоксона-Манна-Уитни. Анализ индивидуальной направленности изменений проводили методом парных сравнений. Различия считали статистически значимыми при p<0,05. Проверку выборок на соответствие нормальному распределению проводили по критерию Колмогорова-Смирнова и W-критерию Шапиро-Уилка. Поскольку в большинстве случаев распределение было близко к нормальному, результаты представлены в виде М ± m, где М – выборочное среднее, m – ошибка среднего. Медиана (Me) во всех группах практически не отличалась от M, а интерквартильный разброс приведен в виде подсчета нижнего и верхнего квартилей: (Q25 и Q75).
3. Результаты исследования
При морфологическом исследовании волокон картриджа с иммобилизованным полимиксином В выявили большое количество клеточных элементов, которые были представлены нейтрофилами (Рис.1). Все клетки имели типичную для незрелых (палочкоядерных) нейтрофилов форму ядра (неправильное подковообразное). Зачастую ядро клетки было сильно фрагментированным, что характерно для «стареющих» форм, не подверженных апоптозу. В некоторых микропрепаратах присутствовали единичные лимфоциты. Других клеток крови не регистрировали. Морфологическая картина во всех 12 случаях была идентична.
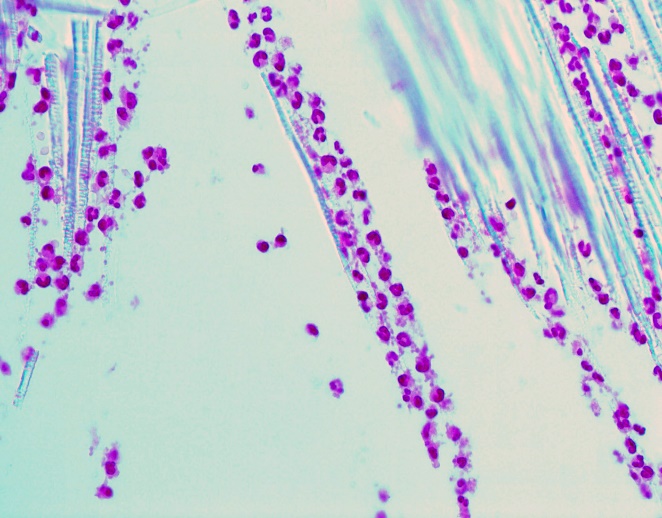
Рисунок 1 - Морфологическое исследование волокон картриджа с иммобилизованным полимиксином В
Примечание: окраска гематоксилином-эозином, увеличение х600
Таблица 1 - Показатели компонентов перекисного окисления липидов и ферментативного звена антиоксидантной защиты в нейтрофилах крови до, через 30 минут после завершения PMX и в промывных водах после отмывания PMX-картриджа
Показатели, ед. изм-я | Здоровые люди (n=10) | До PMX (n=12) | Через 30 минут после PMX (n=12) | В промывных водах (n=12) |
ДК, мкмоль/мл суспензии | 1,381±0,153 1,385 [1,24;1,8] | 2,783±0,464 2,31 [1,93; 3,88] р1=0,010165 | 1,347±0,169 1,305 [1,02; 1,48] р1>0,1 рпар.=0,009785 | 6,108±0,58 6,36 [4,76; 7,43] р1=0,000000 р2=0,000292 р3=0,000000 |
МДА, нмоль/мл суспензии | 1,899±0,166 1,855 [1,54;2,43] | 2,76±0,321 2,42 [2,05; 3,58] р1=0,028659 | 1,901±0,289 1,665 [1,15; 2,82] р1>0,1 рпар.=0,011934 | 3,956±0,581 3,71 [2,18; 5,12] р1=0,003175 р2=0,088588 р3=0,005365 |
СОД, ед.акт./мг белка | 3,749±0,301 3,525[3,28;3,83] | 4,384±0,382 4,552[3,41;5,56] | 5,294±0,468 5,743 [4,29; 6,31] р1=0,012428 рпар.=0,010954 | 1,773±0,151 1,773 [1,47; 2,07] р1=0,000028 р2=0,000012 р3=0,000003 |
СПА, ед.акт./мг белка | 0,152±0,016 0,155[0,11;0,19] | 0,193±0,023 0,205[0,13;0,25] | 0,266±0,029 0,26 [0,19; 0,33] р1=0,003218 рпар.=0,011054 | 0,334±0,027 0,31 [0,26; 0,40] р1=0,000020 р2=0,001041 |
GSH, мкмоль/мг белка | 35,04±2,13 33,47 [30,76; 39,33] | 24,62±2,95 24,69 [16,96; 27,79] р1=0,010244 | 33,97±2,63 30,7 [26,65;43,93] рпар.=0,003083 | 24,4±3,28 18,99[16,68;33,45] р1=0,014027 р3=0,035142 |
ГПО, МЕ/мг белка | 133,1±14,6 123,5 [92,99; 167,2] | 131,5±17,8 105,9 [83,77; 194,2] | 83,73±15,98 78,74 [34,96;136,06] р1=0,034880 рпар.>0,1 | 61,95±13,93 60,15[19,61;82,48] р1=0,002399 р2=0,065080
|
Примечание: р1 – по отношению к здоровым людям (T-Test для независимых данных); рпар – между до и после PMX (T-Test для зависимых данных); р2 и р3 – в промывных водах по отношению к показателям в крови до и после PMX (T-Test для независимых данных)
Аббревиатуры: ДК – диеновые конъюгаты, МДА – малоновый диальдегид, СОД – супероксиддисмутаза, СПА – суммарная пероксидазная активность, GSH – содержание восстановленного глутатиона, ГПО – глутатионпероксидаза.
Анализ результатов исследования показал, что в образцах крови до входа в картридж PMX содержание компонентов перекисного оксисления липидов в НФ было существенно выше, чем у здоровых людей: содержание ДК было выше в 2 раза (p=0,01), концентрация МДА — в 1,5 раза (p=0,03). При этом наблюдали неадекватный ответ со стороны ферментов первой линии антиоксидантной защиты и глутитионовой системы, который характеризовался отсутствием роста активации СОД и СПА, а также снижением содержания глутатиона в 1,4 раза (p=0,01). При этом активность ГПО, как основного глутатионзависимого антиоксидантного фермента, статистически значимых отличий от нормальных значений не имела.
При исследовании промывных вод выявили присутствие в них НФ, в некоторых образцах встречались единичные лимфоциты, наличие других клеток крови не фиксировали. При биохимическом исследовании функционального состояния в выделенных НФ отмечали более высокую активность процессов гиперпероксидации относительно исхода. Содержание обоих продуктов перекисного окисления липидов превышало результаты, полученные в пробах крови: уровень ДК был выше в 2,2 раза (p=0,000), а концентрация МДА — на уровне тенденции к значимости в 1,4 раза (p=0,089). При этом активность СОД в НФ промывных вод была ниже, чем в крови, в 2,5 раза (p=0,000), но СПА, напротив, выше в 1,7 раза (p=0,001). Статистически значимых изменений показателей глутатионовой системы не выявили.
В пробах крови через 30 минут после завершения гемоперфузии регистрировали нормализацию показателей перекисного оксисления липидов в НФ. Этот было связано с более низкими значениями ДК и МДА по сравнению с образцами крови до начала PMX: в 2,1 и в 1,5 раза соответственно (p=0,01). При этом активность СОД и СПА была выше в 1,2 и 1,4 раза соответственно (p=0,01), существенно превышая, в том числе, и нормальные значения. При парном сравнении активности ГПО значимых отличий не было, а содержание GSH превышало показатели по сравнению с образцами крови до входа в картридж PMX в 1,4 раза (p=0,003).
4. Обсуждение
Полученные данные морфологического исследования свидетельствуют об избирательной фиксации незрелых форм нейтрофилов на волокнах картриджа с иммобилизованным полимиксином В. Известно, что нейтрофилы, в том числе циркулирующие в системном кровотоке, функционально не являются гомогенными. Они состоят из субпопуляций с определенными фенотипическими и секреторными параметрами и существуют в трех состояниях: покой, возбуждение и активация. Следует отметить, что только пул активированных НФ предрасположен к эндотелиальному взаимодействию, инициирующему развитие эндотелиальной дисфункции.
Нами впервые было проведено исследование функциональных свойств экстракорпорально удалаемых нейтрофилов при проведении РMX, результаты которого указывают на специфичность воздействия полимиксиновой сорбции именно в отношении активированных НФ. Так, для клеток, «выдавленных» с волокон картриджа (промывные воды), был характерен значительно более выраженный дисбаланс активности процессов пероксидации липидов и снижения защитных реакций со стороны антиоксидантных систем по сравнению с нейтрофилами в пробах крови из системного кровотока, полученных перед входом в картридж PMX. Особенно выраженным оказался дисбаланс между 2,2-кратным увеличением концентрации первичных продуктов перекисного оксисления липидов, 1,4-кратным повышением концентрации МДА и 2,5-кратным снижением активности СОД. Это сопровождалось нарушением соотношения между активностью сопряженных ферментов первой линии антиоксидантной защиты. Наблюдали снижение коэффициента отношения СОД/СПА до 5,3 тогда как в нейтрофилах в пробах крови этот коэффициент составлял 22,7.
Нейтрофилы крови через 30 минут после завершения полимиксиновой сорбции отличало более стабильное и сбалансированное течение окислительно-восстановительных реакций как по сравнению с клетками, фиксируемыми на волокнах картриджа с иммобилизованным полимиксином В, так и в сравнении с НФ крови до PMX, на что указывала нормализация внутриклеточной интенсивности процессов гиперпероксидации липидов и содержания восстановленного глутатиона.
Результаты представленного исследования отчетливо демонстрируют продуктивность избирательного удаления из системного кровотока больных сепсисом пула нейтрофилов, активация которых играет ключевую роль в инициации эндотелиальной дисфункции с последующим развитием органных и системных повреждений (Рис. 2).
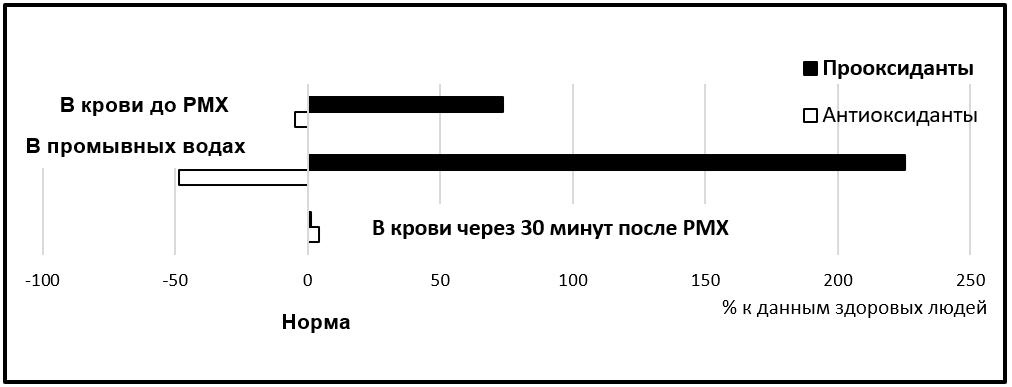
Рисунок 2 - Схема внутриклеточного баланса прооксиданты/антиоксиданты в нейтрофилах в исследуемых пробах исследования
Выявленные нами отличия в характере течения процессов перекисного окисления липидов в НФ крови и промывных водах на фоне проведения PMX позволяют предположить сродство клеточной мембраны активированных нейтрофилов к полимиксину В, аналогично тому, как липид А липополисахарида связывается с полимиксином В, поскольку интенсивность внутриклеточной активации процессов пероксидации при истощении факторов антиоксидантной защиты неизбежно приводит к изменению структуры и разрыхлению липидного слоя клеточной мембраны, изменению ее проницаемости, потенциала, и, соответственно, заряда.
5. Заключение
Полученные данные расширяют представление о механизмах положительного влияния PMX на характер течения септического процесса. Можно предположить, что продуктивность экстракорпорального удаления активированных нейтрофилов из системного кровотока может уменьшить выраженность системной воспалительной реакции и вносит определенный вклад в органопротективное воздействие сорбционного лечения у больных сепсисом.
