Determination of thermodynamic characteristics of nickel alloys with tellurium
Determination of thermodynamic characteristics of nickel alloys with tellurium
Abstract
The aim of the present work was to determine the thermodynamic characteristics of tellurium-nickel alloys in order to predict the effect of tellurium on the corrosion resistance of nickel alloys in molten salts. The choice of the Ni-Te system is due to the fact that nickel is the main component of structural materials for liquid salt reactors, and tellurium is a fission product that accumulates in fuel salt and affects intergranular corrosion processes in nickel alloys. To determine the thermodynamic properties of the Ni-Te system, the EDS method was used, based on determining the potential difference between nickel and nickel-tellurium alloys of various compositions. The experimental data obtained were compared with the phase diagram of the Ni-Te system, and based on the analysis, the thermodynamic characteristics of the compounds formed were calculated. In a special series of experiments performed using chronopotentiometry and cathodic polarisation curve recording methods, characteristic potentials were determined, which made it possible to calculate the activities of nickel in alloys and the corresponding formation energies over a wide temperature range.
1. Введение
Эффективное развитие атомной энергетики связано с важнейшей задачей замыкания ядерного топливного цикла (ЯТЦ), предусматривающего переработку отработавшего ядерного топлива, выделение неизрасходованных и вновь образовавшихся делящихся материалов, подготовку радиоактивных отходов к длительному хранению или окончательному захоронению. С целью реализации подхода радиационно-эквивалентного захоронения отходов необходимо трансмутировать долгоживущие радионуклиды в короткоживущие или стабильные. Одним из подходов к решению этой задачи является создание жидкосолевого реактора (ЖСР), который позволит «дожигать» (трансмутировать) долгоживущие нуклиды, включая изотопы минорных актинидов .
В качестве топлива и теплоносителя в ЖСР используют расплавленные соли, что позволяет достигать высоких температур при одновременно низком давлении паров, что повышает безопасность и надежность работы ЖСР. Одним из вариантов основы топливной композиции являются расплавленные смеси галогенидов щелочных металлов, которые обладают относительно низкой вязкостью и высокой и теплоемкостью. Однако расплавы фторидов щелочных металлов, особенно содержащие фториды актинидов, проявляют повышенную коррозионную активность по отношению к конструкционным материалам, что, в свою очередь, усложняет эксплуатацию ЖСР.
Помимо коррозионной активности стартовой топливной соли, процессы коррозии интенсифицируются за счет накопления продуктов деления, которые образуются в процессе работы ЖСР. Одним из таких продуктов является теллур, который способен взаимодействовать с конструкционными материалами . Проведенные ранее исследования показали, что никелевые сплавы демонстрируют удовлетворительную коррозионную стойкость в расплавах хлоридов и фторидов щелочных металлов , , однако в присутствии теллура коррозия интенсифицируется, наблюдается изменение структуры сплавов и снижение их прочности , , . В результате диффузии теллура из топливной соли в сплав происходит образование теллурсодержащих интерметаллических соединений на границах зерен , следствием чего является межкристаллитное растрескивание сплава, ухудшающее прочностные характеристики материалов.
Для анализа механизма коррозионных процессов и возможных последствий теллуровой коррозии необходима информация о термодинамических характеристиках соединений, образуемых теллуром с элементами конструкционных материалов. Поскольку никель является основным компонентом сплавов, используемых в качестве конструкционных материалов в ЖСР, целью настоящей работы являлось определение термодинамических характеристик соединений никеля с теллуром.
2. Материалы и методы исследования
Для определения термодинамических свойств сплавов никеля с теллуром были использованы способы ЭДС, хронопотенциометрии и гальваностатический коммутаторный метод съемки поляризационных кривых. В качестве рабочего электролита для получения термодинамических характеристик сплавов Ni-Te использовали расплав тройной эвтектической смеси 6NaCl–9KCl–5CsCl, в который дополнительно вводили ионы никеля в виде его хлорида.
Для приготовления эвтектической композиции индивидуальные безводные хлориды щелочных металлов (марки ХЧ или ОСЧ) смешивали в нужных пропорциях и помещали в кварцевую ячейку. Затем смесь выдерживали при температуре 100 °C в течение 1,5 ч, после чего постепенно повышали температуру с шагом в 100 °C со временем выдержки на шаге 0,5 часа. В диапазоне температур от 300 до 600 °C сушку солей осуществляли при пониженном давлении. Затем ячейку заполняли аргоном, поднимали температуру до 850 °C и выдерживали до полного расплавления солей, после чего расплав продували хлором и хлористым водородом для удаления остаточных следов влаги, кислорода и органических примесей. Хлор получали электролизом расплава хлорида свинца, а хлористый водород — по реакции плавленого KCl с концентрированной серной кислотой, Расплавленную соль разливали в предварительно прокаленные алундовые тигли, которые охлаждали в эксикаторе под вакуумом.
С целью получения никельсодержащего электролита в полученную соль добавляли безводный хлорид никеля. Смесь соли-растворителя и NiCl2 сплавляли в кварцевой при температуре 650°С при перемешивании расплава посредством барботажа газообразного хлористого водорода. Полноту растворения хлорида никеля контролировали визуально. Подготовленную таким образом солевую смесь перемещали в перчаточный бокс с инертной атмосферой, где хранили до проведения экспериментов. Содержание влаги и кислорода внутри бокса не превышало 10 ppm. Содержание примесей в полученных плавах, а также концентрацию ионов никеля измеряли с помощью рентгенофлуоресцентного анализа (РФА). Данные о содержании основных и примесных компонентов в исходной эвтектической смеси хлоридов натрия, калия и цезия представлены в таблице 1. Начальная концентрация ионов никеля в расплаве хлоридов составляла 2 мас %.
Таблица 1 - Содержание основных и примесных компонентов в исходной эвтектической смеси 6NaCl–9KCl–5CsCl
Элемент | Содержание, мас. % |
Сs | 51,8 |
Cl | 32,1 |
Na | 9,0 |
K | 8,6 |
Fe | 1,8•10-4 |
S | 1,4•10-4 |
Ni | 1,1•10-4 |
Mo | 1,1 •10-4 |
Для изготовления никелевых электродов использовали металлический никель с содержанием основного компонента не менее 99,6 мас. %. С целью синтеза сплавов никель–теллур применяли теллур марки ХЧ. Концентрации основных примесей в теллуре и никеле согласно сертификатам производителей представлены в таблицах 2 и 3.
Таблица 2 - Содержание примесей в исходном теллуре
Элемент | Содержание, мас. % |
Se | 1,59 |
Pb | 0,50 |
Cl | 0,45 |
Cu | 0,31 |
Ag | 0,29 |
S | 0,01 |
Таблица 3 - Содержание примесей в исходном металлическом никеле
Элемент | Содержание, мас. % |
As | ≤0,002 |
Bi | ≤0,002 |
C | ≤0,1 |
Cd | ≤0,002 |
Cu | ≤0,1 |
Fe | ≤0,01 |
Mg | ≤0,1 |
Mn | ≤0,05 |
S | ≤0,005 |
P | ≤0,002 |
Pb | ≤0,002 |
Sb | ≤0,002 |
Si | ≤0,15 |
Sn | ≤0,002 |
Zn | ≤0,007 |
В основе метода ЭДС, использованного в настоящей работе для определения термодинамических характеристик сплавов никеля с теллуром, лежит измерение равновесных потенциалов сплавов относительно электрода сравнения из чистого никеля.
Равновесный потенциал сплава Me-Te в расплаве, содержащем ионы Men+, может быть описан уравнением Нернста:
где,
В том случае, когда металл и сплав находятся в одном и том же расплавленном электролите, концентрация потенциалопределяющих ионов в расплаве будет одинаковой как в приэлектродном слое сплава, так и у поверхности чистого металлического электрода. В этой ситуации разница потенциалов между электродами будет равна:
а изменение свободной энергии Гиббса образования сплава может быть выражено, как
Для определения термодинамических характеристик сплавов и образующихся интерметаллических соединений измеряли разность потенциалов между электродами из никеля и сплавов никеля с теллуром различного состава . Для подтверждения корректности результатов измерений в ряде экспериментов проводили измерение потенциалов относительно стандартного хлорного электрода сравнения (ХЭС). Схема использованной при этом экспериментальной ячейки представлена на рисунке 1.
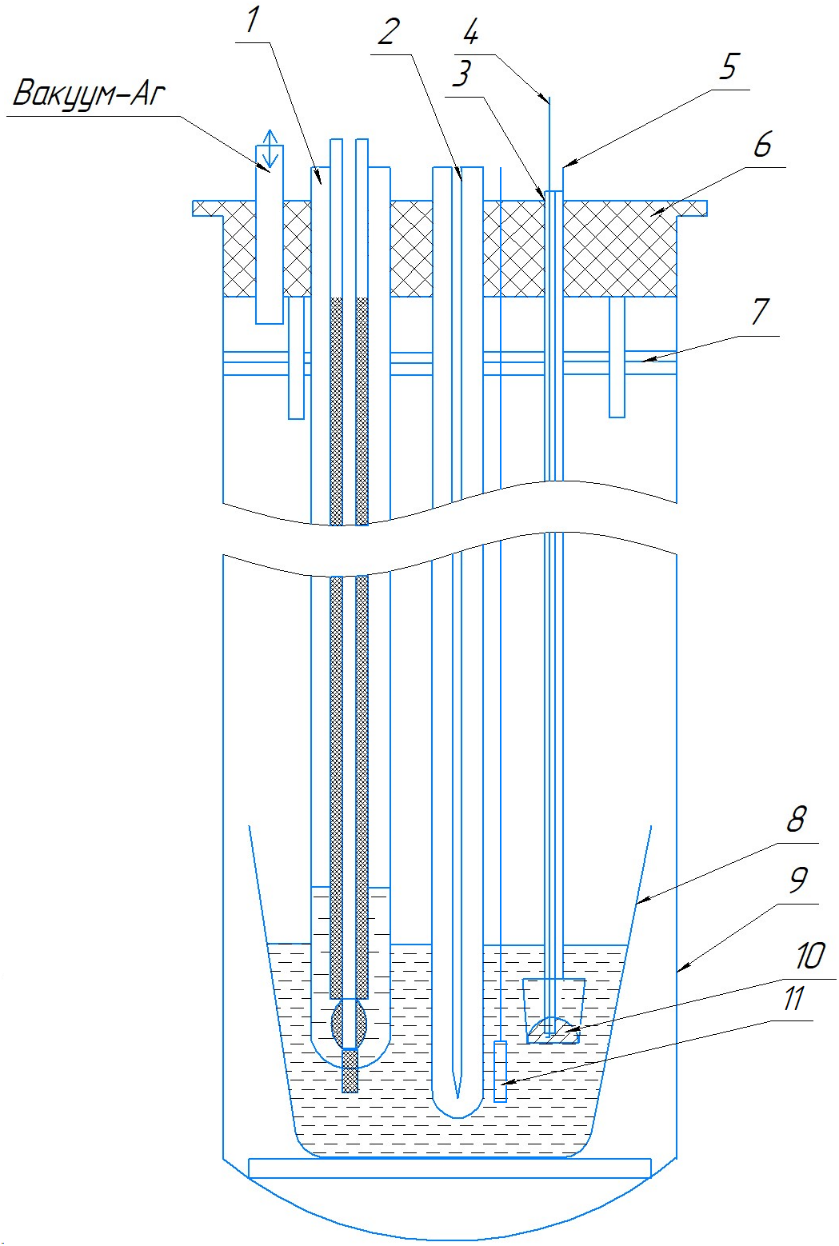
Рисунок 1 - Экспериментальная ячейка для потенциометрических измерений
Примечание: 1 – хлорный электрод сравнения; 2 – термопара в кварцевом чехле; 3 – алундовая соломка; 4 – молибденовый токоподвод к теллуровому электроду; 5 – молибденовая подвеска тигля; 6 – пробка из вакуумной резины; 7 – никелевые экраны; 8 – алундовый тигель с солевым электролитом; 9 – кварцевая ячейка; 10 – теллур в алундовом тигле; 11 – никелевый электрод
При проведении хронопотенциометрических измерений выполняли кратковременное насыщение поверхности теллурового электрода никелем (за счёт электролиза при предельной плотности тока выделения никеля), а затем регистрировали изменение во времени потенциала сплава Ni–Те относительно никелевого электрода. Для этого в экспериментальную ячейку помещали три электрода: расплавленный теллур в отдельном тигле с токоподводом и два никелевых электрода, один из которых служил электродом сравнения, а другой — анодом. Систему выдерживали до стабилизации величины температуры и потенциала теллурового электрода, значение которого брали за реперную точку окончания процесса выдержки сплава. Затем проводили электролитическое выделение никеля на теллуровом катоде при плотности тока, близкой к предельной плотности тока выделения никеля на теллуре. В отдельной серии потенциометрических экспериментов был использован метод прямого нанесения жидкого теллура на никелевый электрод, предусматривающий кратковременное погружение его в жидкий теллур.
После выделения никеля на теллуре в ходе последующей выдержки концентрация никеля в поверхностном слое сплава снижалась за счёт диффузии в объем теллура. При этом состав поверхностного слоя сплава изменялся в соответствии с диаграммой состояния Ni–Те, представленной на рисунке 2, что отражалось на характере регистрируемых кривых «потенциал — время». Полученные зависимости анализировали на предмет наличия перегибов, обусловленных изменением состава сплава в поверхностном слое. По замедлению или ускорению изменения потенциала во времени делали вывод о том, какому участку фазовой диаграммы соответствовало данное изменение, а по характерным точкам, предшествующим этим изменениям, определяли термодинамические характеристики сплавов соответствующего состава.
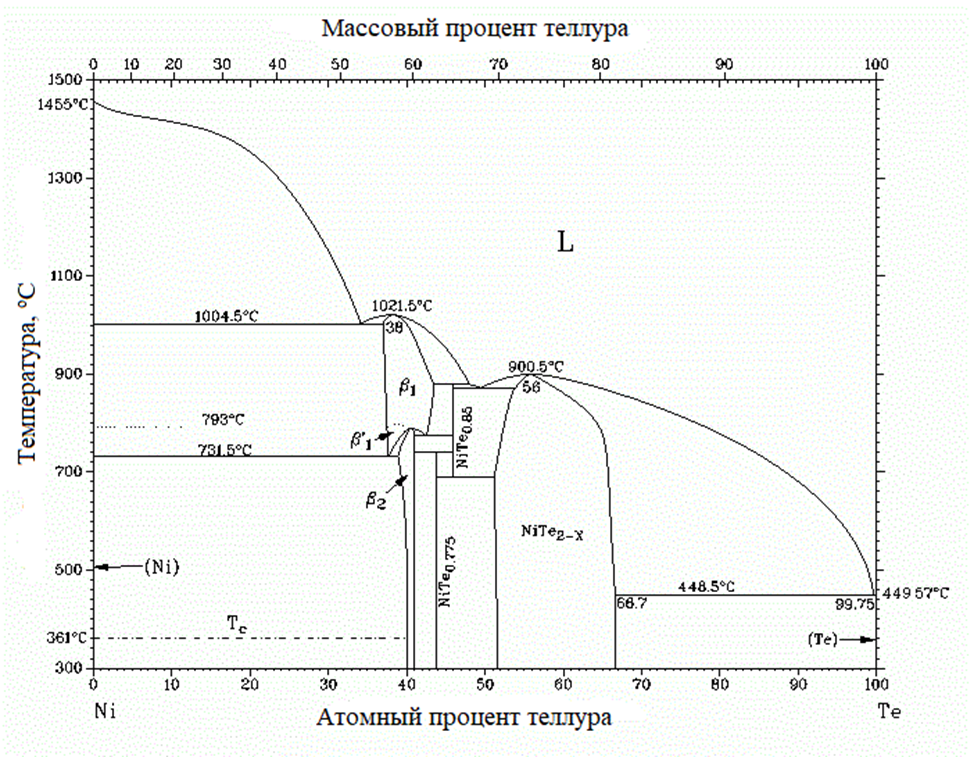
Рисунок 2 - Диаграмма состояния Ni–Te
Примечание: источник [10]
3. Диаграмма состояния Ni-Te
Анализ диаграммы состояния позволяет выделить несколько характерных фаз, образующихся в системе при повышении содержания теллура в системе Ni-Te, а именно переход от двухфазной области насыщенной Ni к однофазному твердому раствору на основе бертоллида β2; трансфер из гомогенной области β2 к NiTe0,775; переход в двухфазной области от NiTe0,775 к твердому раствору на базе конгруэнтно плавящегося соединения NiTe2-x; переход из гомогенной области NiTe2-x к двухфазной области и границе насыщения теллура никелем (Liq). При температуре около 700 оС на фазовое равновесие накладывается образование двухфазной области NiTe2-х + NiTe0,85.
4. Результаты и их обсуждение
Характер хронопотенциограмм, зарегистрированных относительно хлорного (рисунок 3) и никелевого (рисунок 4) электродов сравнения аналогичен. Потенциалы горизонтальных участков при начальной бестоковой выдержке теллурового катода в пределах погрешности измерений близки к потенциалу выделения никеля в электролите данного состава при температуре проведения экспериментов. Анализ кривых выключения проводили, аппроксимируя участки кривой с различными наклонами прямыми линиями, как показано на рисунке 5. В дополнение, по полученным данным для определения предельных плотностей тока выделения никеля на теллуре в данном электролите были построены поляризационные кривые (рисунок 6).
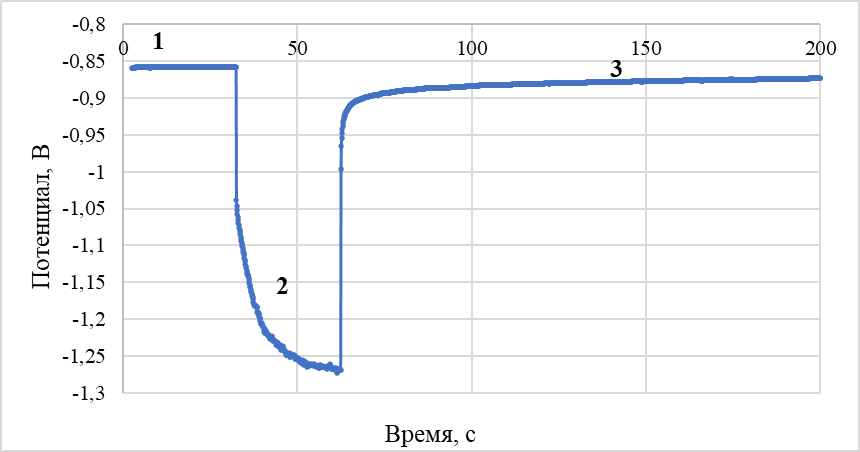
Рисунок 3 - Кривые «потенциал – время» при поляризации теллурового катода в хлоридном расплаве, содержащем ионы никеля 2 мас. %
Примечание: участки на кривой: 1 – бестоковая выдержка; 2 – катодная поляризация; 3 – кривая выключения; электрод сравнения – хлорный; плотность катодного тока – 0,14 А/см2; температура – 500 оС
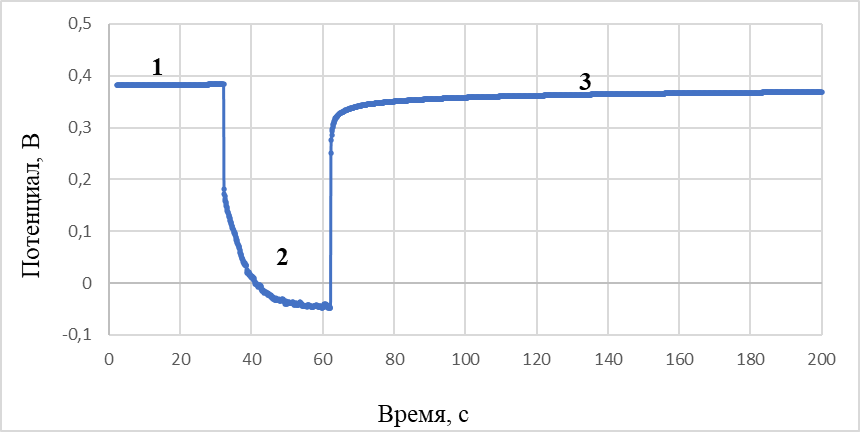
Рисунок 4 - Кривые «потенциал – время» при поляризации теллурового катода в хлоридном расплаве, содержащем ионы никеля 2 мас%
Примечание: участки на кривой: 1 – бестоковая выдержка; 2 – катодная поляризация; 3 – кривая выключения; электрод сравнения – никель; плотность катодного тока – 0,14 А/см2; температура – 500 °С
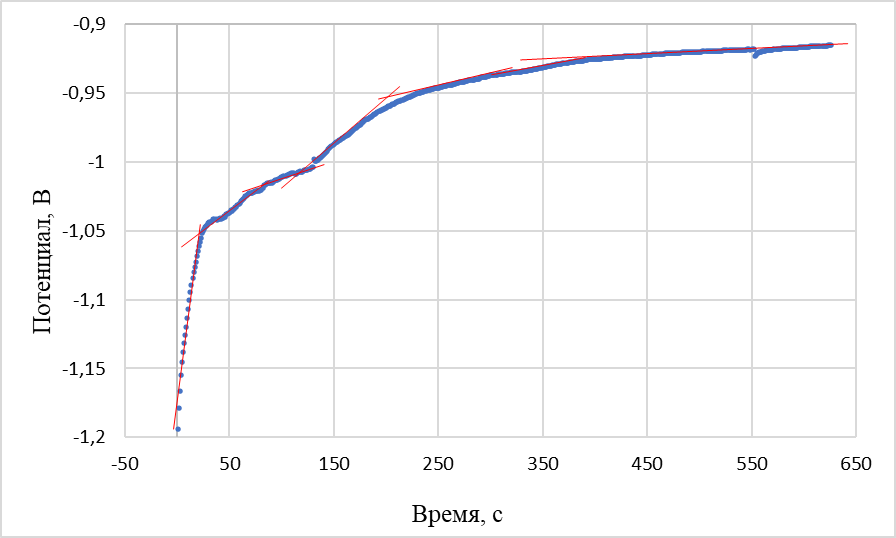
Рисунок 5 - Кривая выключения
Примечание: плотность катодного тока – 0,13 А/см2; электрод сравнения – хлорный; температура – 500 °С
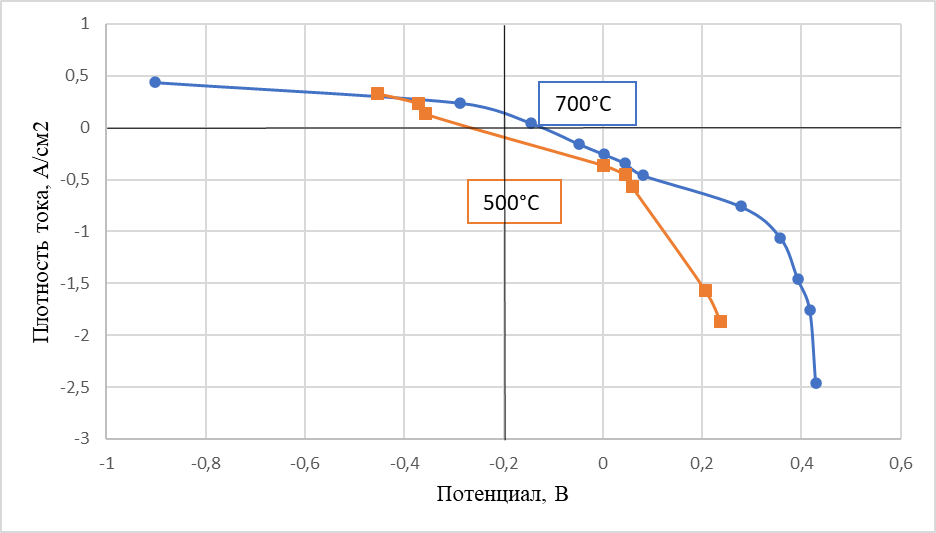
Рисунок 6 - Поляризация теллурового катода в хлоридном расплаве, содержащем ионы никеля 2 мас%
Примечание: электрод сравнения – никель
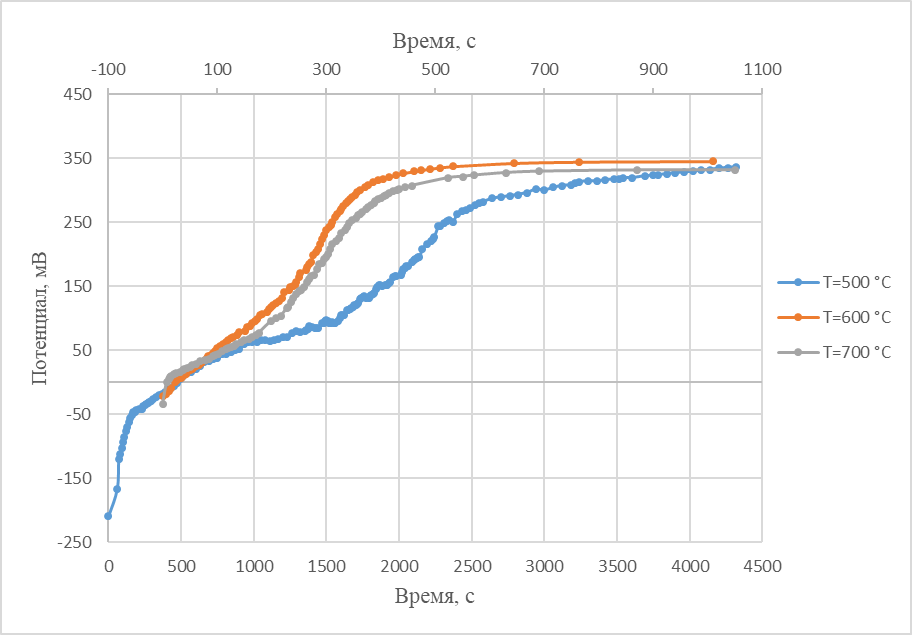
Рисунок 7 - Кривые выключения при поляризации теллурового катода в хлоридном расплаве, содержащем ионы никеля
Примечание: электрод сравнения – никель
Для оценки влияния этих побочных процессов были выполнены эксперименты, в ходе которых на поверхность торцевого никелевого электрода кратковременным погружением в расплав наносили тонкую пленку теллура. Результаты такового опыта представлены в рисунке 8.
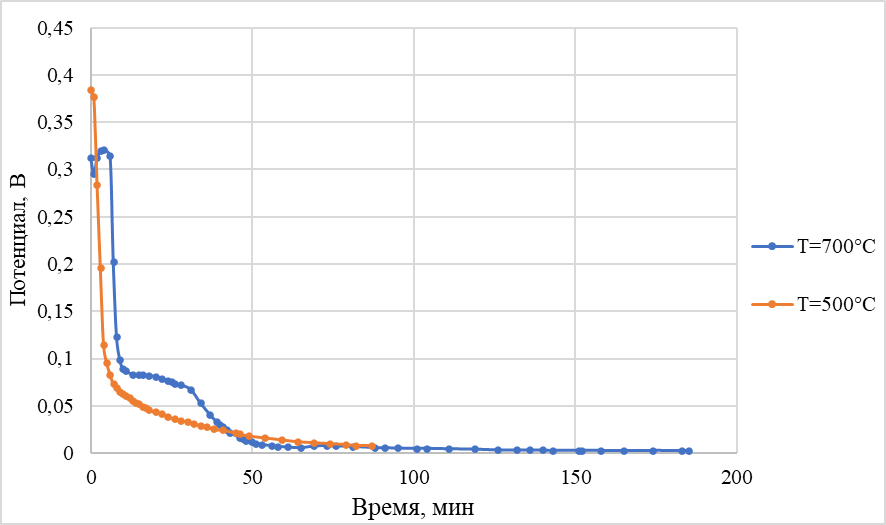
Рисунок 8 - Изменение потенциала после нанесения теллура на никель
Примечание: электрод сравнения – никель
Значения потенциалов характерных точек на хронопотенциограммах относительно никелевого электрода позволили рассчитать активность никеля в сплавах и соответствующие им изменения свободной энергии Гиббса образования. Результаты расчетов сведены в таблице 4.
Таблица 4 - Термодинамические характеристики сплавов Ni–Te
Фаза | Потенциал, В | Активность никеля в сплаве | Изменение энергии Гиббса, кДж/моль |
500 оС | |||
β2 (–) | 0,056 | 1,86·10–1 | –10,8 |
β2 (+) | 0,082 | 8,51·10–2 | –15,8 |
NiTe0,775 | 0,190 | 3,31·10–3 | –36,7 |
NiTe2–x | 0,285 | 1,91·10–4 | –55,0 |
NiTe2 | 0,305 | 1,05·10–4 | –58,9 |
600 оС | |||
β2 (–) | 0,058 | 2,14·10–1 | –11,2 |
β2 (+) | 0,085 | 1,04·10–1 | –16,4 |
NiTe0,775 | 0,197 | 5,30·10–3 | –38,0 |
NiTe2–x | 0,285 | 5,10·10–4 | –55,0 |
NiTe2 | 0,305 | 2,00·10–4 | –58,9 |
700 оС | |||
β2 (–) | 0,056 | 2,63·10–1 | –10,8 |
β2 (+) | 0,087 | 1,25·10–1 | –16,8 |
NiTe0,775 | 0,165 | 1,95·10–2 | –31,8 |
NiTe0,85 | 0,189 | 1,10·10–2 | –36,5 |
NiTe2–x | 0,289 | 1,01·10–3 | –55,8 |
NiTe2 | 0,305 | 6,90·10–4 | –58,9 |
Примечание: (–) и (+) – меньшая и большая концентрация теллура в соответствующей гомогенной области
5. Заключение
В работе определены термодинамические характеристики сплавов теллура с никелем. Полученные экспериментальные данные были сопоставлены с диаграммой состояния системы Ni–Te, и были рассчитаны термодинамические характеристики образующихся соединений, а именно активности никеля в сплавах с теллуром и соответствующие им энергии образования при температурах 500 – 700 оС. Из полученных данных, следует, что взаимодействие никеля с теллуром происходит со значительными энергетическими эффектами.
