Criteria of toxicity of biologically active molecules on the example of complex copper compound with phenanthroline using the method of dynamic speckle interferometry
Criteria of toxicity of biologically active molecules on the example of complex copper compound with phenanthroline using the method of dynamic speckle interferometry
Abstract
According to literature data, organometallic compounds have antitumour activity, but some of them, such as platinum compounds, have various side effects. Evaluation of medicinal products is performed according to the Order of the Ministry of Health of the Russian Federation dated 16.10.1997 N 305 “On the norms of variations permissible in the manufacture of medicinal products and packaging of industrial products in pharmacies” (together with the “Instruction on quality assessment of medicinal products manufactured in pharmacies”). At the same time, the search for alternative, simple, informative, cheap and accurate methods of assessing in vitro properties is the most important and still unresolved task.
For the complex compound of copper with phenanthroline obtained in this research with concentrations of reagents at the level of MAC in water the possibility of using the method of dynamic speckle-interferometry to assess toxicity on different cell cultures was shown: when the toxicity of the complex compound decreases in comparison with copper sulphate and with phenanthroline there is an increase in the intensity of processes occurring in the cell. The experimental data correlate with the data on the lipophilicity of the complex compound of copper with phenanthroline, which was determined by the method of Quantitative Structure Activity Correlation (QSAC), using the computer programme Molinspiration. The influence of different substituted amino acids (glycine, alanine, serine, asparagic acid, asparagine, glutamic acid, glutamine) on this property was also evaluated: the introduction of amino acid decreases the value of lipophilicity in comparison with the complex compound of copper with phenanthroline, which according to the Lipinski criterion reduces the toxicity of these compounds.
1. Введение
Поиск новых противоопухолевых препаратов не теряет свою актуальность для медицины. Большой потенциал имеют комплексные соединения различных переходных металлов с органическими лигандами: аминокислотами, карбоновыми кислотами, азотистыми основаниями и т.д. Авторами систематизирована информация об исследованиях противоопухолевых металлосодержащих препаратов, в том числе комплексных соединений меди (II). Ион Cu2+ является активным комплексообразователем.
Взаимодействие меди с ДНК обсуждается в работах , , , . Обнаружено, что Сu2+ обладает наибольшей степенью сродства к азотистым основаниям ДНК и показано, что дозы CuSO4 больше 10 мг/кг вызывают окислительный стресс, апоптоз, повреждение ДНК и воспалительные реакции, которые способствуют дисфункции селезенки у мышей . В работе показано, что комплексные соединения меди проявляют хорошую активность как ингибиторы топоизомеразы. В качестве возможных лигандов исследовался и фенантролин.
1,10-Фенантролин (phen) — классический бидентатныйхелатирующийлиганд ионов переходных металлов, который легко входит в водных растворах в состав октаэдрических комплексов [Me(phen)(H2O)4]2+, [Me(phen)2(H2O)2]2+ и [Me(phen)3]2+ с катионами переходных металлов . Стабильность комплексов [Me(phen)]2+ соответствует последовательности Ирвинга–Вильямса, константы их образования варьируются от 4,13 ([Mn(phen)]2+) до 9,25 ([Cu(phen)]2+) логарифмических единиц . Комплексы фенантролина с ионами переходных металлов, включая Fe2+, Cu2+, Co2+, Zn2+, Mn2+, Ln3+, Ru2+, Rh3+ и Os2+, известны своей способностью взаимодействовать с ДНК, вызывая расщепление полинуклеотидных цепей , , .
Структура возможных комплексных соединений меди с фенантролином, а также их возможность применения в противоопухолевой терапии изучена авторами .
Необходимость получения новых противоопухолевых препаратов продиктована в том числе тем, что широко применяемые препараты комплексных соединений платины обладают высокой токсичностью . Подбор оптимального соотношения липофильности/гидрофильности и токсичности играет большую роль при создании и изучении новых лекарственных препаратов , . Липофильность — это свойство молекулы, определяющее ее способность проникать через биологические мембраны и непосредственно влияющая на такие важные биофармацевтические парматерты как растворимость, абсорбция в кровоток, биотрансформация, экскрекция , . Согласно критериям Липински, липофильность соединения (LogP) не должна быть больше 5. Считается, что при таких значениях обеспечивается наилучшее соотношение терапевтического эффекта и токсичности.
В настоящее время при доклиническом исследовании токсичности молекул invitro используется метод фенотипического скрининга — оценка цитотоксического действия лекарственных препаратов в отношении различных линий опухолевых клеток с последующим определением концентрации, подавляющей рост 50% клеток, вызывающей гибель 50% клеток и вызывающей снижение функции у 50% клеток . Данный метод не требует понимания механизма химического воздействия соединения на клетки .
В направлении совершенствования методов доклинических исследований представляет интерес метод динамической спекл-интерферометрии. Спекл-структуры — это пятнистые картины, возникающие при когерентном освещении неоднородных сред или объектов. Так как распределение неоднородностей структуры носит случайный характер, то полученное пятнистое изображение является носителем измерительной информации. Спекл-интерферометрия используется для высокоточного интерференционного контроля объектов с оптически грубыми поверхностями, наблюдения астрономических объектов через турбулентную атмосферу Земли . Метод динамической спекл-интерферометрии основан на том, что внутриклеточные процессы в живых клетках, культивированных или осажденных на прозрачной подложке, случайным образом изменяют фазы прошедших через клетку волн и, таким образом, по характеру изменения картины спеклов можно получить сведения о процессах, протекающих на поверхности или в глубине клетки . Авторами , , опубликованы работы, в которых изучается применение метода динамической спекл-интерферометрии при оценке изменений метаболической активности клеток при воздействии температуры, вируса герпеса, а также подробно рассмотрена теория метода, описана экспериментальная установка, методика расчетов. Таким образом, метод является перспективным в направлении анализа внутриклеточных процессов, но также имеет ряд недостатков. Во-первых, культивированные клетки находятся в питательной среде, содержащей множество аминокислот и других потенциальных лигандов, которые могу образовать соединение с исследуемым металлом. Во-вторых, для оценки критериев токсичности молекул новым методом необходимо оценить их другими известными методами.
Липофильность и потенциальную токсичность часто сопоставляют. Для оценки этих свойств целесообразно использовать методы количественной корреляции структура — активность (ККСА), включающие в себя применение различных компьютерных программ, алгоритмы которых основаны на сравнении вкладов структурных фрагментов молекулы с соединениями из базы данных. Примерами таких программ являются Molinspiration, Petra, Osyris и др.
Сложность и многообразие структур потенциальных лекарственных препаратов требует применения новых методов предсказания и оценки свойств молекул, обеспечивающих адекватную интерпретацию данных доклинических исследований, которые потом могут быть успешно перенесены в клиническую практику.
В рамках данной работы рассмотрена возможность применения метода для оценки токсичности молекул потенциальных лекарственных препаратов.
Цель — определение токсичности комплексного соединения меди с фенантролином, полученного при концентрации реагентов на уровне ПДК в воде; оценка влияние различных аминокислот на данное свойство.
2. Материалы и методы
Синтез комплексного соединение меди с фенантролином.
Для приготовления комплексного соединения растворы CuSO4·5H2O с концентрациями 0,95 мг/л и фенантролина 0,3 мг/л смешивались в соотношении 1:2.
Раствор сульфата меди получали разбавлением исходного 0,01 М раствора: 1,5 мл в 100 мл раствора, так, чтобы концентрация по меди составила 9,5 мг/л. Это необходимо, так как в дальнейшем раствор вводится в количестве 10% от состава питательной среды, таким образом, происходит разбавление еще в 10 раз и концентрация Сu(II) составляет 0,95 мг/л (ориентиром здесь служит ПДК меди в питьевой воде — 1 мг/л ).
Раствор фенантролина готовили из исходного раствора с концентрацией 1 мг/л. Перед добавлением в питательный раствор исходный раствор фенантролина разбавляли 3 мл в 100 мл раствора так, чтобы концентрация составила 3 мг/л и при дальнейшем вводе в питательный раствор в количестве 10% от состава питательной среды произошло разбавление в 1 раз и концентрация его бы составила 0,3 мг/л, что также не превышает ПДК фенантролина в питьевой воде — 0,3 мг/л .
Образование комплексного соединения обнаруживали по появлению пика на спектре при длине волны 270 нм на спектрофотометре «Leki» (Финляндия) в кювете 50 мм (рис.1).
Для контроля идентичности состава растворов, приготовленных для серии параллельных измерений у растворов определяли электрическую проводимость (кондуктометр «АНИОН 7020»), водородный показатель (анализатор жидкости «Эксперт-001») и оптическая плотность при длине волны 220 и 270 нм в кварцевой кювете на 50 мм (спектрофотометр «Leki» (Финляндия)).
Предварительная оценка токсичности комплексного соединения методом динамической спекл-интерферометрии.
Метод динамической спекл-интерферометрии был реализован согласно публикациям авторов , , . В рамках данного исследования клетки линии L-41 (раковые клетки) подвергались воздействию приготовленных растворов сульфата меди, фенантролина и комплексного соединения меди с фенантролином. Регистрировались основные параметры, предложенные авторами , , в качестве критерия оценки метаболической активности клеток – среднеквадратичное отклонение и время релаксации флуктуаций показателя преломления m–го процесса на участке (метод позволяет усреднять результаты, полученные на участке размером 10 клеток). Параметры регистрировались для клеток в норме и после введения реагента. Предварительно оценен спад клеточной активности в процентах после введения реагента относительно нормы.
3. Результаты и их обсуждение
Для эксперимента готовили растворы сульфата меди, фенантролина и комплексного соединения меди с фенантролином. С помощью таких показателей как электропроводность, водородный показатель и оптическая плотность контролировали состав растворов, приготовленных для серии параллельных измерений. В таблице 1 приведены значения физико-химических характеристик приготовленных растворов с рассчитанной величиной отклонения. Полученная величина отклонения характеристик раствора от контрольных показателей позволяет обеспечить воспроизводимость результатов эксперимента с культурой клеток.
Таблица 1 - Контрольные показатели приготовленных растворов
№ пробы | состав пробы | С, мг/л | электропроводность, мкСм/см | А220 | А270 | рН |
1 | CuSO4 | 9,525 | 42±2 | 0,65±0,05 | 0,13±0,05 | 5,1±0,1 |
2 | CuSO4 | 0,950 | 6±2 | 0,13±0,05 | 0,07±0,01 | 5,45±0,05 |
3 | C12H8N2 | 2,970 | 7±2 | 2,35±0,05 | 1,8±0,05 | 4,9±0,2 |
4 | C12H8N2 | 0,297 | 3±1 | 0,29±0,05 | 0,24±0,05 | 5,4±0,2 |
5 | КС | - | 38±2 | 2,5±0,2 | 2,35±0,05 | 4,6±0,2 |
6 | КС | - | 7±1 | 0,34±0,05 | 0,3±0,05 | 5,25±0,05 |
Образование комплексного соединения между ионом меди и фенантролином подтверждали, сравнивая спектры приготовленных растворов (рисунок 1). У раствора сульфата меди не наблюдается максимума поглощения в выбранном диапазоне длин волн, у раствора фенантролина два максимума поглощения — при длине волны 225 нм и 250 нм, у раствора, в который добавлены аликвота меди и аликвотафенантролина в мольном соотношении 1:2 имеется один максимум поглощения при длине волны 270 нм. Появление сдвига максимума поглощения свидетельствует об образовании комплексного соединения между медью и фенантролином. Именно длины волн, при которых в растворах наблюдаются максимумы поглощения и были выбраны для определения контрольного показателя оптической плотности приготовленных растворов для обеспечения воспроизводимости результатов.
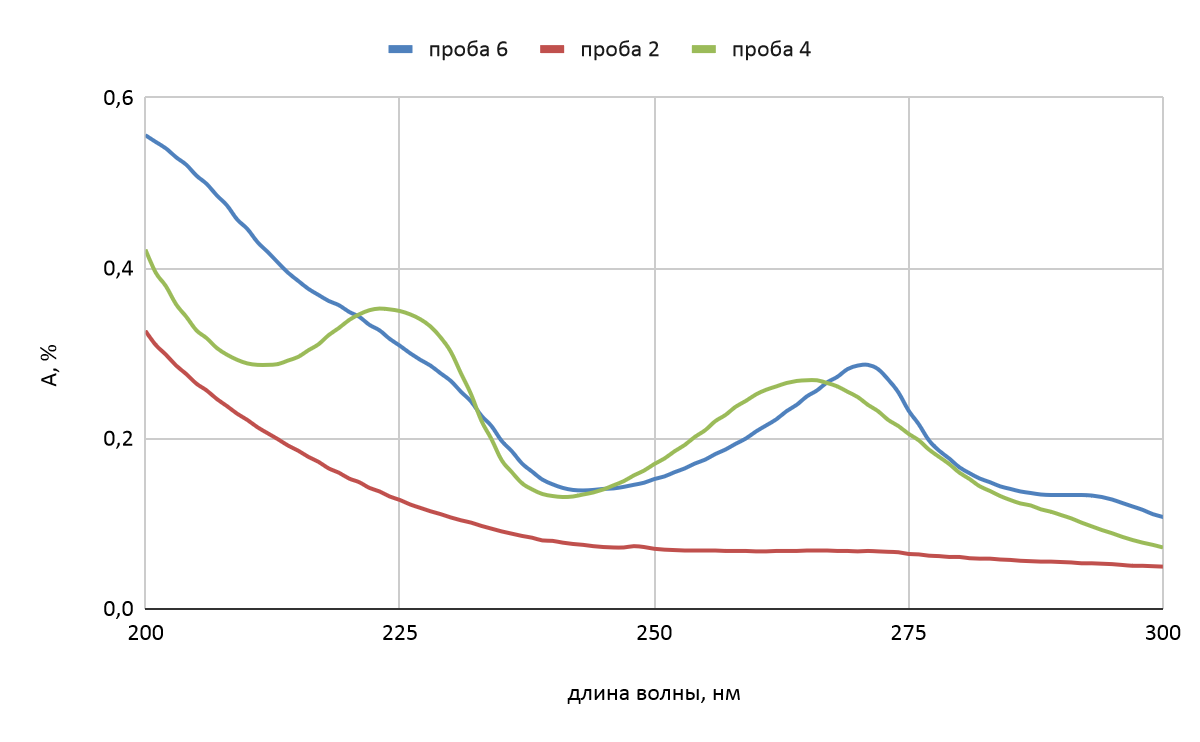
Рисунок 1 - Зависимость оптической плотности раствора от длины волны
Примечание: проба 2 – раствор CuSO4 с концентрацией 0,95 мг/л; проба 4 – раствор C12H8N2 с концентрацией 0,297 мг/л; проба 6 – раствор комплексного соединения
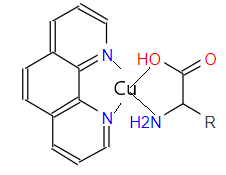
Рисунок 2 - Возможная структура комплексных соединений меди с фенантролином и аминокислотами
Таблица 2 - Значения LogP для предполагаемых комплексных соединений Cu(II) с различными лигандами
Название системы | phen-gly | phen-ala | phen-ser | phen-asp | phen-asn | phen-glu | phen-glmn | phen-pro | phen | phen-phen |
LogP | 8,97 | 9,09 | 8,69 | 8,77 | 9,05 | 8,88 | 8,69 | 9,19 | 9,11 | 10,65 |
Для всех комплексных соединений с включенным лигандом-заменимой аминокислотой значение липофильности меньше, чем у соединений меди с фенантролином. Однако у всех соединений величина LogP выше 5, что, согласно критерию Липински говорит о высокой токсичности данных молекул.
Также близкие величины снижения клеточной активности под воздействием всех трех растворов может быть связано с тем, что концентрации иона меди и фенантролина выбраны в соответствии с нормативными документами, определяющими их допустимый уровень содержания (ПДК) в питьевой воде. Однако, для того чтобы увеличить чувствительность метода динамической спекл-интерферометрии до уровня, позволяющего различать какие процессы и с какой скоростью подавляются под воздействием токсичных веществ, необходимо использовать концентрации ниже установленных ПДК.
Метод динамической спекл-интерферометрии позволяет количественно определять параметры, характеризующие активность метаболизма клеток, однако к настоящему моменту получаемые данные нуждаются в тщательной интерпретации, так как пока что очень сложно сказать, какие именно процессы подавляются при воздействии тех или иных и в каком процентном соотношении. Накопив базу данных экспериментальных кривых процессов, протекающих в клетках под воздействием различных реагентов или других внешних условий, можно будет количественно оценивать снижение интенсивности конкретных процессов (синтез протеинов, дыхание, размножение и пр.) В рамках данного исследования используются предварительно полученные данные о средней величине спада клеточной активности — рассчитанной на основании 7 повторений значение для раствора меди — 47%, 4 повторений для раствора фенантролина — 36%, и 6 повторений для раствора комплексного соединения меди с фенантролином — 38%. Стоит отметить, что все значения близки между собой и для комплексного соединения меди с фенантролином не наблюдается усиление эффекта или величины снижения клеточной активности равной сумме для растворов сульфата меди или фенантролина. Полученные данные согласуются с результатами, полученными другими авторами . В этой статье показано, что взаимодействие с компонентами клетки и гибель клеток связаны с раздельным действием ионов Cu2+ и молекулы фенантролина, а не частицы комплексного соединения. Также авторы этой работы предлагают изучить применимость этого утверждения на комплексные соединения меди с другими лигандами.
Кроме того, близкие величины снижения клеточной активности под воздействием всех трех растворов могут быть связаны с тем, что концентрации иона меди и фенантролина выбраны в соответствии с нормативными документами, определяющими их допустимый уровень содержания (ПДК) в питьевой воде.
Таким образом, можно заключить, что метод динамической спекл-интерферометрии позволяет количественно определять параметры, характеризующие активность метаболизма клеток, однако для обоснования критериев токсичности необходимо получить зависимости по снижению клеточной активности от концентрации, которая позволит обосновать терапевтическую дозу с минимальным токсичным эффектом.
4. Заключение
1. Метод динамической спекл-интерферометрии экспериментально подтвердил теоретический расчет: комплексное соединение меди (II) c 1,10-фенантролином имеет токсический эффект и снижает клеточную активность на 38%.
2. При введении аминокислоты липофильность смешанного комплексного соединения уменьшается и незначительно уменьшается токсичность (согласно критерию Липински). Следовательно, присутствие аминокислот в питательном растворе не должно существенно повлиять на оценку свойств комплекса меди (II) с 1,10-фенантролином.
3. Метод динамической спекл-интерферометрии позволяет количественно определять параметры, характеризующие активность метаболизма клеток, однако для обоснования критериев токсичности необходимо получить зависимость снижения клеточной активности от концентрации комплексного соединения меди(II) с 1.10-фенантролином, концентрацию комплекса можно определять спектрофотометрически при длине волны 270 нм.
