MORPHOLOGICAL SPECIFICS OF LUNGS IN EXPERIMENTAL DIABETES MELLITUS
MORPHOLOGICAL SPECIFICS OF LUNGS IN EXPERIMENTAL DIABETES MELLITUS
Abstract
Studies of the respiratory system in diabetes mellitus (DM) described in the literature are concerned with its clinical picture, but it is known that years and even decades pass between the early disturbances of carbohydrate metabolism and the patient's diagnosis. It is possible to evaluate the earliest changes in DM only in experimental studies. The aim of the work was to examine the dynamics of pathomorphological changes in rat lungs in experimental DM. DM modelling was carried out by a single subcutaneous administration of alloxan monohydrate at a dose of 135 mg/kg. The material was sampled on the 3rd, 7th, 14th and 30th day after alloxan administration. The results obtained show that insulin deficiency leads to the appearance of numerous foci of atelectasis in the lung tissue, combined with areas of emphysema and changes in the vascular bed, while preserving the general structure of the tissue. Extensive zones of infiltration are found in the peribronchial connective tissue and walls of alveoli. Thus, already at the early stage of DM development there are significant morphological changes in lung tissue, which increases hypoxia in insulin deficiency.
1. Введение
Сахарный диабет (СД) – заболевание, основным патогенетическим фактором которого является недостаточность инсулина. Дефицит инсулина может быть вызван как непосредственным повреждением поджелудочной железы, так и развитием инсулинорезистентности . В современной классификации сахарного диабета выделяют эти два типа, а также ряд других, например, связанный с генетическими нарушениями, гестационный и пр. Количество больных сахарным диабетом в нашей стране и в мире постоянно увеличивается. На 1 января 2024 года в Российской Федерации зарегистрировано более 5 млн пациентов с СД, а новых случаев за год более 215 тыс. Однако в реальности количество больных намного больше, что связано с поздней диагностикой заболевания . При СД происходит нарушение всех видов обмена веществ и энергии. В результате страдают все органы и системы организма . Наиболее чувствительными являются так называемые «органы-мишени» сахарного диабета – нервная система, сердечно-сосудистая система, почки, сетчатка . Однако часто больные с СД предъявляют жалобы на респираторные симптомы, и риск возникновения заболеваний дыхательной системы у них выше, чем в общей популяции . Исследования дыхательной системы, описанные в литературе, касаются развернутой клинической картины СД, но известно, что между ранними нарушениями углеводного обмена и постановкой больному диагноза «сахарный диабет» проходят годы и даже десятилетия. Также мало учитывается динамика изменений легочной ткани при прогрессировании СД. Оценить наиболее ранние изменения при СД представляется возможным только в экспериментальных исследованиях, когда известно время воздействия инициирующего фактора, повреждающего инсулярный аппарат поджелудочной железы.
Цель исследования – изучить динамику патоморфологических изменений легких крыс при экспериментальном сахарном диабете.
2. Методы и принципы исследования
Исследование проводилось на 50 белых беспородных крысах-самцах, находящихся в стандартных условиях вивария, в соответствии с Европейской конвенцией о защите позвоночных животных. Имеется разрешение локального Этического комитета на его проведение. Экспериментальное моделирование сахарного диабета осуществляли с помощью однократного введения аллоксана моногидрата (производитель – фирма ДиаМ) подкожно в дозе 135 мг/кг . Эта модель является второй по частоте использования после стрептозоциновой модели. Механизм действия аллоксана связан с селективным повреждением бета-клеток островков Лангерганса и развитием инсулинзависимого сахарного диабета. Для оценки динамики изменений в легких забор материала осуществляли на 3-й, 7-й, 14-й и 30-й день после введения аллоксана. На каждом из сроков наблюдения использовали группу по 10 животных, всего 40 с моделью сахарного диабета и 10 контрольных. Эвтаназия осуществлялась под золетиловым наркозом путем декапитации. Легкие забирали целиком и помещали в 10% забуференный формалин для первичной фиксации. После вторичной фиксации осуществляли обезвоживание 99% изопропиловым спиртом. Фрагменты легких заливали в парафин и на санном микротоме «Microtom» изготавливали срезы толщиной 5 – 6 мкм. Срезы окрашивали гематоксилином и эозином. Фотографирование микропрепаратов проводили на микроскопе «Micros» МС-200 с цифровой окулярной камерой DCM 900. При оценке легких исследовалось состояние бронхиального дерева, альвеол, а также сосудистого русла.
Концентрация глюкозы в плазме крови определяли глюкозооксидазным методом, используя набор ООО «Ольвекс диагностикум» (Россия) для количественного определения содержания глюкозы в сыворотке или плазме крови человека энзиматическим колориметрическим методом без депротеинизации. Статистическая обработка результатов измерения глюкозы в крови проводилась в программе Statistica 13, использовали непараметрический критерий Манна-Уитни. Статистически значимыми считали различия при р<0,05.
3. Основные результаты и обсуждение
Введение аллоксана в описанной дозировке приводило к гибели около 30% животных в первую неделю эксперимента. Концентрация глюкозы достоверно (р<0,05) увеличивалась во все сроки исследования и составляла на 3-й день после введения аллоксана 72,0 мМ, на 7-й – 21,7 мМ, на 14-й – 18,8 мМ, на 30-й – 14,8 мМ при 9,4 мМ у крыс контрольной группы.
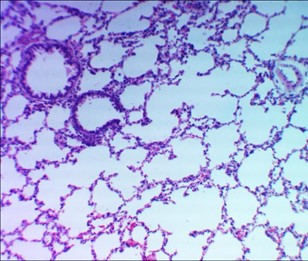
Рисунок 1 - Контрольная группа
Примечание: альвеолы легких расправлены, просвет бронхиол свободен, кровенаполнение капилляров стромы равномерное; окраска гематоксилином и эозином; увеличение х120
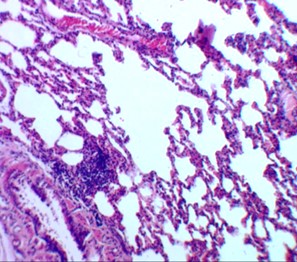
Рисунок 2 - 3-и сутки после введения аллоксана
Примечание: в легких венозное полнокровие, очаговая эмфизема, лейкоцитарная инфильтрация межальвеолярных перегородок; окраска гематоксилином и эозином; увеличение х120
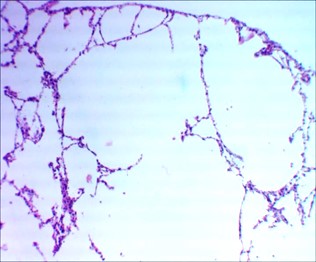
Рисунок 3 - 7-е сутки после введения аллоксана
Примечание: в легких очаговая эмфизема; окраска гематоксилином и эозином; увеличение х 120
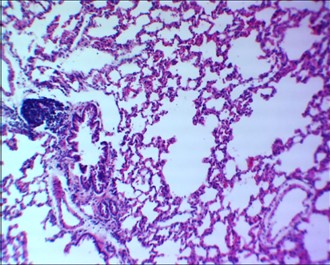
Рисунок 4 - 7-е сутки после введения аллоксана
Примечание: бронхоспазм, лейкоцитарная инфильтрация стромы легкого; увеличение х120
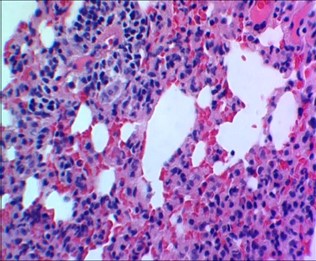
Рисунок 5 - 14-е сутки после введения аллоксана
Примечание: в легких венозное полнокровие, очаговые кровоизлияния, чередование очагов ателектазов и эмфиземы, лейкоцитарная инфильтрация; окраска гематоксилином и эозином; увеличение: х480
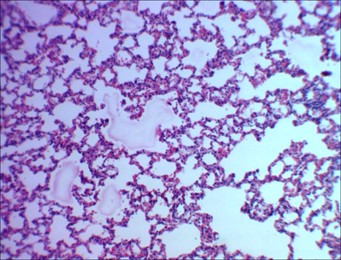
Рисунок 6 - 14-е сутки после введения аллоксана
Примечание: венозное полнокровие, очаговая эмфизема, интраальвеолярный отек стромы легкого; окраска гематоксилином и эозином; увеличение х120
Гипергликемия в течение 1 месяца вызывает еще более выраженные изменения структуры бронхов, альвеолярной ткани и сосудистого русла. Бронхиальное дерево частично в спавшемся состоянии, в просвете отмечается повышенное скопление слизи. Имеются признаки лейкоцитарной инфильтрации стенок бронхов. В респираторном отделе альвеолы частично в спавшемся состоянии, их стенки утолщены, что сочетается с эмфизематозно расширенными альвеолами. Кровообращение существенно изменено. Отмечается выраженная гиперемия, множество очагов кровоизлияний.
4. Заключение
Экспериментально вызванная хроническая гипергликемия приводит к появлению в легочной ткани многочисленных очагов ателектазов, сочетающихся с участками эмфиземы и изменений сосудистого русла при сохранении общего строения ткани. Обширные зоны инфильтрации обнаруживаются в перибронхиальной соединительной ткани и стенках альвеол. Полученные результаты свидетельствуют об еще одной важной мишени влияния хронической гипергликемии – легочной ткани, что усиливает гипоксические нарушения в организме при сахарном диабете.
