A COMPREHENSIVE EVALUATION OF BIOCOMPATIBILITY OF SCAFFOLDS AND DERMAL FIBROBLASTS OF HUMAN SKIN
A COMPREHENSIVE EVALUATION OF BIOCOMPATIBILITY OF SCAFFOLDS AND DERMAL FIBROBLASTS OF HUMAN SKIN
Abstract
The article presents the results of studying the homeostasis of human skin cells in the in vitro model cultured on different scaffolds. A comprehensive analysis of biocompatibility indices of dermal fibroblast cell lines with scaffolds of different chemical composition and spatial organization – G-DERM, Cytodex 3, Transwell – is presented. It was noted that spindle shape and a greater number of outgrowths, high kinetics of culture growth, a large percentage of viable cells (more than 95%) are characteristic of fibroblasts growing on Transwell and G-DERM. At the same time, the cell line of fibroblasts seeded on G-DERM with higher mitotic activity (G2-M-period) with a greater number of CD90+ fibroblasts (mesenchymal marker 89%), the main pathway of death – apoptosis (Annexin V+/7-AAD- and Annexin V+/7-AAD+).
1. Введение
Более чем три десятилетия назад появились первые разработки двухслойного и биосовместимого дермального скаффолда на основе бычьего коллагенового матрикса, который успешно индуцировал синтез неодермы. Эта новая биоконструкция произвела настоящую революцию в современной ожоговой практике
. Методы тканевой инженерии (scaffold-technology), представляет собой хирургическую альтернативу в лечении различных патологий, включая ожоги, язвы, гигантские невусы и опухоли. Главной задачей которой является разработка универсального скаффолда с морфологическими и функциональными свойствами, оптимальными для адгезии, дифференцировки, пролиферации, формирования микроокружения, необходимого для жизнеспособности клеток кожи . Разработка скаффолдов, различного химического состава, предназначенных для клеточных культур, должна учитывать химический состав компонентов внеклеточного матрикса кожи in vivo, а сам скаффолд должен быть механически стабильным, биосовместимым и биодеградируемым, имитируя ткане- и органоспецифическую микроархитектуру кожи . Скаффолды как носители клеток также являются хорошей моделью для тестирования лекарств in vitro и исследований патогенеза заболеваний кожи, в том числе меланомы. Благодаря своей пористости каркасы облегчают транспорт кислорода, питательных веществ и продуктов метаболизма, способствуя высокому уровню пролиферации, миграции, цитокоммуникаций и межклеточных адгезий и адгезии клеток с компонентами скаффолда, создавая эквивалент по принципу гистоморфологического соответствия пространственного и функционального подобия кожи. Более того пространственная организация компонентов скаффолда влияет на экспрессию генов , .Несмотря на значительный прогресс в фундаментальных и прикладных исследованиях в области клеточной и тканевой инженерии, нет единых критериев, которые бы отражали биосовместимость скаффодов с культивируемыми клеточными линиями, в том числе с клеточными линиями кожи
, . Отсутствие единых критериев является одной из причин медленного прогресса в достижении клинических и коммерческих результатов, а также это связано с тем, что на рынке представлены скаффолды различной химической природы и пространственной 3D организации .В связи с этим цель исследования – предложить критерии биосовместимости дермальных фибробластов и скаффолдов различной химической природы и пространственной организации – G-DERM, Cytodex 3, Transwell.
2. Методы и принципы исследования
2.1. Культивирование
В качестве тест-системы была использована клеточная линия дермальных фибробластов кожи человека 3 пассажа. Первичная культура получена методом экспланта кожного лоскута размерами не более 1,0×5,0 см, иссеченного из области груди (область ареола). Культивирование проводили в стерильных чашках Петри (ТРР, Швейцария) и флаконах объемом 25 см2 (ТРР, Швейцария), в питательной среде RPMI-1640 (Панэко, Россия) с 10% сывороткой эмбрионов телят (HyClonе, США), гентамицином (Панэко, Россия) в условиях 5% СО2 при температуре +37°С. Оценку количества клеток проводили с помощью анализа исключения трипанового синего на автоматическом счетчике клеток (BioRad, США).
2.2. Используемые скаффолды
«Transwell» – мембраны из тетрафторэтилена (ПТФЭ) с коллагеновым покрытием, который используется в качестве вставки для культуральных планшетов. Толщина мембраны 10 мкм, диаметр 24 мм, диаметр пор 0,4 мкм.; «G-DERM» – биопластический материал из биополимера на основе гидроколлоида гиалуроновой кислоты и адгезивного пептидного комплекса; «Cytodex 3» - гранулы диаметром 300мкм, образованные путем химического связывания тонкого слоя денатурированного коллагена с поперечно-сшитым декстрановым матриксом сферической формы в гидрогеле. Экспериментальные группы в зависимости от скаффолда на который заселяли дермальные фибробласты условно обозначали CulCyt, CulTw и CulGD.
2.3. Оценка жизнеспособности клеток
Анализ роста, количества живых клеток и фотофиксацию проводили на флуоресцентном инвертированном микроскопе «Axio Vert. A1 FL» (Carl Zeiss, Германия) с цифровой цветной видеокамерой Axiocam 105 при увеличении ок10 х об20. Рассчитывали индекс пролиферации и пролиферативный потенциал.
2.4. Морфологический анализ
Для определения характера роста фибробластов, клетки выращивали на покровном стекле с адгезивным покрытием Polysine (Thermo Fisher Scientific, США), фиксировали 10% формалином, окрашивали гематоксилином Карацци и водно-спиртовым раствором эозина (Вiovitrum, Россия) согласно разработанному в НИЦ ФППББ оптимизированному протоколу, заключали в среду Immu-Mount (Thermo Fisher Scientific, США). Для морфологического анализа препараты оцифровывали на сканере «Pannoramic Deck» (3DHISTECH, Венгрия) с программным обеспечением Zeiss (Германия).
2.5. Проточная цитофлуориметрия
Анализ клеточного цикла методом проточной цитофлуориметрии проводили как описано ранее (Pozarowski, Darzynkiewicz, 2004). Объем клеток 5*105 в одном аналите предварительно фиксировали в 70% охлажденном этаноле. В работе использовали флуорохром ДНК пропидий йодид (PI) (50 мкг/мл), РНКазу (100 мкг/мл). Анализ и интерпретацию данных выполняли на мультилазерной (мультиплексной) диагностической системе проточной цитофлуориметрии CyFlowSpace (Partec, Германия) с сопряженным программным обеспечением FlowMax, при длине волны 536 нм. Для оценки доли клеток в соответствующих фазах клеточного цикла (G0/G1, S и G2/M) анализировали гистограммы частоты содержания ДНК в клетках.
Для анализа путей клеточной гибели использовали двойной флуресцентный краситель (FITS) к Annexin V и 7-AAD (BD Bioscientices, США). Живые клетки отрицательны по Annexin V-/7-AAD-, клетки на ранней стадии апоптоза проявляют одиночное флуоресценцирование положительное свечение – Annexin V+/7-AAD-, а клетки на поздней стадии апоптоза и клетки в состоянии некроза проявляют двойную положительную флуоресценцию – Annexin V+/7-AAD+, Annexin V- 7AAD+ – соответственно.
2.6. Статистические методы
При анализе, обработке и представлении данных использовалось программное обеспечение Prism 8.0.1 (Graphpad, США). Для каждой выборки было рассчитано среднее значение и стандартное отклонение. Различия величин тестируемых показателей в контрольной и экспериментальной группе оценивали с помощью попарной статистики, используя t-критерий Стьюдента. Различия считались достоверными при уровне значимости р<0,05.
3. Результаты и обсуждение
3.1. Морфофункциональная характеристика клеточной линии дермальных фибробластов перед заселением на скаффолды
На этапе выделения первичной клеточной культуры отмечаются популяции фибробластов разной степени дифференцировки - клетки среднего и крупного размера, веретеновидной и плащевидной формы с отростками I-го и II-го порядка. В слабо базофильной эктоплазме располагаются пересекающиеся нитевидные структуры и включения. Ядро овальной формы с чётким контуром, количество ядрышек от 2 до 4-х.
В контрольных образцах через 48 часов инкубации отмечена деконденсация хроматина, как морфологический критерий секреторной активности, активации обменных процессов с внеклеточным матриксом. Отростки фибробластов веретеновидной формы значительно длиннее по сравнению с таковыми у фибробластов округлой формы. На поверхности отдельных фибробластов присутствовали инвагинации, которые являются признаком экзо- или эндоцитозного транспорта. Межклеточное пространство заполнено умеренным количеством ВКМ (внеклеточного матрикса) с немногочисленными тонкими волокнами.
После формирования монослоя большинство фибробластов метаболически активны, веретеновидной формы, ориентированные параллельно или волнообразно вокруг центра колониеобразования. Подобная картина монослоя отражает различную степень организации и ориентации цитоскелета фибробластов, который обеспечивает динамическое изменение клетки в ответ на меняющееся микроокружение. В ходе анализа эффективности колониеобразования отмечено, что колонии, сформированные дермальными фибробластами, отличались друг от друга: рыхлые колонии состоят из разных по величине, разобщенных, хаотично ориентированных, полиморфных фибробластов с большим количеством отростков; плотные колонии – преобладает веретеновидная форма, клетки упорядоченно расположены, тесно прилежат друг к другу; смешанные колонии - из веретеновидных и полиморфных фибробластов.
3.2. Морфологическая характеристика клеточной линии дермальных фибробластов групп CulCyt, CulTw и CulGD
Фибробласты клеточной линии после заселения на скаффолды удлиненной формы, с распластанной цитоплазмой, плотно прилегающие к пластику культурального флакона (активные фибробласты). Все культуры сформировали монослой в равные сроки на - 7 сутки. Фибробласты экспериментальной группы CulCyt, в большей мере округлой формы, гладкой поверхности. Веретеновидную и полигональную форму, складчатую поверхность отмечали у фибробластов группы CulTw и CulGD.
3.3.Кинетики роста клеточной линии дермальных фибробластов групп CulCyt, CulTw, CulGD
В группах CulTw и CulGD формирование конфлюэнтного слоя клеток отмечено в течение 2 недель. В группе CulCyt рост клеточной линии неравномерный с появлением единичных фибробластов на 5 и 7 день культивирования. Полное заселение скаффолда наблюдалось с 13 по 21-е сутки культивирования (рис. 1А) с частичным прикреплением фибробластов к микроносителю (рис. 1Б), что определяет низкую скорость роста клеток на поверхности микросфер гидрогелевого скаффолда Cytodex 3.
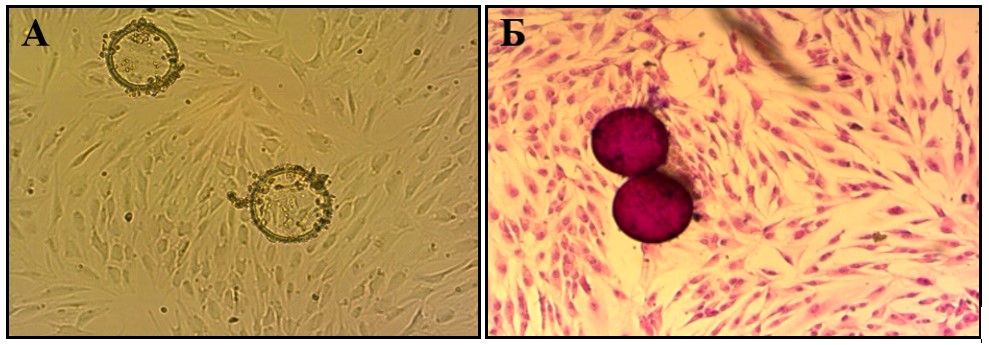
Рисунок 1 - Клеточная линия дермальных фибробластов группы CulCyt
Примечание: А – световая микроскопия, увеличение ок. 10 х об. 20, Б – окраска гематоксилин-эозином, увеличение ок. 10 х об. 20

Рисунок 2 - Клеточная линия дермальных фибробластов группы G-Derm
Примечание: А – нативная культура. Световая микроскопия. Увеличение: - ок10 х об10, Б, В – окраска гематоксилин-эозином. Увеличение: - ок10 x об 20
Методом проточной цитофлуориметрии выявлены различия в распределении фибробластов по фазам клеточного цикла в зависимости от химико-физических свойств и пространственной организации структур скаффолдов. Так, в группе CulTw 27% фибробластов полиплоидны 2n4c (S-стадия), 27% в стадии митоза – G2-M-период, в стадии пролиферативного покоя 47% диплоидных клеток (2n2c) - G0-G1-стадия.
В группе CulGD 12% фибробластов полиплоидны 2n4c (S-стадия), 45% в стадии митоза – G2-M-период и 43% диплоидных клеток (2n2c) – G0-G1-стадия пролиферативного покоя (рис. 3).
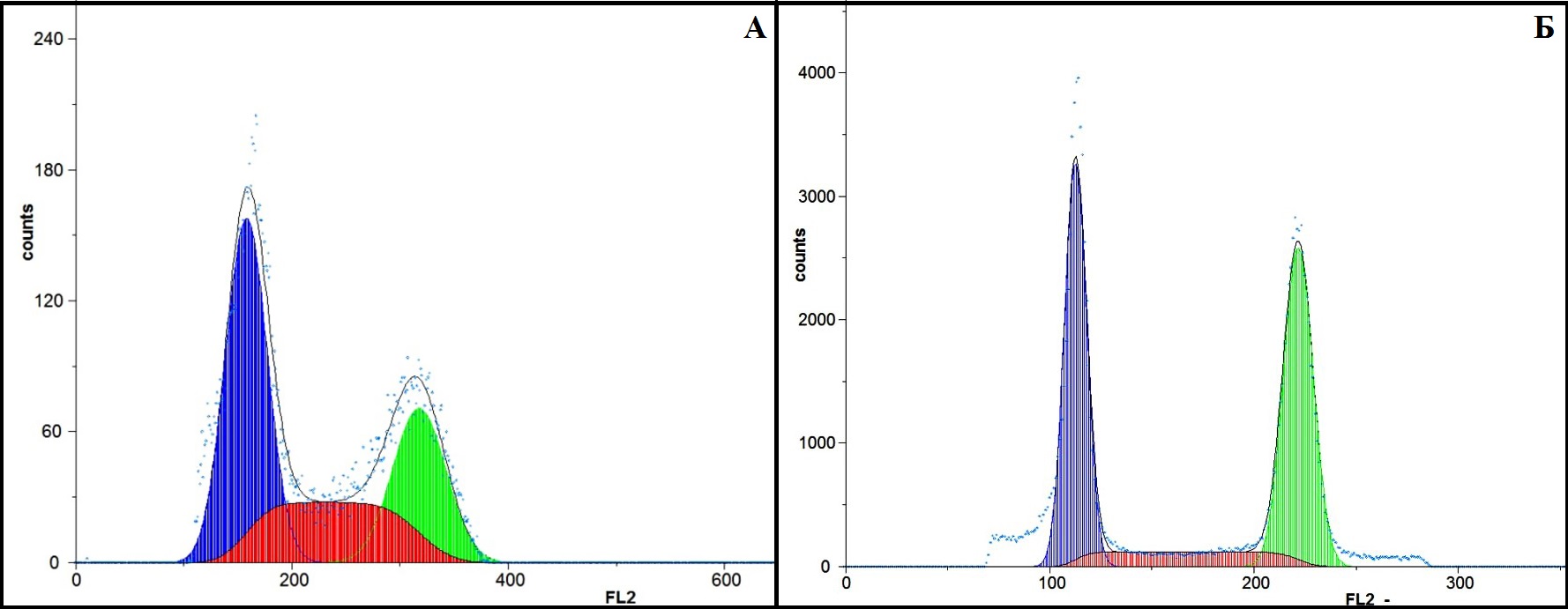
Рисунок 3 - Показатели клеточного цикла клеточной линии дермальных фибробластов группы CulTw (А) и CulGD (Б)
Примечание: окраска пропидиум йодид (PI), проточная цитофлуориметрия
3.5. Анализ путей гибели клеточной линии дермальных фибробластов в группе CulTw, CulGD
Методом проточной цитофлуориметрии выявлено, в экспериментальной группе CulTw 9% клеток проявляют признаки ранней стадии апоптоза (Annexin V+/7-AAD-), около 50% клеток на поздней стадии апоптоза (Annexin V+/7-AAD+), 20% клеток, которые погибают по пути клеточного некроза (Annexin V- 7AAD+) (рис. 4). В группе CulGD 1% клеток на ранней стадии апоптоза (Annexin V+/7-AAD-), 58% на поздней стадии апоптоза (Annexin V+/7-AAD+), и 5% клеток, погибают по пути клеточного некроза (Annexin V- 7AAD+).
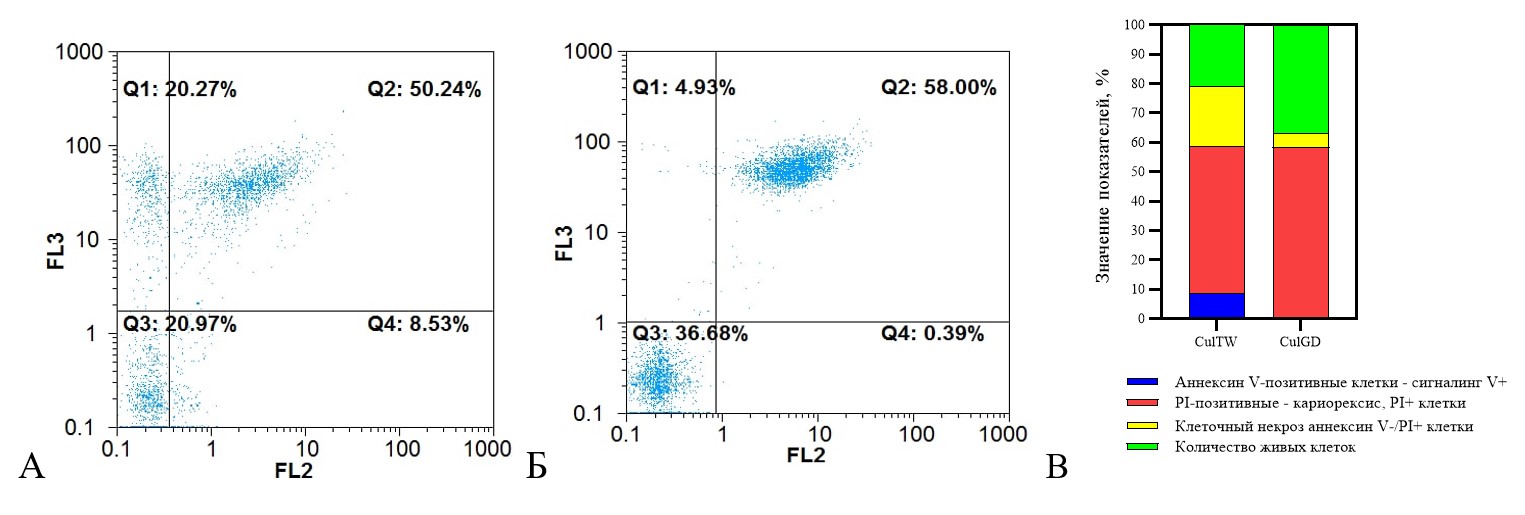
Рисунок 4 - Реализация ПКГ фибробластов
Примечание: Transwell (А) и G-derm (Б). Процентное значение показателей (В). Окраска 7AAD, Аннексин V
Классические причины, приводящие к некрозу клетки - гипертермия, ингибирование окислительного фосфорилирования, гликолиза или цикла Кребса, истощение НАД+ и АТФ, гипоксия, с активацией гена BNIP3, лизосомальных кальций-зависимых протеаз – кальпаин, катепсин, протеасомы в меньшей мере каспаз, нарушением целостности мембран, ионного гомеостаза , , . В нашем эксперименте, по всей видимости, пусковыми механизмами являются процессы, связанные с дисфункцией митохондрий и нарушением ионного гомеостаза.
4. Заключение
Таким образом, результаты проведенного комплексного анализа по определению биосовместимости скаффолдов Cytodex 3, Transwell, G-DERM которые отличаются химическим составом и пространственной организацией, с клеточной линией дермальных фибробластов выявил: веретеновидная форма и большее количество отростков, высокая кинетика роста культуры фибробластов, большой процент жизнеспособных клеток (более 95%) и бóльшее число фибробластов CD90+ (мезенхимный маркер) характерен для фибробластов растущих на Transwell и G-DERM. При этом клеточная линия фибробластов, заселенная на G-DERM с более высокой митотической активностью (G2-M-период), с бóльшим числом фибробластов CD90+ (мезенхимный маркер 89%), основной путь гибели – апоптоз (Annexin V+/7-AAD- и Annexin V+/7-AAD+).
