Difficulties in the Diagnosis of Disseminated Ewing's Sarcoma of Intrathoracic Localization (clinical observation)
Difficulties in the Diagnosis of Disseminated Ewing's Sarcoma of Intrathoracic Localization (clinical observation)
Abstract
Ewing's sarcoma of intrathoracic location is an extremely rare and prognostically unfavourable tumour. According to the literature, there are no established diagnostic and treatment programmes. Currently, there are difficulties in diagnosis, and there are no generally accepted treatment tactics. We present our own clinical observation of Ewing's sarcoma intrathoracic localization in a 63-year-old patient, where the spread of the tumour with invasion into the oesophagus, diaphragm, the presence of metastatic lesions of both lungs and liver excluded surgical intervention, and the rapidly progressive nature of the disease led to the development of multiorgan failure and caused lethal outcome in this patient.
1. Введение
Саркомы Юинга представляет собой группу злокачественных опухолей со сходными гистологическими, генетическими и имунногистохимическими характеристиками и крайне неблагоприятным прогнозом. В зависимости от происхождения выделяют 4 типа данной опухоли: костная саркома Юинга, периферическая примитивная нейроэктодермальная опухоль, опухоль Аскина и внекостная (экстраскелетная) саркома Юинга .
Первичная внутригрудная локализация опухоли является достаточно редким явлением, преимущественно встречается у детей и подростков, и наиболее часто исходит из костных структур грудной клетки (ребер, грудины, лопаток, ключиц). В настоящее время в литературе описаны только 17 случаев легочной саркомы Юинга и 7 наблюдений медиастинальной формы у взрослых , , , .
Медиастинальные формы саркомы Юинга длительно протекают бессимптомно. Диагностика заболевания вызывает трудности и требует проведения дифференциального диагноза с герминогенной опухолью, солитарной фиброзной опухолью, раком тимуса, тератомой, медиастинальной формой лимфомы . Основополагающим фактором для выбора тактики лечения является проведение гистологического исследования. Трудности при проведении верификации обусловлены значительной вариабельностью и наличием фенотипического сходства злокачественных опухолей средостения. Ввиду этого обязательным условием является проведение ИГХ и молекулярное исследование.
Хирургическое вмешательство при внутригрудной локализации возможно только при условии полной резекции опухоли. Cui M. et al., сообщили о пациенте 66 лет, у которого по данным компьютерной томографии грудной клетки имелось новообразование переднего средостения, расцененное как злокачественная тимома с инвазией в верхнюю полую вену, перикард и среднюю долю правого легкого. Пациент был оперирован в радикальном объеме. ИГХ-исследование подтвердило диагноз саркомы Юинга и наличие метастазов в медиастинальных лимфатических узлах. Пациент был выписан из стационара, однако через месяц повторно госпитализирован с клиникой сердечной недостаточности и кахексии. Анализ перикардиального выпота подтвердил наличие злокачественных клеток. Ввиду неблагоприятного прогноза, прогрессирования дыхательной недостаточности от хирургического лечения отказались. Пациент скоропостижно скончался .
При медиастинальной локализации, ввиду близкого расположения таких анатомических структур как сердце, пищевод, магистральные сосуды, высоких рисков осложнений, саркома Юинга все же чаще является нерезектабельной . В случае невозможности оперативного лечения выполняется химиотерапия, направленная на уменьшение размеров опухоли и достижения оптимального поля для проведения лучевой терапии . Однако, в настоящее время не существует единого подхода в отношении стандартной схемы химиотерапии. Tao H.T. et al., рекомендуют применять препараты платины и антрациклины . Tural D. et al., придерживаются мнения о необходимости интенсивной терапии с использованием винкристина, доксорубицина, циклофосфамида, актиномицина Д, чередуя ифосфомид и этопозид каждые 3 недели. Liu M. et al., продемонстрировали клинический случай пациентки 51 года, у которой была выявлена саркома Юинга заднего средостения 8х8 см с инвазией в пищевод, нисходящую аорту и правую легочную артерию. Проведено 4 цикла химиотерапии по схеме дакарбазин с пирарубицином с последующим проведением лучевой терапии суммарной дозой 54 Гр. Эта терапия позволила обеспечить практически полную редукцию опухолевой массы у неоперабельного пациента .
Оптимальной тактикой лечения считается комбинированная терапия: хирургическое удаление новообразования в пределах здоровых тканей с пред- или послеоперационной химиолучевой терапией. Caltavituro A. et al., выполнили удаление новообразования средостения размером 19х11х12 см у пациентки 30-ти лет. Опухоль резецирована единым блоком с межреберными мышцами, передними дугами третьего, четвертого, пятого ребра, сегментэктомией S3 и резекцией язычковых сегментов слева. Гистологическое и иммуногистохимические данные свидетельствовали о хорошо дифференцированной карциноме тимуса. Только после третьего пересмотра препаратов был подтвержден диагноз саркомы Юинга. Пациентке было рекомендовано проведение адьювантной химитерапии, от которой она отказалась в связи с желанием забеременеть. Через несколько месяцев у нее возник локальный рецидив заболевания, который дал полный ответ на 9 циклов комбинации винкристина, доксорубицина, циклофосфамида, чередующихся с ифосфамидом и этопозидом. В качестве консолидируюшей терапии пациентка получила высокодозную химиотерапию бисульфаном и мелфаланом и аутологическую трансплантацию гемопоэтических клеток .
Известно, что экстраскелетные саркомы Юинга имеют агрессивное течение. Tural D. et al., выделил следующие предикторы неблагоприятного прогноза: размер опухоли более 8 см, высокий уровень лактатдегидрогеназы в крови, наличие метастазов на момент поступления в клинику, положительный край резекции, плохой ответ на химиотерапию, проведенная только лучевая терапия . Эти факторы применимы и к медиастинальной форме сарком.
5-летняя безрецидивная выживаемость при локализованных опухолях и проведенном комбинированном лечении оценивается в 60-70%. При наличии рецидива заболевания или метастатического поражения, как у нашего пациента, 5-летняя выживаемость не достигает 25% .
Приводим собственное клиническое наблюдение. Оно заслуживает внимания потому, что является примером трудной верификации быстропрогрессирующей гигантской опухоли с локализацией в заднем средостении.
2. Основные результаты
Больной Ж., 63 лет, 27.03.2023 г. госпитализирован в отделение сосудистой хирургии ФГБУ «Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий ФМБА России» для решения вопроса о проведении хирургического вмешательства по поводу критического стеноза внутренней сонной артерии справа (85-90%). В течение месяца предъявлял жалобы на общую слабость, одышку при минимальных физических нагрузках, головокружение, необходимость в малопоточной кислородотерапии. В рамках обследования пациенту выполнена компьютерная томография органов грудной клетки 29.03.2023 г., по данным которой выявлена гигантская опухоль заднего средостения с инвазией в пищевод, диафрагму размером 204х130х202 мм и метастатическим поражением обоих легких, осложненная смещением органов средостения, двусторонним плевритом (рис. 1).
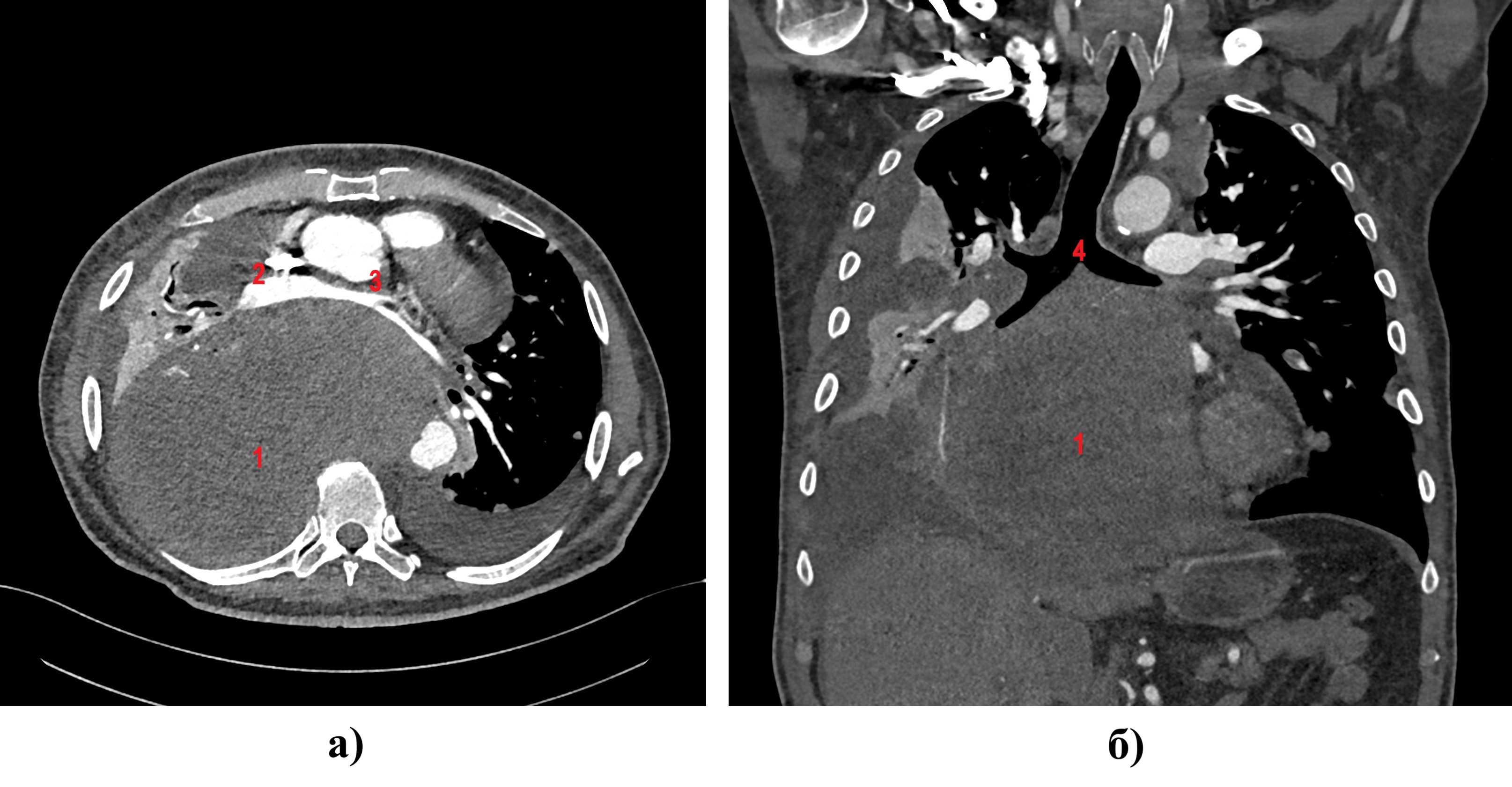
Рисунок 1 - Компьютерная томография органов грудной клетки, аксиальный (а) и коронарный (б) срезы
Примечание: 1 – опухоль, 2 – правая нижняя легочная вена, 3 – левая нижняя легочная вена, 4 – бифуркация трахеи
В рамках дифференциальной диагностики с первичной внегонадной герминогенной опухолью средостения были определены уровни хорионического гонадотропина – 1,83 мМЕ/мл (N=0-5), лактатдегидрогеназы – 135 Ед/л (N=130-480), альфа-фетопротеина – 0,99 МЕ/мл (N=0,5-5,5).
В целях получения гистологического материала выполнена трансторакальная трепан-биопсия новообразования под ультразвуковым контролем 29.03.2023 г. По данным гистологического исследования 29.03.2023 г. выявлено злокачественное новообразование преимущественно солидного строения, в фиброзированной строме опухолевые клетки формируют дуги и трабекулярные тяжи (рис. 2).
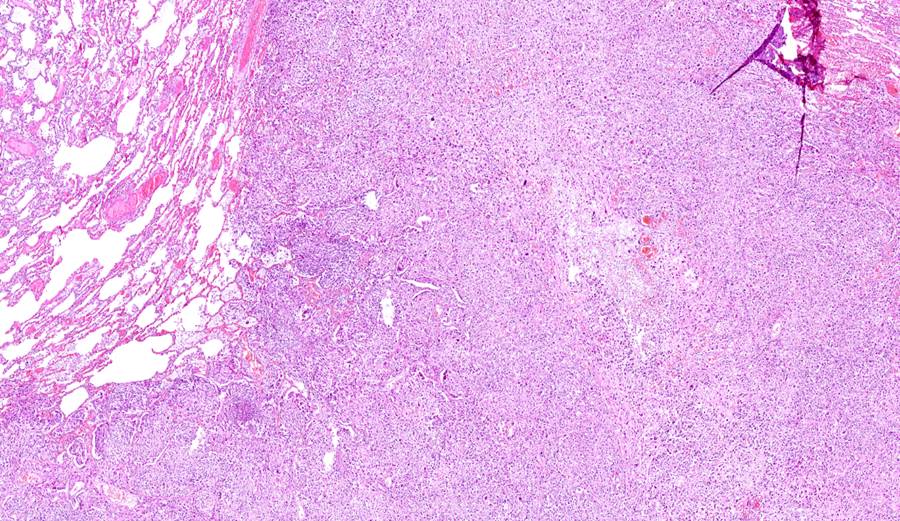
Рисунок 2 - Инфильтративный рост опухоли солидного строения в паренхиме легкого
Примечание: увеличение х40, окраска H&E
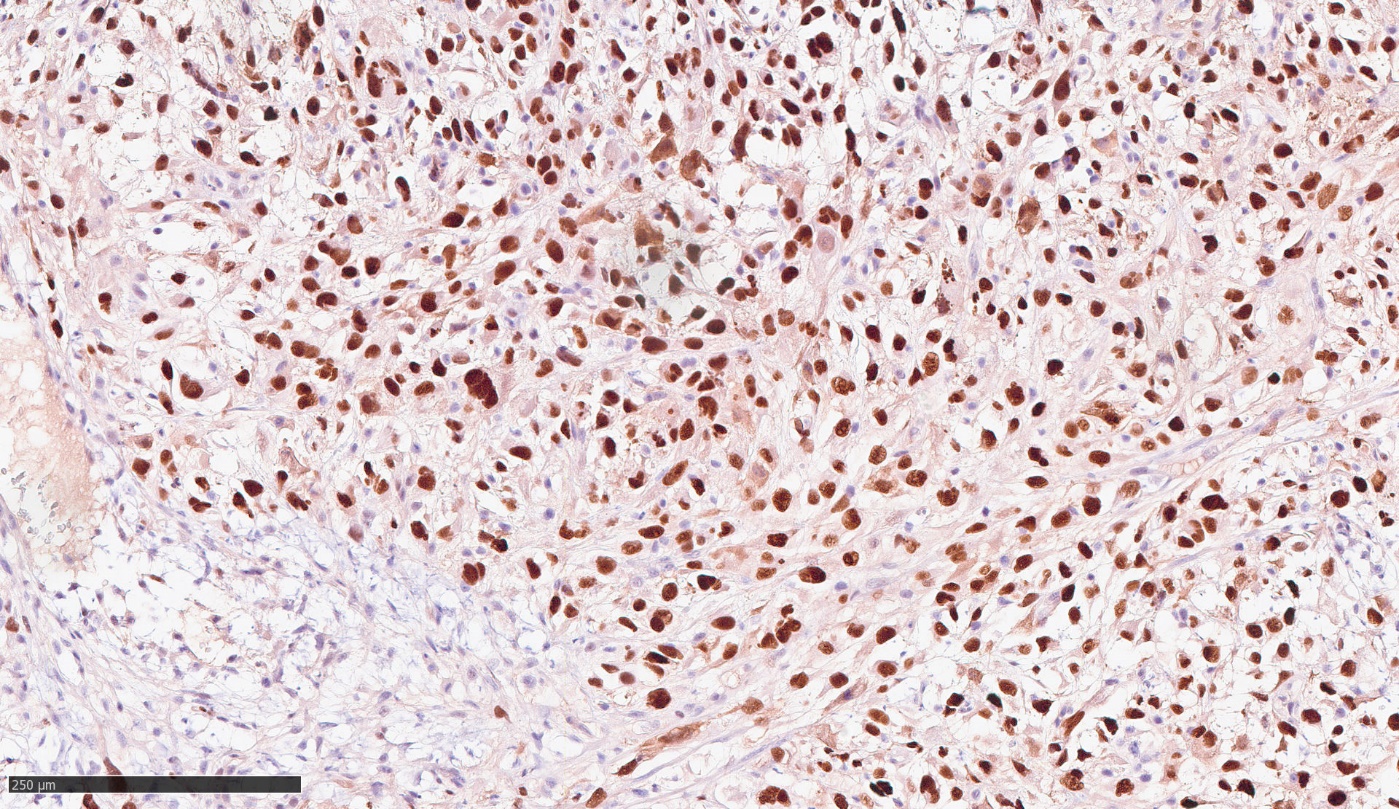
Рисунок 3 - Экспрессия CD99 в опухолевых клетках (диффузная ядерная и цитоплазматическая)
Примечание: увеличение х200
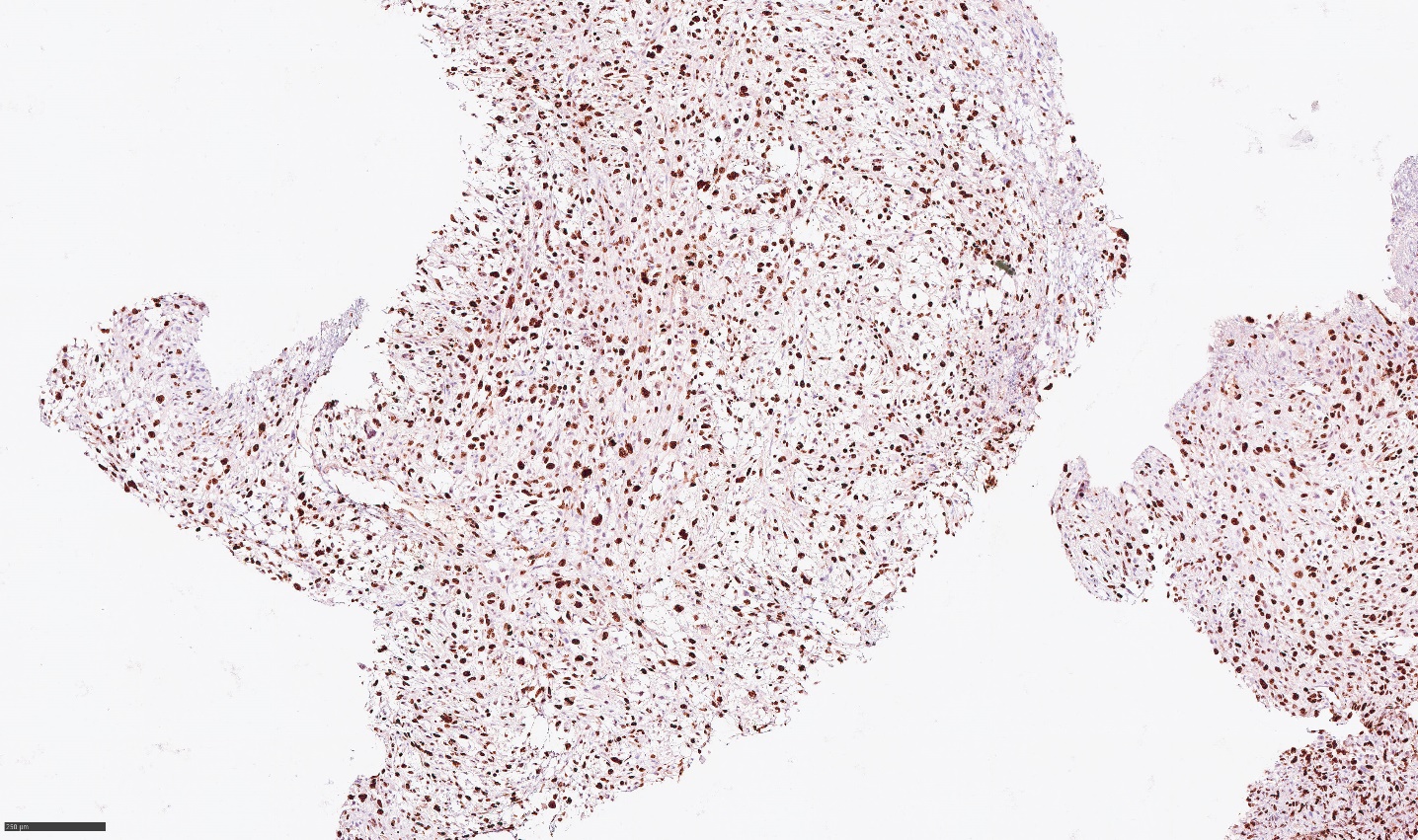
Рисунок 4 - Экспрессия р53 в опухолевых клетках (диффузная ядерная)
Примечание: увеличение х100
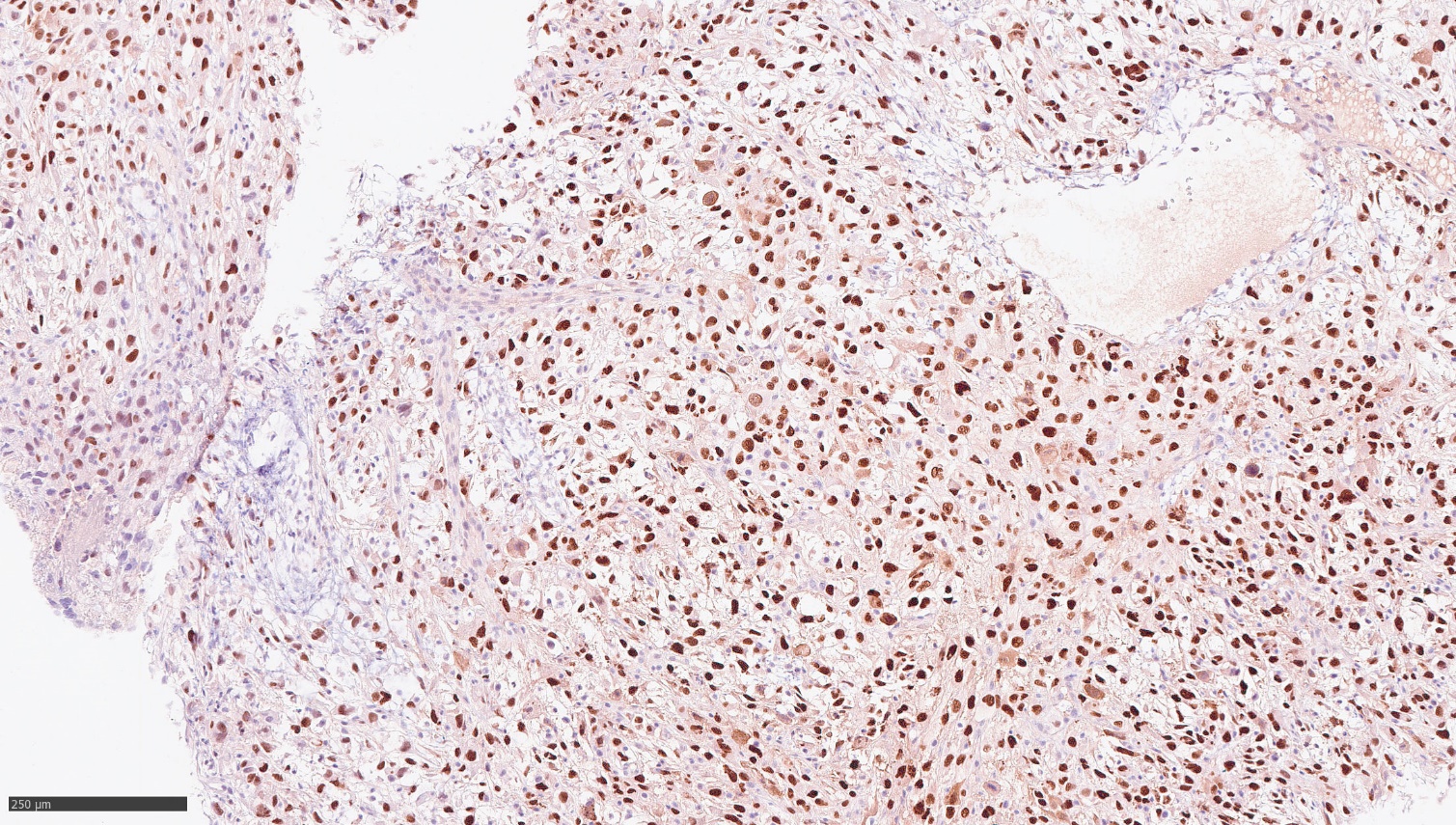
Рисунок 5 - Индекс пролиферативной активности Ki-67 ~95%
Примечание: увеличение х200
3. Заключение
Диагностика саркомы Юинга вызывает трудности и требует мультидисциплинарного подхода. Учитывая редкость заболевания особенно среди взрослого населения, в настоящее время ни одно онкологическое сообщество не регламентировало единой стратегии для обеспечения адекватного лечения медиастинальной саркомы Юинга. В приведенном нами наблюдении ввиду распространенности заболевания и наличия метастатического поражения легких и печени выполнение оперативного вмешательства было исключено, а быстрое прогрессирование онкологического процесса с развитием полиорганной недостаточности привели к невозможности выполнения химио- или лучевой терапии, что и обусловило летальный исход у данного пациента.
