МАСС-СПЕТРОСКОПИЯ АДДУКТОВ СВОБОДНЫХ РАДИКАЛОВ И ИМИНОКСИЛЬНЫХ РАДИКАЛОВ РЯДА 6-ГИДРОКСИПИРИМИДИН-4(3H)-ОНОВ
МАСС-СПЕТРОСКОПИЯ АДДУКТОВ СВОБОДНЫХ РАДИКАЛОВ И ИМИНОКСИЛЬНЫХ РАДИКАЛОВ РЯДА 6-ГИДРОКСИПИРИМИДИН-4(3H)-ОНОВ
Научная статья
Ву К.Т.1, Юдин Н.В.2, *, Фенин А.А.3
1 ORCID: 0000-0002-4989-7053;
2 ORCID: 0000-0003-4847-9105;
3 ORCID: 0000-0002-5193-3607;
1, 2, 3 Российский химико-технологический университет им. Д.И. Менделеева, Москва, Россия
* Корреспондирующий автор (yudinnik[at]gmail.com)
АннотацияИзучена масс-спектроскопия при ионизации электрораспылением (ESI) и диссоциация индуцированная соударением (CID) аддуктов, образованных при взаимодействии свободных радикалов 2-замещенных 6-гидроксипиримидин-4(3H)-онов и иминоксильных радикалов ряда 6-гидроксипиримидин-4(3H)-онов. Показано, что для них характерно образование однозарядных моно-, ди- и тримерных протонитрованных и депротонированных ионов вида [n·M+H]+ и [n·M-H]-, где n=1-3. При отрицательной ионизации наблюдается отщепление ОН· радикала с формированием ионов [n·M-OH]- (n=1-3). В положительном режиме происходит гидратация с образованием ионов [n·M+H3O]+ (n=1-3). Фрагментация аддуктов происходит по единому механизму, первой стадией которого является отщепление N-оксидного кислорода в виде гидрокси-радикала, затем следует фрагментация диоксопиримидинового цикла в конченом итоге приводящая к бициклической структуре.
Ключевые слова: 6-гидроксипиримидин-4(3H)-он, иминоксильные радикалы, аддукты, масс-спектроскопия, диссоциация индуцированная соударением.
MASS SPECTROSCOPY OF ADDUCTS OF FREE RADICALS AND IMINOXYL RADICALS OF 6-HYDROXYPYRIMIDINE-4(3H)-ONES
Research article
Vu K.T.1, Yudin N.V.2, *, Fenin A.A.3
1 ORCID: 0000-0002-4989-7053;
2 ORCID: 0000-0003-4847-9105;
3 ORCID: 0000-0002-5193-3607;
1, 2, 3 D. Mendeleev University of Chemical Technology of Russia, Moscow, Russia
* Corresponding author (yudinnik[at]gmail.com)
AbstractThe current article examines mass spectroscopy of electrospray ionization (ESI) and collision-induced dissociation (CID) of adducts formed by the interaction of free radicals of 2-substituted 6-hydroxypyrimidine-4(3H)-ones and iminoxyl radicals of 6-hydroxypyrimidine-4(3H)-ones. It is shown that they are characterized by the formation of single-charged mono -, di-and trimeric protonated and deprotonated ions of the form [n·M+H]+ and [n·M-H] -, where n=1-3. With negative ionization, the cleavage of the OH ·- radical is observed with the formation of [n·M-OH]- (n=1-3) ions. In the positive mode, hydration occurs with the formation of [n·M+H 3 O]+ ions (n=1-3). Fragmentation of adducts occurs by a single mechanism, the first stage of which is the cleavage of N-oxide oxygen in the form of hydroxyl radical followed by fragmentation of the dioxopyrimidine cycle, eventually leading to a bicyclic structure.
Keywords: 6-hydroxypyrimidine-4(3H) - oh, iminoxyl radicals, adducts, mass spectroscopy, collision-induced dissociation.
Введение
Производные пиримидина относятся к важнейшим биохимическим структурам и этим привлекают постоянный интерес исследователей. Среди них можно выделить аналог урацила - 4,6-дигидроксипиримидин (6-гидрокси-пиримидин-4(3H)-он, 1а). К его производным относится хорошо известная барбитуровая кислота (1b). В последнее время в ряду производных 4,6-дигидроксипиримидина найдены новые соединения, обладающие фермент-ингибирующей активностью [1], [2]. Нитрованием 1а предложено получать нитроформ [3]. Способ получения малочувствительного взрывчатого вещества 1,1-диамино-2,2-динитроэтилена основан на нитровании 6-гидрокси-2-метилпиримидин-4(3H)-он (1с) [4].
В предлагаемой работе представлены результаты масс-спектрометрического исследования мурексидо-подобных аддуктов, образующихся при катион-радикальном нитровании, нитрозировнии и одноэлектронном окислении производных 6-гидроксипиримидин-4(3H)-она в среде трифторуксусной кислоты (ТФУК).
Методы исследования
Исследование проводили с помощью жидкостной хромато-масс-спектрометрии (ЖХМС) при ионизации электрораспылением (ESI) в формиатно-аммиачном буфере при рН = 4,5. Для определения путей фрагментации использовали режим MSn с диссоциацией вызванной соударением (CID) при энергии 18 – 36 eV и, в ряде случаев, меченные изотопом азота N15 нитрозосоединения.
Результаты и обсуждение
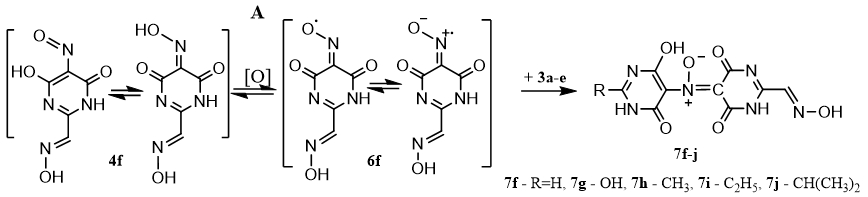
Образование аддуктов 7a-e протекает в соответствии со схемой, приведенной на рисунке 1. На первой стадии происходит окисление пиримидина 1a-е до катиона-радикала 2a-е. В условиях нитрования и нитрозирования окислителем служит ион нитрозония. В первом случае, при нитровании изопропилнитратом в среде ТФУК, азотистая кислота первоначально выделяется при его кислотно-катализируемом разложении и, далее, накапливается в ходе окислительных процессов.
Образовавшийся катион-радикал может быть превращен в нитрозо-соединение 4a-е или нитросоединение 5a-е при взаимодействии с NO· или NO2·, либо депротонирован с образованием радикалов 3а-е. Нитросоединения также образуются в результате окисления нитрозопроизводных.
Рис. 1 – Схема образования нитрозосоединений 4а-е, нитросоединений 5а-е, аддуктов 7а-е и гидроксиламинов 9а-е
5-нитрозопроизводные 4a-e находятся в равновесии с оксимой формой, в результате ее окисления образуются иминоксильные радикалы (ИР) 6a-e, что подтверждено ЭПР спектроскопией (таблица 1). Следует отметить, что при нитровании образование аддуктов происходит после индукционного периода связанного с накоплением оксидов азота и нитрозосоединений.
Таблица 1 – Спектральные параметры ЭПР иминоксильных радикалов 6а-f
| Соединение | Эксперимент | Расчет | Литература [5]* | |||
| g | aN, Гс | g | aN, Гс | g | aN, Гс | |
| 6a | 2,0042 | 31,0 | 2,0036 | 31,0 | - | - |
| 6b | 2,0039 | 32,5 | 2,0037 | 30,3 | 2,0047 | 31,71 |
| 6c | 2,0037 | 32,0 | 2,0036 | 31,1 | - | - |
| 6d | 2,0044 | 31,0 | 2,0036 | 31,0 | - | - |
| 6f | 2,0056 | 32,6 | 2,0036 | 31,0 | - | - |
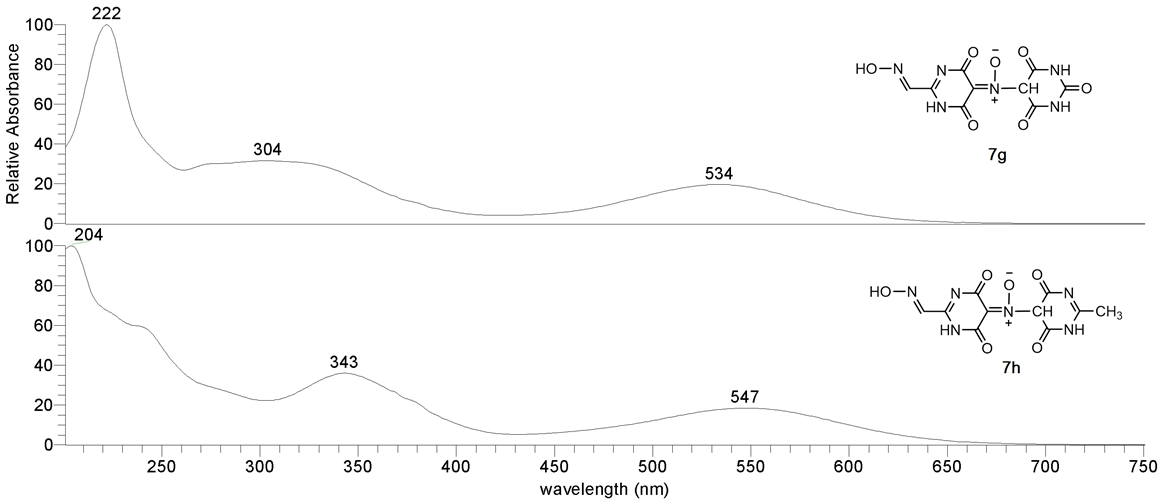
Образование аддуктов 7а-е является результатом взаимодействия иминоксильных радикалов 6а-е с радикалами исходных соединений 3а-е, рисунок 1, маршрут «А». Они, в отличие от других продуктов нитрования и нитрозирования, имеют максимум поглощения в видимой области спектра, что позволяет надежно идентифицировать их на хроматограмме или в реакционной массе. При уменьшении кислотности среды спектральная полоса претерпевает батохромный сдвиг, таблица 2, рисунок 4. Аддукты 7а-е достаточно устойчивы в растворе в ТФУК, в водно-ацетонитрильных буферных растворах (pH ~ 4.5) стабильны от 5 мин до 48 часов при комнатной температуре. Гидроксиламины 9а-е являются продуктами превращения нитроксильных радикалов, образованных в параллельном процессе по маршруту «B» в результате взаимодействия радикалов 3а-е с нитрозопроизводными 4а-е.
При введении в систему 4-гидрокси-5-нитрозо-6-оксо-1,6-дигидропиримидин-2-карбальдегид оксима (4f) индукционный период отсутствует, образующиеся радикалы быстро перехватываются ИР 6f с образованием аддуктов 7f-j и процесс идет по схеме, приведенной на рисунке 2.
Рис. 2 – Схема образования аддуктов 7f-j при взаимодействии радикалов 3a-e с ИР 6f
Аналогичный результат дает использование окислителей: диоксида свинца и солей церия (IV) которые имеют стандартный окислительно-восстановительный потенциал выше, чем у NO+ (Ео(NO+/NO) = 1.45 В, Ео(β-PbO2/Pb2+ ) = 1.46 В, Ео(Ce4+/Ce3+) = 1.61 В). Использование AgClO4 (Ео(Ag+/Ag) = 0.80 В, как окислителя с низким потенциалом не приводит к образованию аддуктов.
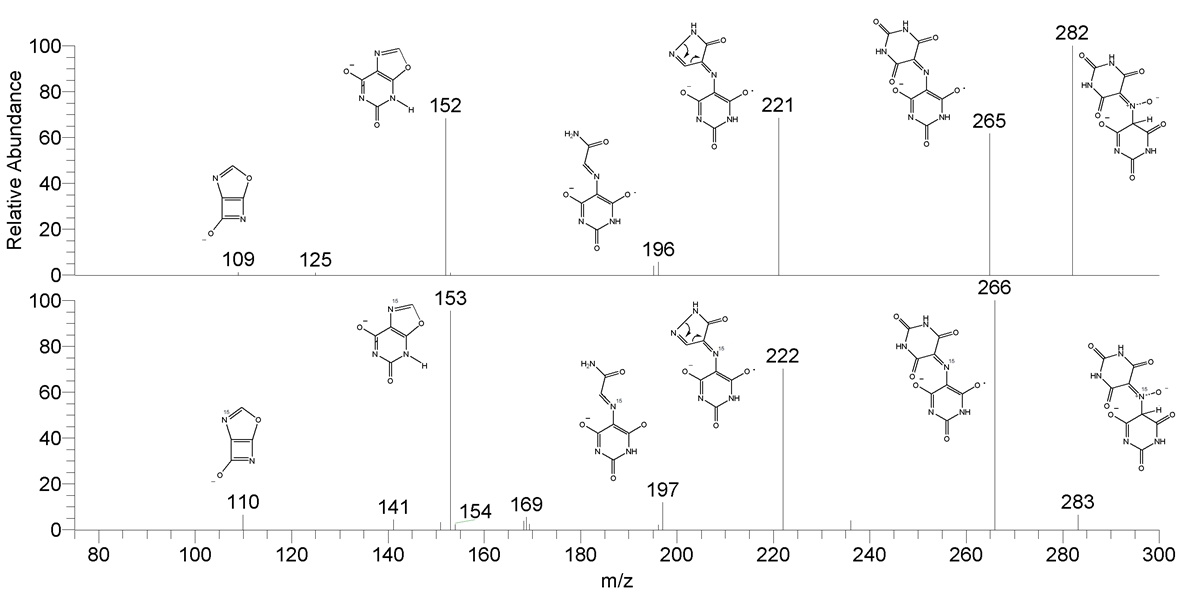
На масс-спектрах ESI аддукты, как правило, наблюдаются в виде протонитрованных [M+H]+ и депротонированных [M-H]- ионов. Для них характерно образование кластеров вида [n·M+H]+ и [n·M-H]-, n=2, 3. Наблюдается отщепление ОН· радикала с формированием ионов [M-OH]- и образование гидратированных протонированных ионов [M+H3O]+. Указанные ионы также образуют кластеры [n·M-OH]- и [n·M+H3O]+, n=2, 3.
Таблица 2 – Псевдомолекулярные ионы и положения максимума поглощения в электронных спектрах аддуктов 7a-j
| Аддукт | λmax., нм | + ESI [M+H]+ | - ESI [M-H]- | Аддукт | λmax., нм | + ESI [M+H]+ | - ESI [M-H]- |
| 7a | 513 | - | - | 7f | 513 | - | - |
| 7b | 513 | - | 282 | 7g | 513 | 311 | 309 |
| 7c | 513 | - | - | 7h | 517 | 309 | 307 |
| 7d | 518 | - | - | 7i | 530 | 323 | 321 |
| 7e | 518 | - | - | 7j | 517 | 337 | 335 |
Зарегистрированные псевдомолекулярные ионы и максимумы поглощения в видимой области спектра (в растворе в трифторуксусной кислоте) приведены таблице 2, характерный масс-спектр на рисунке 3, характерные УФ-видимые спектры на рисунке 4.
Рис. 3 – Масс-спектр ESI аддукта 7g:
сверху – отрицательные ионы; снизу – положительные ионы
Рис. 4 – УФ-вид спектры аддуктов 7g и 7h при рН=4,5 в водно/ацетонитрильном формиатно-аммиачном буфере
Строение аддуктов 7а-j близко к известному аддукту, образованному иминоксильным радикалом виолуровой кислоты и вератриловым спиртом [6] и их фрагментация также описывается схемой с образованием циклических структур [7], [8]. Кроме того, изучение фрагментации полученных аддуктов и сравнение с фрагментацией аналогичных по структуре соединений [6] и мурексида [9] также демонстрирует схожий путь.
Рис. 5 – Масс-спектр MS2 аддукта 7b. Сверху - CID 20eV:
снизу – изотопно-меченный, CID 25eV; Родительские ионы с m/z 283 и 283 соответственно
Наши исследования, проведенные с меченными N15 по нитрозогруппе виолуровой кислотой и 6-гидрокси-2-метил-5-нитрозо-пиримидин-4(3H)-оном, подтверждает такую схему фрагментации. Для изотопно-меченных соединений изменение m/z ключевых ионов соответствует предполагаемой структуре, рисунок 5.
Таким образом, при масс-спектроскопии фрагментация аддуктов 7а-j происходит по единому механизму, приведенному на рисунке 6.
На начальной стадии фрагментации родительского иона а происходит отщепление радикала ОН· с образованием мурексидо-подобного анион-радикала или катион-радикала b (в зависимости от полярности наблюдаемых ионов). Такой ход фрагментации характерен для N-оксидов [10], [11]. Затем происходят превращеня диоксопиримидинового цикла, которые, в итоге, приводит к бициклическому иону f.
Рис. 6 – Схема фрагментации аддуктов 7 в отрицательных ионах
Заключение
Проведенное исследование показало возможность взаимодействия радикалов 2-алкилзамещенных 4,6-дигидроксипиримидинов с иминоксильными радикалами ряда 4,6-дигидроксипиримидинов с образованием мурексидо-подобных аддуктов. Фрагментация полученных соединений происходит по единому механизму, первой стадией которого является отщепление N-оксидного кислорода в виде гидрокси-радикала.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Muhammad M. Syntheses of 4, 6-dihydroxypyrimidine diones, their urease inhibition, in vitro, in silico, and kinetic studies / M. T. Muhammad, K. M. Khan, A. Khan et al. // Bioorganic chemistry. – 2017. – V. 75. – P. 317–331.
- Jansa P. 5-Substituted 2-amino-4,6-dihydroxypyrimidines and 2-amino-4,6-dichloropyrimidines: synthesis and inhibitory effects on immune-activated nitric oxide production / P. Jansa, Holý, M. Dračínský et al // Med. Chem. Res. – 2014. – V. 23. – P. 4482–4490.
- Fu-qiang BI. Study on the Preparation Technique of Nitroform with High Security / Bi, B. Wang, X.G. Wang et al // Chinese Journal of Explosives and Propellants. – 2010. – V. 33. – №3. – P. 14 – 17.
- Bellamy A. FOX-7 (1,1-Diamino-2,2-dinitroethene) / A. J. Bellamy // Structure and Bonding, High Energy Density Materials: – Berlin: Springer-velag Heidelberg., 2007. – V. 125. – P. 1 - 33.
- Kim H.C. Molecular origin of the stability of violuric acid radicals at high pH-values / H.C. Kim, M. Mickel, N. Hampp // Chemical physics letters. – 2003. – 371. – №3-4. – P.410-416.
- Mickel M. Origin of the mediator losses in electrochemical delignification processes: primary and secondary reactions of violuric acid and N, N′-dimethylvioluric acid radicals with lignin model compounds / M. Mickel, H.C. Kim, N. Hampp // Green Chemistry. – 2003. – V. 5. – №1. – P.8-14.
- Demarque D. P. Fragmentation reactions using electrospray ionization mass spectrometry: an important tool for the structural elucidation and characterization of synthetic and natural products / D. P. Demarque, A. E. Crotti, R. Vessecchi et al // Natural Product Reports. – 2016. – V. 33. – №3. – P.432-455.
- Szostek B. Investigation of natural dyes occurring in historical Coptic textiles by high-performance liquid chromatography with UV–Vis and mass spectrometric detection / B. Szostek, J. Orska-Gawrys, I. Surowiec et al // Journal of Chromatography A. – 2003. – V.1012. – №2. – P. 179–192.
- Degano I. HPLC-DAD and HPLC-ESI-Q-ToF characterisation of early 20th century lake and organic pigments from Lefranc archives / I. Degano, P. Tognotti, D. Kunzelman et al // Heritage Science. – 2017. – V. 5. – №1. – P. 1-15.
- Zagorevskii D. A mass spectrometry study of tirapazamine and its metabolites: Insights into the mechanism of metabolic transformations and the characterization of reaction intermediates / D. Zagorevskii, M. Song, C. Breneman et al // Journal of the American Society for Mass Spectrometry. – 2003. – V. 14. – № – P. 881-892.
- Miao X. A tandem mass spectrometric study of the N-oxides, quinoline N-oxide, carbadox, and olaquindox, carried out at high mass accuracy using electrospray ionization / X. S. Miao, R. E. March, C. D. Metcalfe // International Journal of Mass Spectrometry. – 2003. – V. 230. – №2-3. – P.123-133.