ELECTROCHEMICAL BEHAVIOR OF SAMARIUM AND YTTERBIUM IN THE MELT EUTECTIC MIXTURE LiF-NaF-KF
ELECTROCHEMICAL BEHAVIOR OF SAMARIUM AND YTTERBIUM IN THE MELT EUTECTIC MIXTURE LiF-NaF-KF
Abstract
To create LSR, it is necessary to know the behavior of nuclear fuel components, as well as fission products formed during the reactor operation. In the work, samarium was considered as a fission product. Ytterbium was studied to compare with the electrochemically similar samarium and to test the assumptions about the behavior of samarium. In this work, the electrochemical properties of samarium (0.9 wt.%, 1.3 wt.%) and ytterbium (0.7 wt.%, 1 wt.%) in the LiF–NaF–KF melt at a temperature of 550-570 oC were studied. The working and reference electrodes were tungsten rods, glassy carbon served as the counter electrode. Cyclic and square wave voltammetry were chosen as research methods. The diffusion coefficients of Sm(III and II) and Yb(III and II) ions and the number of electrons participating in the reactions were calculated, and a conclusion was drawn about the reversibility of electrochemical reactions.
1. Введение
Жидкосолевой реактор (ЖСР), или реактор с активной зоной в виде солевого расплава, является перспективным типом реакторной установки, позволяющей перейти к замкнутому ядерному топливному циклу. В частности такой реактор может быть использован в качестве «дожигателя» долгоживущих радионуклидов. При этом появляется возможность реализации радиационноэквивалентного обращения с радиоактивными отходами (РАО). Долгоживущие радионуклиды (прежде всего нептуний и трансплутониевые элементы) можно выделить из РАО и трансмутировать («дожигать») в ЖСР, следовательно, захоронение таких отходов будет дешевле, они не требуют глубинного захоронения, их можно хранить приповерхностно.
Активную зону в ЖСР формирует расплавленная смесь из фтористых солей легких металлов и фторидов делящихся материалов. В качестве расправленной смеси в ранних конструкциях ЖСР использовали фториды лития и бериллия. Но работа с солями бериллия требует обширных мер безопасности и мониторинга здоровья. Кроме того, бериллий относится к редким элементам, его соединения дороги. Смесь LiF–NaF–KF (FLiNaK) исключает токсичные и дорогостоящие компоненты, и имея свойства близкие к LiF–BeF2, становится перспективной заменой бериллийсодержащих расплавов.
Для создания ЖСР необходимо знать поведение компонентов ядерного топлива. Элементы, относящиеся к редкоземельным металлам, (иттрий и элементы от лантана до тербия) образуются в ядерном топливе в результате реакций деления тяжёлых ядер или радиоактивного распада первичных радионуклидов деления. Основной степенью окисления редкоземельных элементов в галоидных расплавах является +3. Из указанных элементов некоторые также способны образовывать ионы с устойчивой степенью окисления +2. К таким элементам относится, в частности, самарий. Его поведение хорошо изучено в хлоридных средах , , . Во фторидных расплавах поведение самария было рассмотрено в нескольких работах , . В статье циклические вольтамперограммы снимали на вольфрамовом электроде, электродом сравнения служил никель, погруженный в исследуемы расплав. В электролите на основе FLiNaK при 500 оС было установлено, что процесс восстановления Sm(III)→Sm(II) протекает при потенциалах около –1 В. Данная реакция была охарактеризована, как необратимая. Из-за низкой воспроизводимости экспериментальных результатов коэффициенты диффузии ионов самария рассчитаны не были. В работе эксперименты проводили в расплаве LiF–BeF2, рабочим электродом была молибденовая проволока, электродом сравнения была Pt, погруженная в расплав. На циклических вольтамперограммах процесс восстановления был зарегистрирован при потенциале –0,48 В (относительно Pt). Коэффициенты диффузии ионов Sm(III) имели порядок 10–6 см2/с. В работе электрохимическое поведение самария было рассмотрено в расплавах на основе смеси LiF–CaF2. Полученные результаты были схожими с работами , .
Электрохимическое поведение иттербия хорошо изучено в хлоридных расплавах , . Однако иттербий во фторидных средах изучен слабо, открытых литературных данных по его поведению в расплаве FLiNaK найти не удалось. Тем не менее, имеются исследования, выполненные в расплаве иного состава, LiF–NaF . Циклические вольтамперограммы были измерены на молибденовом рабочем электроде. Катодный пик перезаряда Yb(III)→Yb(II) был зарегистрирован при потенциалах примерно на 0,3 В более положительных, чем потенциал разложения растворителя. Доказать обратимость перезаряда авторам не удалось. В статье исследования проводили в расплаве LiF–CaF2, рабочим электродом был молибденовый стержень, а электродом сравнения платиновая проволока, погруженная в электролит. Восстановление ионов иттербия (III) протекало по одноэлектронной схеме, реакция контролировалась диффузией. Коэффициент диффузии ионов Yb(III) составил 2,57∙10–5 см2/с.
Таким образом, анализ литературы показал, что исследования электрохимического поведения самария и иттербия в расплавах на основе фторидов щелочных металлов носят отрывочный характер. Поэтому представляло интерес провести углублённое изучение электрохимического поведения указанных элементов в среде расплавленной смеси FLiNaK, представляющей интерес для практического использования.
2. Методика эксперимента
В работе в качестве соли растворителя была использована эвтектическая смесь фторидов лития, натри и калия (массовое соотношение LiF:NaF:KF = 29:12:59). Измерения выполняли при помощи потенциостата/гальваностата AUTOLAB PGSTAT 12/30/302. Рабочим электродом служил вольфрамовый стержень диаметром 1,7 мм, площадь поверхности определяли после каждого эксперимента, на основе глубины погружения в расплав. Другой вольфрамовый стержень служил псевдоэлекртодом сравнения. В качестве противоэлектрода использовали стержень из стеклоуглерода. Исследуемы расплав, содержащий ионы Sm/Yb, готовили растворением навесок соответствующих трифторидов. Контейнером для расплава служил тигель из стеклоуглерода, помещенном в герметично закрывающуюся кварцевую ячейку. Электроды заранее размещали в необходимом положении в резиновой пробке, закрывающей ячейку, чтобы исключить их перемещение в процессе измерений. После сборки ячейку вакуумировали, помещали в высокотемпературную печь, разогретую до рабочей температуры, выдерживали под вакуумом до расплавления соли. Затем ячейку заполняли аргоном (чистотой >99,995 %) и приступали к измерениям. Температуру контролировали термопарой, расположенной вне тигля, но в тесном контакте с его внешней стенкой на уровне середины расплава. После окончания измерений отбирали пробу расплавленного электролита для последующего определения содержания исследуемого фторида металла.
3. Результаты и обсуждение
Поведение самария и иттербия в расплавленных электролитах на основе эвтектической смеси LiF–NaF–KF было исследовано методами циклической и квадратно-волновой вольтамперометрии.
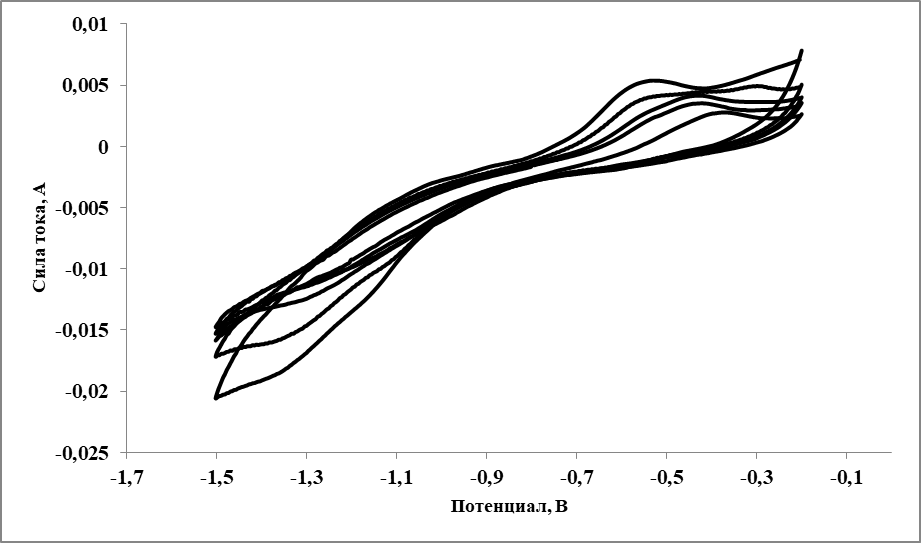
Рисунок 1 - Циклические вольтамперограммы, зарегистрированные в расплаве LiF–NaF–KF–SmF3 (0,9 мас. % Sm) при 570 oC при различных скоростях поляризации рабочего электрода
Примечание: cкорость поляризации рабочего электрода (начиная изнутри): 0,01÷0,09 В/с с шагом 0,02 В/с
Анализ циклических вольтамперограмм показал, что полученные вольтамперограммы (рисунок 1) соответствуют обратимому окислительно-восстановительному процессу, контролируемому диффузией ионов самария к поверхности электрода. Число электронов, принимающих участие в электродной реакции для данного процесса, может быть рассчитано исходя из формулы (1)
где ECp – потенциал пика катодного процесса, В;
ECp/2 – потенциал полупика катодного процесса, В;
R – универсальная газовая постоянная, 8,314 Дж/(моль К);
T – абсолютная температура, К;
F – постоянная Фарадея, 96485 Кл/моль.
Рассчитанное по данной зависимости число электронов, принимающих участие в процессе восстановления, составило примерно 1.
Полученные данные таким образом подтверждают, что наблюдаемый электрохимический процесс, соответствует восстановлению ионов Sm(III) до Sm(II).
Для обратимого, контролируемого массопереносом окислительно-восстановительного электрохимического процесса с участием растворимых окисленного и восстановленного продуктов зависимость между током пика и скоростью поляризации рабочего электрода описывается уравнением Рендлса-Шевчика, которое позволяет рассчитать коэффициенты диффузии электроактивных компонентов. На основании данного уравнения были рассчитаны коэффициенты диффузии ионов самария в исследуемом расплаве. При температуре 570 оС полученные значения составили 9,4·10–6 и 1,16·10–5 cм2/c для ионов Sm(II) и Sm(III), соответственно, аналогичные результаты получены в работе .
В качестве дополнительного метода исследования была использована квадратно-волновая вольтамперометрия. Примеры квадратно-волновых вольтамперограмм, измеренных при температуре 560 oC в расплаве FLiNaK, содержащем 1,3 мас. % самария, представлены на рисунке 2.
В отличии от циклических вольтамперограмм, на квадратно-волновых вольтамперограммах присутствовали два катодных пика, около –0,5 и –0,9 В, что указывает на протекание двух катодных реакций при близких значениях потенциалов (разница составила около 0,4 В).
С использованием выражения (2) было рассчитано число электронов, соответствующих катодным реакциям, описываемым пиками А и В.
где W1/2 – полуширина пика;
R, T и F были определены ранее.
Число электронов для пика А (около –0,5 В) и пика В (около –0,9 В) составило примерно 1 и 2, соответственно. Таким образом можно предположить, что пик А соответствует восстановлению ионов самария Sm(III)→Sm(II), а пик В восстановлению Sm(II)→Sm(0).
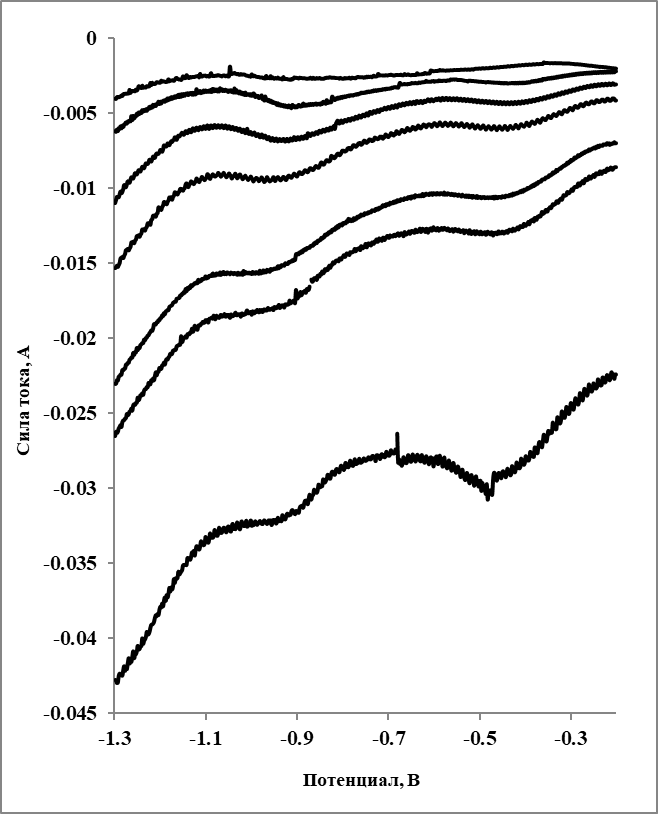
Рисунок 2 - Квадратно-волновые вольтамперограммы, зарегистрированные в расплаве LiF–NaF–KF–SmF3 при 560 oC при различных частотах, содержание Sm 1,3 мас. %
Примечание: частота (начиная сверху) - 8, 10, 20, 30, 40, 50, 60, 100, 120, 240 Гц
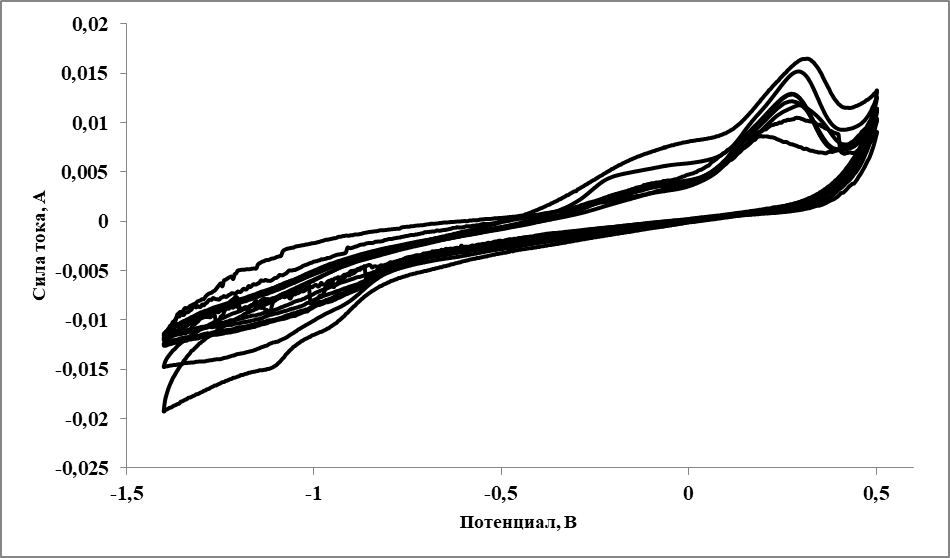
Рисунок 3 - Циклические вольтамперограммы, зарегистрированные в расплаве LiF–NaF–KF–YbF3 при 555 oC (1 мас. % Yb) при различных скоростях поляризации рабочего электрода
Примечание: скорость поляризации рабочего электрода (начиная изнутри) - 0,01, 0,02, 0,05, 0,07, 0,09, 0,1, 0,2, 0,5 В/с
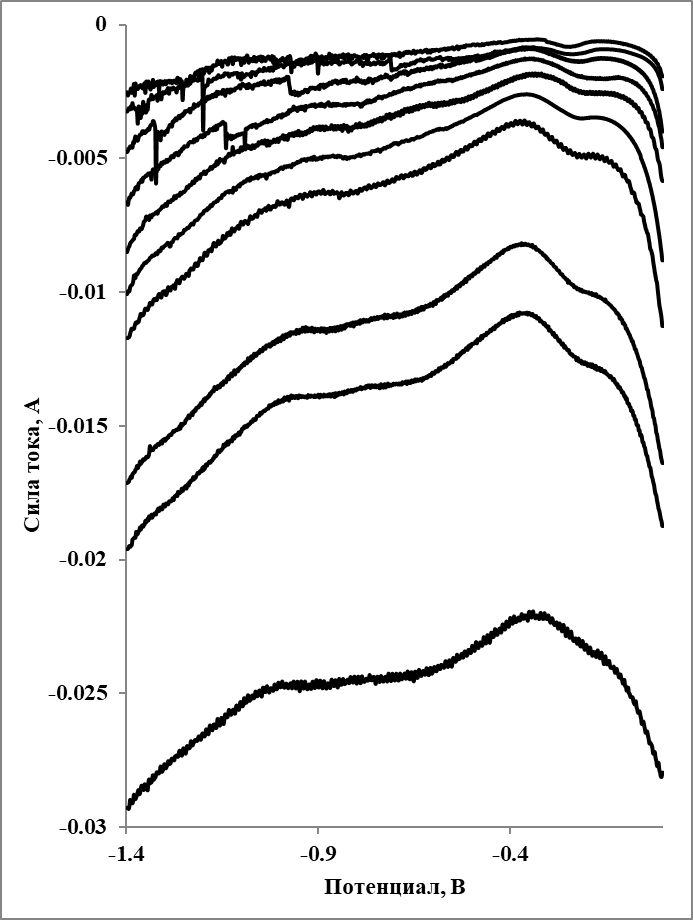
Рисунок 4 - Квадратно-волновые вольтамперограммы, зарегистрированные в расплаве LiF–NaF–KF–YbF3 (0,7 мас. % Yb) при 555 oC при различных частотах
Примечание: частота (начиная сверху) - 8, 10, 20, 30, 40, 50, 60, 100, 120, 240 Гц
Примеры квадратно-волновых вольтамперограмм, измеренных при температуре 560 oC в расплаве LiF–NaF–KF, содержащем 0,7 мас. % иттербия, представлены на рисунке 4.
Как и в случае самарийсодержащих расплавов, на квадратно-волновых вольтамперограммах видны два катодных пика, соответствующие двум процессам, обозначенным А и В, при потенциалах около –0,2 и –0,7 В, соответственно. Число электронов для пиков А и В было рассчитано по формуле (2). Полученные значения составили для пика А около трёх и пика В около единицы. В соответствии с этими величинами можно сделать предположение, что пик А соответствует восстановлению Yb(III)→Yb(0), а пик В восстановлению Yb(III)→Yb(II).
4. Заключение
В ходе выполнения работы было исследовано поведение ионов самария и иттербия в расплавах на основе тройной эвтектической смеси фторидов лития, натрия и калия. На основании результатов циклической вольтамперометрии показано, что процесс восстановления ионов самария и иттербия протекает в две стадии, первой является перезаряд Ме(III)→Me(II). Определены механизм протекания реакций и коэффициенты диффузии.
Проведённые эксперименты выявили некоторые общие черты, но и некоторые отличия в электрохимическом поведении самария и иттербия. Необходимо проведение дополнительных исследований для уточнения механизмов катодного восстановления ионов Sm(III) и Yb(III) в расплавах FLiNaK, в том числе уточнение числа электронов, принимающих участие в различных процессах.
