ПАТОФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ МЕТАБОЛИЗМА ЛИПИДОВ В СЫВОРОТКЕ КРОВИ И ТКАНЯХ ГОЛОВНОГО МОЗГА КРЫС НА ФОНЕ ОСТРОЙ ГЕМИЧЕСКОЙ ГИПОКСИИ
ПАТОФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ МЕТАБОЛИЗМА ЛИПИДОВ В СЫВОРОТКЕ КРОВИ И ТКАНЯХ ГОЛОВНОГО МОЗГА КРЫС НА ФОНЕ ОСТРОЙ ГЕМИЧЕСКОЙ ГИПОКСИИ
Аннотация
Вне зависимости от причин и условий развития гипоксия приводит к нарушению процессов биологического окисления и энергетического обмена в клетках. В настоящее время ведется активный поиск фармакологических средств защиты от гипоксии – антигипоксантов. Перспективными антигипоксантами являются экстракты смородины черной и малины лекарственной, так как они обладают широким спектром биофлавоноидов, алкалоидов, микроэлементов и других биологически активных веществ. Цель исследования – изучить изменения метаболизма липидов в сыворотке крови и тканях головного мозга крыс на фоне острой гемической гипоксии и применении растительных антигипосантов. Исследования произведены на 60 белых беспородных крысах. Животные были разделены поровну на 6 групп. Одна группа – интактные крысы (нулевая группа). Животные 1 группы получали в течение недели до моделирования гипоксии экстракт смородины черной в дозе 100 мг/кг массы; животные 2 группы получали в аналогичный период и той же дозе экстракт малины лекарственной; животные 3 группы – цитохром С (в качестве эталонного антигипоксанта) в рекомендуемой дозе; животные 4 группы – получали смесь экстрактов смородины черной и малины лекарственной в соотношении 1:1 в дозе 200 мг/кг массы, а животные 5 группы – контроль, получавшие дистиллированную воду по аналогичной схеме в эквивалентном объеме. Антигипоксическое действие растительных экстрактов исследовали на модели гемической гипоксии. Липопротеины определяли электрофоретическим способом по стандартной методике при использовании стандартных наборов химических реактивов фирмы «Лахема» (Чехия). Фосфолипидный спектр определяли методом тонкослойной хроматографии с использованием силиконовых пластин фирмы «Силуфол» (Чехия). На фоне острой гемической гипоксии развиваются нарушения метаболизма липидов, характеризующиеся уменьшением доли суммарных фосфолипидов, концентрации PHH и ЛПВП и повышением концентрации ЛПНП, ЛПОНП, триглицеридов, общего холестерина и LPH, а расчет индексов атерогенности, Castelli 1 и 2 и атерогенного индекса плазмы подтверждают развитие выраженной дислипопротеинемии. Использование антигипоксантов нивелирует негативное влияние гемической гипоксии на липидный обмен в тканях головного мозга и сыворотке крови крыс и наиболее выраженный положительный эффект наблюдается при применении смеси экстрактов малины лекарственной и смородины черной в соотношении 1:1.
1. Введение
Клеточные и внутриклеточные мембраны играют ключевую роль в жизнедеятельности клеток и поэтому любое их повреждение сопровождается развитием тяжелых патологических состояний
, . Важным компонентом клеточных мембран являются липиды, за счет которых и реализуются барьерная и структурная функция. Нарушение барьерных свойств мембран или нарушение их вязкости приводит к изменениям работы мембранных структур клетки, дезорганизации жизнедеятельности клетки и заболеваниям организма . Основу жизнедеятельности клетки составляет ее энергетика, определяющая нормальное протекание энергопродуцирующих и энергопотребляющих процессов и, соответственно, все остальные клеточные функции , , . Вне зависимости от причин и условий развития гипоксия приводит к нарушению процессов биологического окисления и энергетического обмена в клетках. Кислородный дефицит является неблагоприятным условием для протекания реакций аэробного гликолиза, окислительного декарбоксилирования пирувата, цикла трикарбоновых кислот (ЦТК) и окислительного фосфорилирования. В связи с этим неизбежными следствиями гипоксии являются развитие энергетического дефицита, сдвиг клеточного метаболизма в сторону катаболических реакций, истощение запасов гликогена и активация реакций протеолиза. Преобладание анаэробного гликолиза приводит к накоплению избыточных количеств лактата с развитием ацидоза. Уменьшение продукции пирувата и, как следствие, ацетил-коэнзима А (ацетил-КоА) препятствует нормальному протеканию ключевых стадий ЦТК, процессов посттрансляционного ацетилирования белков, синтеза холестерола и других стероидов, высших жирных кислот, ацетилхолина, мелатонина и других биологически активных соединений , , .Резкое снижение продукции АТФ сопровождается дисфункцией Na+/K+-АТФ-азы и нарушением процесса формирования мембранных потенциалов, а также повреждением элементов цитоскелета и транспортных систем клетки. Увеличение цитоплазматического pH приводит к повышению проницаемости мембран лизосом и разрушению клеточных структур под действием лизосомальных гидролаз. Важнейшим звеном патогенеза гипоксии являются активация процессов перекисного окисления липидов, увеличение продукции активных форм кислорода (АФК) и развитие оксидативного стресса
.Гемическая гипоксия – это вид гипоксии эндогенного происхождения, возникающий в результате уменьшения эффективной кислородной емкости крови и ее кислород транспортирующей функции. В основе патогенеза гемической гипоксии лежит гипоксемия, которая сопровождается снижением артерио-венозной разницы по кислороду и может сопровождаться нарушением биологического окисления.
Известно, что при различных видах гипоксии отмечается значительное повышение некоторых высокоактивных метаболитов фосфолипидов, приводящих к токсическому повреждению тканей. Поэтому в понимании нарушений метаболических процессов важное значение следует придавать изучению изменений в абсолютном содержании не только отдельных фосфолипидов, но и изменениям относительного содержания их в сумме фосфолипидов, так как каждой отдельной фракции и их соотношениям принадлежит своя специфическая роль в сложных процессах обмена веществ
, , , .Цель исследования – изучить изменения метаболизма липидов в сыворотке крови и тканях головного мозга крыс на фоне острой гемической гипоксии.
2. Методы и принципы исследования
Исследования произведены на 60 белых беспородных крысах, массой 240-260 г. Перед началом экспериментов животные, отвечающие критериям включения в эксперимент, распределялись на группы с учетом пола, возраста, массы и принципа рандомизации.
Животные были разделены поровну на 6 групп. Одна группа – интактные крысы (нулевая группа). Животные 1 группы получали в течение недели до моделирования гипоксии экстракт смородины черной в дозе 100 мг/кг массы; животные 2 группы получали в аналогичный период и той же дозе экстракт малины лекарственной; животные 3 группы – цитохром С (в качестве эталонного антигипоксанта) в рекомендуемой дозе; животные 4 группы – получали смесь экстрактов смородины черной и малины лекарственной в соотношении 1:1 в дозе 200 мг/кг массы, а животные 5 группы – контроль, получавшие дистиллированную воду по аналогичной схеме в эквивалентном объеме.1. Антигипосакнты вводили в течение 7 дней до моделирвоания гипоксии внутрижелудочно с помощью зонда ежедневно, однократно.
Цитохром С разводили физиологическим раствором и вводили крысам внутримышечно также в течение 7 суток в дозе 0,1 мг/кг живой массы активного вещества.
Антигипоксическое действие растительных экстрактов исследовали на модели гемической гипоксии, которую воспроизводили путем однократного внутрибрюшинного введения нитрита натрия в дозе DL100 (200 мг/кг)
.Липопротеины определяли электрофоретическим способом по стандартной методике при использовании стандартных наборов химических реактивов фирмы «Лахема» (Чехия). Фосфолипидный спектр определяли методом тонкослойной хроматографии с использованием силиконовых пластин фирмы «Силуфол» (Чехия)
. На основании полученных данных был произведен расчет индекса атерогенности, атерогенного индекса плазмы и индексы Castelli 1 и 2 для сыворотки крови крыс и индекс атерогенности, а также индексы Castelli 1 и 2 для тканей головного мозга . Цифровой материал эксперимента обрабатывали с помощью параметрических и непараметрических методов анализа.3. Основные результаты
Первоначально были произведены исследования изменений концентраций различных фракций липидов и фосфолипидов в сыворотке крови крыс и результаты эксперимента представлены в таблицах 1 и 2.
Таблица 1 - Изменение содержания различных фракций фосфолипидов в сыворотке крови у крыс при гемической гипоксии на фоне нагрузки антигипоксантами растительного происхождения
Группы | Показатель | ||||||
PHH | PHEA | PHS | KL | S | LPH | Всего | |
0 | 92,3±3,23 | 66,4±2,12 | 37,2±1,33 | 14,4±0,51 | 32,3±1,16 | 3,01±0,11 | 245,61±8,84 |
1 | 80,6±2,911 | 75,4±2,631 | 30,3±1,111 | 16,7±0,621,2 | 25,4±0,911,2 | 3,95±0,151,2 | 232,35±8,13 |
1 < 0 на 12,6 % | 1 > 0 на 13,6 % | 1 < 0 на 18,5 % | 1 > 0 на 15,9 % | 1 < 0 на 21,4 % | 1 > 0 на 31,2 % | 1 < 0 на 5,4 % | |
1 > 5 на 5,2 % | 1 < 5 на 4,8 % | 1 > 5 на 6,7 % | 1 < 5 на 12,6 % | 1 > 5 на 10,0 % | 1 < 5 на 27,5 % | 1≈5 | |
2 | 78,4±2,831 | 73,6±2,871,2 | 29,1±1,051 | 18,2±0,661 | 26,2±1,031,2 | 4,12±0,171,2 | 229,62±7,81 |
2 < 0 на 15,1 % | 2 > 0 на 10,8 % | 2 < 0 на 21,8 % | 2 > 0 на 26,4 % | 2 < 0 на 18,9 % | 2 > 0 на 36,9 % | 2 < 0 на 6,5 % | |
2 > 5 на 2,3 % | 2 < 5 на 7,1 % | 2 > 5 на 2,5 % | 2 < 5 на 4,7 % | 2 > 5 на 13,4 % | 2 < 5 на 24,4 % | 2≈5 | |
3 | 79,1±2,951 | 74,8±2,511 | 30,5±0,971,2 | 17,4±0,551,2 | 27,4±1,041,2 | 4,39±0,211,2 | 233,59±8,43 |
3 < 0 на 14,3 % | 3 > 0 на 12,7 % | 3 < 0 на 18,0 % | 3 > 0 на 20,8 % | 3 < 0 на 15,2 % | 3 > 0 на 45,8 % | 3 < 0 на 4,9 % | |
3 > 5 на 3,2 % | 3 < 5 на 5,6 % | 3 > 5 на 7,4 % | 7 < 5 на 8,9 % | 7 > 5 на 18,6 % | 7 < 5 на 19,4 % | 3≈5 | |
4 | 84,3±3,051,2 | 73,4±2,711,2 | 32,3±1,161 | 15,9±0,641,2 | 28,8±1,081,2 | 3,41±0,121,2 | 238,11±7,38 |
4 < 0 на 8,7 % | 4 > 0 на 10,5 % | 4 < 0 на 13,2 % | 4 > 0 на 10,4 % | 4 < 0 на 10,8 % | 4 > 0 на 13,3 % | 4 < 0 на 3,1 % | |
4 > 5 на 10,1 % | 4 < 5 на 7,3 % | 4 > 5 на 13,7 % | 4 < 5 на 16,8 % | 4 > 5 на 24,7 % | 4 < 5 на 37,4 % | 4≈5 | |
5 | 76,6±2,861 | 79,2±3,011 | 28,4±1,031 | 19,1±0,751 | 23,1±0,841 | 5,45±0,191 | 231,85±8,11 |
5 < 0 на 17,1 % | 5 > 0 на 19,3 % | 5 < 0 на 23,7 % | 5 > 0 на 32,6 % | 5 < 0 на 24,5 % | 5 > 0 на 81,1 % | 5 < 0 на 5,6 % | |
Примечание: PHH – фосфатидилхолин, PHEA - фосфатидилэтаноламин, PHS – фосфатидилсерин, KL – кардиолипин, S – сфингомиелин, LPH – лизофосфолипид. Различия достоверны при P < 0,05: 1 – по сравнению с показателями интактных животных; 2 – по сравнению с показателями контрольной группы
По результатам эксперимента, представленным в таблице 1, видно, что на фоне острой гемической гипоксии у крыс в сыворотке крови происходит снижение концентрации фосфатидилхолина, фосфатидилсерина, сфингомиелина и всех фракций фосфолипидов, а также наблюдается рост концентрации фосфатидилэтаноламина, кардиолипин и лизофосфолипид.
В сыворотке крови крыс при гемической гипоксии без коррекции установлено снижение соотношения сфингомиелина к фосфатидилхолину на 14,3% по сравнению с интактными животными, что свидетельствует о снижении жесткости липидной фазы мембраны, но при применении антигипоксантов снижение соотношения сфингомиелина к фосфатидилхолину было не столь значительным. В целом снижение коэффициента S/PHH предполагает интенсификацию жидкостных свойств мембран и снижение микровязкости липидного слоя. Уменьшение уровня фосфатидилхолина приводит к умеренному снижению отношения нейтральных фосфолипидов к кислым фосфолипидам, которое является индикатором интенсивности обмениваемости фосфолипидов в данный момент.
Также у крыс на фоне гемической гипоксии установлено возрастание концентрации легкоокисляемых липидов, о чем свидетельствует снижение соотношения PHH/PHEA на 30,3% по отношению к показателям интактных крыс, при этом у животных на фоне приема антигипоксантов данный коэффициент снизился не так значительно относительно интактных животных: у животных 1 и 2 групп он был ниже, чем у интактных крыс на 23,0%; у животных 3 группы – ниже на 23,7%, а у крыс 4 группы – ниже на 17,3%. Установлено снижение концентрации в сыворотке крови фостфатидилхолина, что приводит к возрастанию уровня лизофосфолипидов и метаболитов глицерофосфолипидов и это, в свою очередь, приводит к подавлению окислительно-восстановительных процессов и разрушению биологических мембран.
Таблица 2 - Различные фракции липидов в сыворотке крови у крыс при гемической гипоксии на фоне нагрузки растительными антигипоксантами
Группы
| Показатель | ||||
ЛПВП, ммоль/л | ЛПНП, ммоль/л | ЛПОНП, ммоль/л | Триглицериды, ммоль/л | Общий холестерин, ммоль/л | |
0 | 1,29±0,05 | 2,36±0,08 | 0,54±0,02 | 1,19±0,04 | 3,81±0,13 |
1 | 1,04±0,041,2 | 2,65±0,091,2 | 0,62±0,031,2 | 1,47±0,051,2 | 4,61±0,171 |
1 < 0 на 19,4 % | 1 > 0 на 12,3 % | 1 > 0 на 14,8 % | 1 > 0 на 23,5 % | 1 > 0 на 21,0 % | |
1 > 5 на 11,8 % | 1 < 5 на 14,2 % | 1 < 5 на 11,4 % | 1 < 5 на 9,3 % | 1 < 5 на 8,7 % | |
2 | 1,11±0,051,2 | 2,71±0,101,2 | 0,65±0,021 | 1,52±0,061 | 4,51±0,161,2 |
2 < 0 на 14,0 % | 2 > 0 на 14,8 % | 2 > 0 на 20,3 % | 2 > 0 на 27,7 % | 2 > 0 на 18,4 % | |
2 > 5 на 19,4 % | 2 < 5 на 12,3 % | 2 < 5 на 7,1 % | 2 < 5 на 6,2 % | 2 < 5 на 10,7 % | |
3 | 1,09±0,031,2 | 2,78±0,121,2 | 0,64±0,031 | 1,49±0,051 | 4,57±0,171,2 |
3 < 0 на 15,5 % | 3 > 0 на 17,8 % | 3 > 0 на 18,5 % | 3 > 0 на 25,2 % | 3 > 0 на 20,0 % | |
3 > 5 на 17,2 % | 3 < 5 на 10,0 % | 3 < 5 на 8,5 % | 3< 5 на 8,0 % | 3< 5 на 9,5 % | |
4 | 1,17±0,041,2 | 2,57±0,111,2 | 0,59±0,031,2 | 1,38±0,041,2 | 4,15±0,151,2 |
4 < 0 на 9,3 % | 4 > 0 на 8,9 % | 4 > 0 на 9,3 % | 4 > 0 на 16,0 % | 4 > 0 на 8,9 % | |
4 > 5 на 25,8 % | 4 < 5 на 16,8 % | 4 < 5 на 15,7 % | 4 < 5 на 14,8 % | 4 < 5 на 17,8 % | |
5 | 0,93±0,031 | 3,09±0,111 | 0,70±0,041 | 1,62±0,051 | 5,05±0,181 |
5 < 0 на 27,9 % | 5 > 0 на 30,9 % | 5 > 0 на 29,6 % | 5 > 0 на 36,1 % | 5 > 0 на 32,5 % | |
Примечание: Различия достоверны при P < 0,05: 1 – по сравнению с показателями интактных животных; 2 – по сравнению с показателями контрольной группы
Согласно табличным данным, на фоне гемической гипоксии в сыворотке крови установлено снижение концентрации ЛПВП и повышение концентрации ЛПНП, ЛПОНП, триглицеридов и общего холестерина.
Для выявления особенностей метаболических нарушений при гипоксии и других патологических состояниях большое значение имеют не абсолютные значения концентрации липидов в сыворотке крови или других тканях организма, а баланс атерогенных и антиатерогенных липопротеидов. Поэтому в клинических исследованиях для оценки дисбаланса обмена липидов используют расчетные индексы.
На основании полученных данных был произведен расчет индекса атерогенности, атерогенного индекса плазмы и индексы Castelli 1 и 2 (рис. 1, 2 и 3).
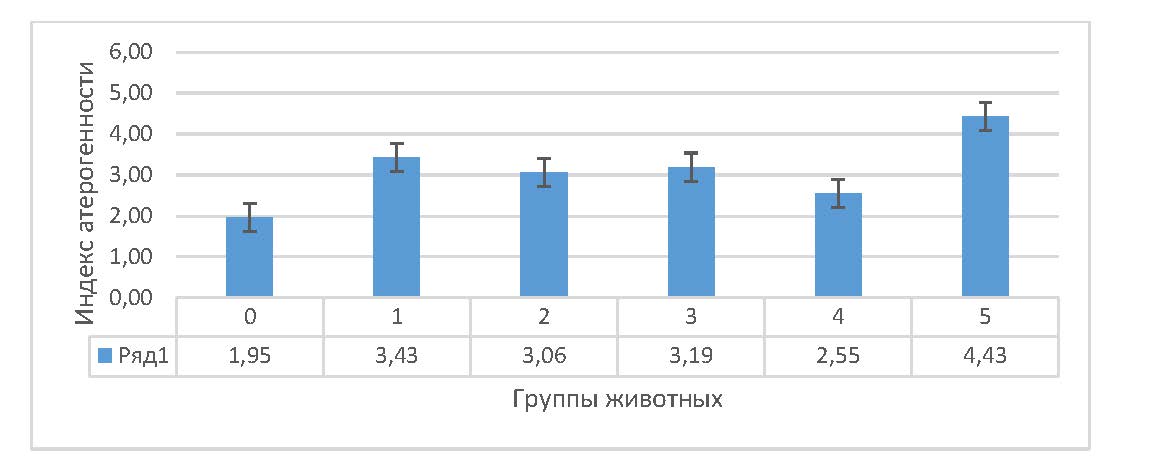
Рисунок 1 - Индекс атерогенности сыворотки крови крыс на фоне гемической гипоксии и ее коррекции антигипоксантами
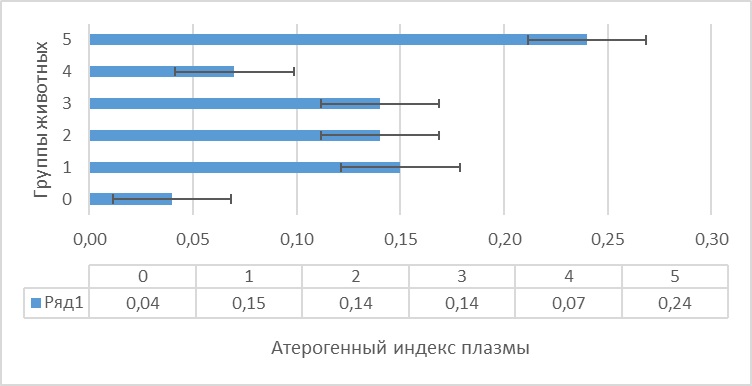
Рисунок 2 - Атерогенный индекс плазмы крыс на фоне гемической гипоксии и ее коррекции антигипоксантами
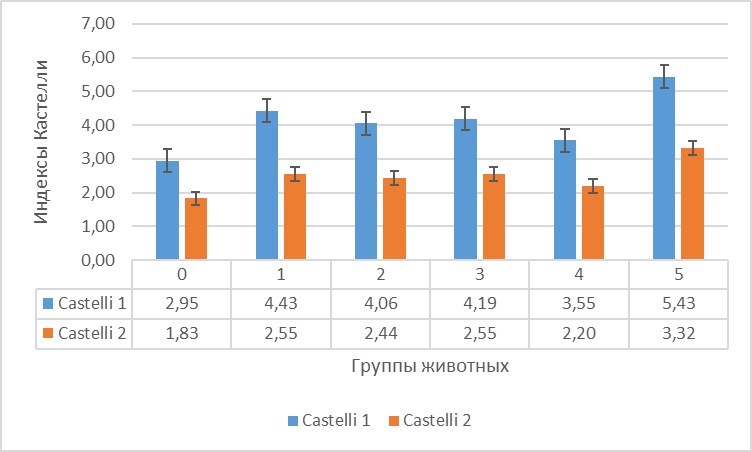
Рисунок 3 - Индексы Castelli 1 и 2 плазмы крыс на фоне гемической гипоксии и ее коррекции антигипоксантами
В отношении индекса Castelli 2 было установлено, что у животных 5 группы он был больше, чем у интактных крыс на 81,4%, при этом у крыс, получавших антигипоксанты этот индекс также был больше, чем у интактных животных: в 1 группе – выше на 39,3%; во 2 группе – выше на 33,3%, в 3 группе – выше на 39,3%, а в 4 группе – выше на 20,2%, но существенно ниже, чем у крыс контрольной группы: в 1 группе – ниже на 23,2%; во 2 группе – ниже на 26,5%, в 3 группе – ниже на 23,2%, а в 4 группе – ниже на 33,7%.
Установленный факт, что головной мозг характеризуется высоким содержанием липидов и они являются не только структурными компонентами, но и важнейшими участниками его функциональной активности. Фосфолипидный состав нервной ткани практически постоянен, вследствие защищенности ЦНС от различных внешних воздействий и его изменение рассматривается обычно как патология. При острой гемической гипоксии установлены изменения концентрации различных фракций фосфолипидов в тканях головного мозга крыс и они отражены в таблице 3.
Таблица 3 - Изменение содержания различных фракций фосфолипидов в тканях головного мозга у крыс при гемической гипоксии на фоне нагрузки антигипоксантами растительного происхождения
Группы | Показатель | ||||||
PHH | PHEA | PHS | KL | S | LPH | Всего | |
Интактные | 36,2±1,37 | 16,4±0,62 | 13,4±0,52 | 9,8±0,37 | 10,6±0,41 | 7,0±0,24 | 93,4±3,36 |
1 | 30,7±1,071 | 13,1±0,511 | 11,8±0,361 | 7,9±0,271,2 | 14,2±0,541,2 | 8,1±0,291,2 | 85,8±3,001 |
1 < 0 на 15,2 % | 1 < 0 на 20,1 % | 1 < 0 на 11,9 % | 1 < 0 на 19,4 % | 1 > 0 на 34,0 % | 1 > 0 на 15,7 % | 1 < 0 на 8,1 % | |
1 > 5 на 4,1 % | 1 > 5 на 4,0 % | 1 > 5 на 1,7 % | 1 > 5 на 16,2 % | 1 < 5 на 9,6 % | 1 < 5 на 26,4 % | 1≈5 | |
2 | 30,9±0,981 | 13,8±0,581,2 | 12,0±0,441 | 8,1±0,331,2 | 14,7±0,501 | 8,8±0,261,2 | 88,3±3,35 |
2 < 0 на 14,6 % | 2 < 0 на 15,9 % | 2 < 0 на 10,4 % | 2 < 0 на 17,3 % | 2 > 0 на 38,7 % | 2 > 0 на 25,7 % | 2 < 0 на 5,5 % | |
2 > 5 на 4,7 % | 2 > 5 на 9,5 % | 4 > 5 на 3,4 % | 4 > 5 на 19,1 % | 4 < 5 на 6,4 % | 4 < 5 на 20,0 % | 2≈5 | |
3 | 30,2±1,111 | 13,4±0,371 | 11,9±0,391 | 8,0±0,311,2 | 14,3±0,521,2 | 8,6±0,311,2 | 86,4±2,681 |
3 < 0 на 16,6 % | 3 < 0 на 18,3 % | 3 < 0 на 11,2 % | 3 < 0 на 18,4 % | 3 > 0 на 34,9 % | 3 > 0 на 22,9 % | 3 < 0 на 7,5 % | |
3 > 5 на 2,4 % | 3 > 5 на 6,3 % | 3 > 5 на 2,6 % | 3 > 5 на 17,6 % | 3 < 5 на 8,9 % | 3 < 5 на 21,8 % | 3≈5 | |
4 | 31,5±1,131 | 14,6±0,541,2 | 12,2±0,461 | 8,7±0,291,2 | 13,1±0,471,2 | 7,9±0,241,2 | 88,0±3,31 |
4 < 0 на 13,0 % | 4 < 0 на 11,0 % | 4 < 0 на 9,0 % | 4 < 0 на 11,2 % | 4 > 0 на 23,6 % | 4 > 0 на 12,9 % | 4 < 0 на 5,8 % | |
4 > 5 на 6,8 % | 4 > 5 на 15,9 % | 4 > 5 на 5,2 % | 4 > 5 на 27,9 % | 4 < 5 на 16,6 % | 4 < 5 на 18,6 % | 4≈5 | |
5 | 29,5±1,091 | 12,6±0,421 | 11,6±0,421 | 6,8±0,271,2 | 15,7±0,611 | 9,7±0,341 | 85,9±3,191 |
5 < 0 на 18,5 % | 5 < 0 на 23,2 % | 5 < 0 на 13,4 % | 5 < 0 на 30,6 % | 5 < 0 на 48,1 % | 5 < 0 на 38,6 % | 5 < 0 на 8,0 % | |
Примечание: различия достоверны при P < 0,05: 1 – по сравнению с показателями интактных животных; 2 – по сравнению с показателями контрольной группы
Согласно представленным данным, установлено, что в тканях мозга крыс при гемической гипоксии наблюдается уменьшение концентрации фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина, кардиолипина и повышение концентрации сфингомиелина и лизофосфолипида, что отражается некоторым снижением общей концентрации фракций фосфолипидов.
В тканях головного мозга крыс при гемической гипоксии без коррекции установлено возрастание соотношения сфингомиелина к фосфатидилхолину на 81,8% по сравнению с интактными животными, что свидетельствует о росте жесткости липидной фазы мембраны и применение антигипоксантов способствовало не столь значительному росту коэффициента S/PHH, как при гипоксии без коррекции, но однако этот коэффициент был также значительно выше, чем у интактных животных: в 1 группе – выше на 57,9%; в 2 группе – выше на 62,5%, в 3 группе – выше на 61,7%, а в 4 группы – выше на 42,0%. В целом увеличение коэффициента S/PHH предполагает нивелирование жидкостных свойств мембран и повышение микровязкости липидного слоя.
Повышение концентрации LPH, обладающего высокотоксическим действием, в тканях головного мозга косвенно свидетельствует об усилении активности фосфолипазы.
В контрольной группе крыс в тканях мозга на фоне гемической гипоксии установлено незначительное снижение концентрации легкоокисляемых липидов в тканях головного мозга, о чем свидетельствует возрастание соотношения PHH/PHEA на 6,0% по отношению к интактным животным, при этом у крыс на фоне приема антигипоксантов данный коэффициент колебался в сторону увеличения и снижения, незначительно отличаясь от интактных животных.
При острой гемической гипоксии также установлены изменения концентрации различных фракций липидов в тканях головного мозга крыс и они отражены в таблице 4.
Таблица 4 - Различные фракции липидов в тканях головного мозга крыс при гемической гипоксии на фоне нагрузки растительными антигипоксантами
Группы
| Показатель | ||||
ЛПВП, мг/г белка | ЛПНП, мг/г белка | ЛПОНП, мг/г белка | Триглицериды, мг/г белка | Общий холестерин, мг/г белка | |
0 | 32,5±1,17 | 17,9±0,64 | 15,3±0,59 | 32,7±1,18 | 22,6±0,79 |
1 | 24,3±0,871 | 22,2±0,771 | 18,0±0,641 | 39,1±1,361,2 | 27,5±0,961 |
1 < 0 на 25,2 % | 1 > 0 на 24,0 % | 1 > 0 на 17,6 % | 1 > 0 на 19,6 % | 1 > 0 на 21,7 % | |
1 > 5 на 6,6 % | 1 < 5 на 3,5 % | 1 < 5 на 5,8 % | 1 < 5 на 7,1 % | 1 < 5 на 5,5 % | |
2 | 24,1±0,841 | 22,3±0,811 | 18,2±0,661 | 39,4±1,451 | 27,6±0,881 |
2 < 0 на 25,8 % | 2 > 0 на 24,6 % | 2 > 0 на 19,0 % | 2 > 0 на 20,5 % | 2 > 0 на 22,1 % | |
2 > 5 на 5,7 % | 2 < 5 на 3,0 % | 2 < 5 на 4,7 % | 2 < 5 на 6,4 % | 2 < 5 на 5,2 % | |
3 | 23,9±0,761 | 22,5±0,831 | 18,4±0,611 | 39,6±1,491 | 27,4±0,911 |
3 < 0 на 26,5 % | 3 > 0 на 25,7 % | 3 > 0 на 20,3 % | 3 > 0 на 21,1 % | 3 > 0 на 21,2 % | |
3 > 5 на 4,8 % | 3 < 5 на 2,2 % | 3 < 5 на 3,7% | 3 < 5 на 5,9 % | 3 < 5 на 5,8 % | |
4 | 27,8±1,011,2 | 21,1±0,681,2 | 17,5±0,561,2 | 37,6±1,351,2 | 26,8±0,931,2 |
4 < 0 на 14,5 % | 4 > 0 на 17,9 % | 4 > 0 на 14,4 % | 4 > 0 на 15,0 % | 4 > 0 на 18,6 % | |
4 > 5 на 21,9 % | 4 < 5 на 8,3 % | 4 < 5 на 8,4 % | 4 < 5 на 10,7 % | 4 < 5 на 7,9 % | |
5 | 22,8±0,881 | 23,0±0,811 | 19,1±0,711 | 42,1±1,551 | 29,1±1,051 |
5 < 0 на 29,8 % | 5 > 0 на 28,5 % | 5 > 0 на 24,8 % | 5 > 0 на 28,7 % | 5 > 0 на 28,2 % | |
Примечание: различия достоверны при P < 0,05: 1 – по сравнению с показателями интактных животных; 2 – по сравнению с показателями контрольной группы
Таким образом, но фоне гемической гипоксии в тканях мозга установлено снижение концентрации ЛПВП и повышение концентрации ЛПНП, ЛПОНП, триглицеридов и общего холестерина.
На основании полученных данных был произведен расчет индекса атерогенности и индексы Castelli 1 и 2 (рис. 4 и 5).
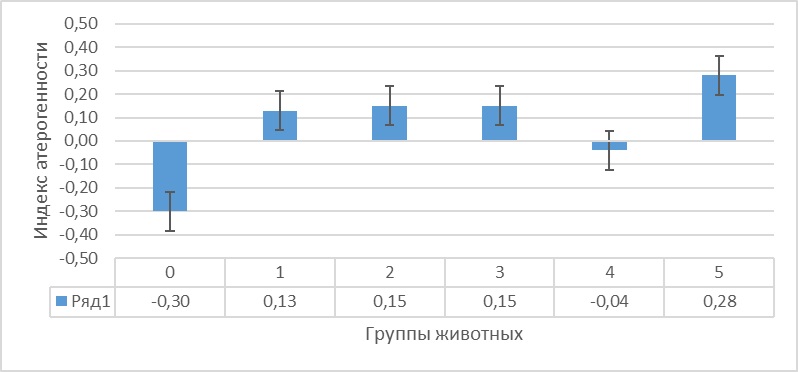
Рисунок 4 - Индекс атерогенности тканей головного мозга крыс на фоне гемической гипоксии и ее коррекции антигипоксантами
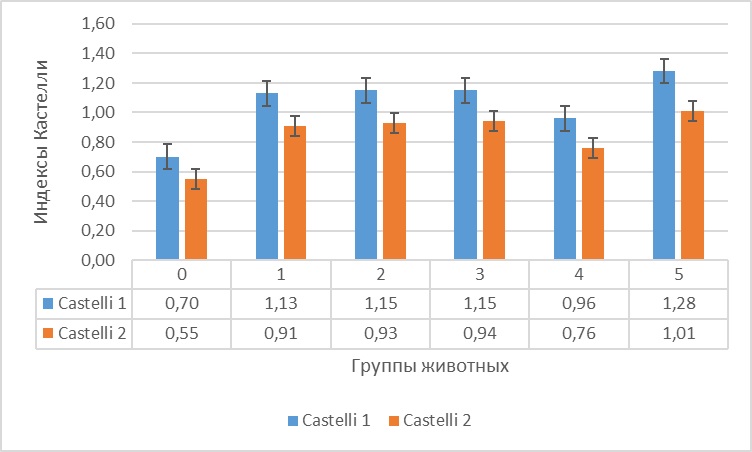
Рисунок 5 - Индексы Castelli тканей головного мозга крыс на фоне гемической гипоксии и ее коррекции антигипоксантами
В отношении индекса Castelli 2 было установлено, что у животных 5 группы он был больше, чем у интактных крыс на 83,6%, при этом у крыс, получавших антигипоксанты этот индекс также был больше, чем у интактных животных: в 1 группе – выше на 65,5%; в 2 группе – выше на 69,1%, в 3 группе – выше на 70,9%, а в 4 группе – выше на 38,2%, но существенно ниже, чем у крыс контрольной группы: в 1 группе – ниже на 9,9%; в 2 группе – ниже на 7,9%, в 3 группе – ниже на 6,9%, а в 4 группе – ниже на 24,8%.
4. Обсуждение
В ходе исследования установлено, что гемическая гипоксия провоцирует значительные изменения в концентрации фракций липидов и фосфолипидов в сыворотке крови и тканях головного мозга крыс, что свидетельствует о глубоких метаболических нарушениях в их организме.
При моделировании острой гемической гипоксии в сыворотке крови и тканях головного мозга установлено уменьшение доли суммарных фосфолипидов, при том, что тенденции в изменении отдельных фракций фосфолипидов были разными:
· в сыворотке крови на фоне гипоксии установлено возрастание концентрации PHEA и LPH и снижение концентраций PHH, PHS, KL и S;
· в тканях головного мозга на фоне гемической гипоксии установлено возрастание концентрации S и LPH и снижение концентраций PHH, PHEA, PHS и KL.
Увеличение концентрации LPH может происходить из-за увеличения активности фосфолипаз А1 и А2 или из-за накопления ионов кальция в тканях, являющихся активаторами фосфолипаз, а также это может возникать вследствие ингибирования активности лизофосфолипазы, участвующей в превращении LPH в глицерофосфохолин и жирную кислоту.
Важным является факт снижения концентрации кардиолепина в сыворотке крови и тканях головного мозга на фоне гемической гипоксии. Дело в том, что каждая молекула АТФ-АДФ-синтетазы в норме образует комплекс с шестью молекулами KL и нарушение липидного окружения фермента приводит к изменению его активности и подтверждает нарушение энергетического обмена в клетках при гипоксии.
Также выявлено уменьшение концентрации PHH и PHEA в сыворотке крови и тканях головного мозга при гемической гипоксии и этот факт играет роль в работе кальциевого насоса, который регулируется процессом метилирования PHEA, приводящему к образованию PHH.
В целом перераспределение соотношения индивидуальных фосфолипидов в сыворотке крови крыс и тканях мозга крыс на фоне острой гипоксии, является существенным фактором нарушения барьерной и транспортной функции биологических мембран.
Гемическая гипоксия оказывает влияние на различные фракции липидов в сыворотке крови и тканях головного мозга крыс, что проявляется снижением концентрации ЛПВП и повышение концентрации ЛПНП, ЛПОНП, триглицеридов и общего холестерина.
Также, при оценке степени дисбаланса обмена липидов с помощью расчетных индексов на фоне гипоксии, было установлено их существенное повышение. Коэффициент атерогенности – расчетный показатель соотношения концентрации липопротеинов низкой и высокой плотности, отражающий степень риска развития заболеваний сердца и сосудов и степень дислипопротеинемии.
В целом, индексы Castelli 1 и 2 отражают соотношение между атерогенными и антиатерогенными липидами и являются индикаторами повреждения сердечно-сосудистой системы, чем выше эти индексы, тем более вероятен шанс возникновения атеросклероза.
Атерогенный индекс плазмы также отражает баланс между атерогенными и антиатерогенными липопротеидами, но указывает на скорость этерификации холестерина в ЛПВП и размер частиц ЛПВП и ЛПНП. Высокие значения этого индекса являются показателями увеличения количества маленьких частиц ЛПВП и маленьких плотных частиц ЛПНП и повышенного риска развития сердечно-сосудистых заболеваний.
Повышение всех вышеуказанных индексов на фоне гемической гипоксии в сыворотке крови и тканях головного мозга также свидетельствует о возникновении дислипопротеинемии.
Стоит отметить, что применение антигипосантов способствует нивелированию нарушений метаболизма липидов крыс и наиболее выраженный положительный эффект наблюдается при использовании смеси растительных экстрактов смородины черной и малины лекарственной в соотношении 1:1.
5. Заключение
На фоне острой гемической гипоксии развиваются нарушения метаболизма липидов, характеризующиеся уменьшением доли суммарных фосфолипидов, концентрации PHH и ЛПВП и повышением концентрации ЛПНП, ЛПОНП, триглицеридов, общего холестерина и LPH, а расчет индексов атерогенности, Castelli 1 и 2 и атерогенного индекса плазмы подтверждают развитие выраженной дислипопротеинемии. Использование антигипоксантов нивелирует негативное влияние гемической гипоксии на липидный обмен в тканях головного мозга и сыворотке крови крыс и наиболее выраженный положительный эффект наблюдается при применении смеси экстрактов малины лекарственной и смородины черной в соотношении 1:1.
