ВЛИЯНИЕ ПАТОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ МИКРОБИОЦЕНОЗА КИШЕЧНИКА НА ПОЯВЛЕНИЕ ИЛИ УСИЛЕНИЕ НЕГАТИВНОГО ПОВЕДЕНИЯ ДЕТЕЙ С РАС
ВЛИЯНИЕ ПАТОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ МИКРОБИОЦЕНОЗА КИШЕЧНИКА НА ПОЯВЛЕНИЕ ИЛИ УСИЛЕНИЕ НЕГАТИВНОГО ПОВЕДЕНИЯ ДЕТЕЙ С РАС
Научная статья
Максимова А. А.*
Медицинский центр "Miraculum", Тбилиси, Грузия
* Корреспондирующий автор (aleksandra-krasn[at]mail.ru)
АннотацияДоказано, что многие проявления негативного поведения являются следствием преобладания патогенной микрофлоры в кишечнике детей с расстройствами аутичного спектра. Устранение выявленных бактериальных и грибковых инфекций приводило к уменьшению или исчезновению негативного поведения, а в случае рецидивов - к их возвращению. Негативное поведение было связано с дисбалансом нейромедиаторов, влиянием метаболитов патогенных бактерий в качестве нейротоксинов, возникновением висцеральных и абдоминальных болей на фоне прямого и опосредованного влияния на блуждающий нерв и симпатический ствол у детей с аутизмом. Родителям и клиническим врачам рекомендовано при негативном поведении детей обращать внимание на возможные проблемы с желудочно-кишечным трактом прежде, чем прибегать к психотропным препаратам.
Ключевые слова: аутизм, бактериальная инфекция, микробиом, нарушения сна, негативное поведение.
ABNORMALITIES OF GASTROINTESTINAL MICROBIOCENOSIS INFLUENCING AVERSIVE BEHAVIOUR OF ASD CHILDREN MANIFESTING OR INTENSIFYING
Research article
Maximova A.A.*
Miraculum Medical Centre, Tbilisi, Georgia
* Corresponding author (aleksandra-krasn[at]mail.ru)
AbstractIt is proved that many manifestations of aversive behaviour are the result of the predominance of intestinal pathogenic microflora of children having autism spectrum disorders. Eradicating the identified bacterial and fungal infections led to a decrease or disappearance of aversive behaviour, and in the case of relapses, it returned. Aversive behaviour occurred due to the neurotransmitter imbalance, neurotoxic action of pathogenic bacteria metabolites, the occurrence of visceral and abdominal pain affected by direct and indirect effects on the vagus nerve and sympathetic trunk of autistic children. Parents and clinicians are recommended to pay attention to the possible gastrointestinal problems when noticing aversive behaviour before resorting to psychotropic medication.
Keywords: autism, bacterial disease, microbiome, sleep disorders, aversive behaviour.
Цель исследования: доказать зависимость негативного поведения детей с расстройствами аутичного спектра от нарушений микробиоценоза кишечника.
Задачи исследования:
- Установить высокую степень корреляции между (1) состоянием желудочно-кишечного тракта (далее - ЖКТ) и нарушениями микробиоценоза кишечника и (2) негативным поведением (тревожность, агрессия/самоагрессия, неконтролируемые истерики, истерический смех), нарушениями сна и эмоциональной лабильностью детей с расстройством аутичного спектра.
- Показать причинно-следственную связь между (1) стабилизацией работы ЖКТ и восстановлением микробиоценоза кишечника и (2) исчезновением / уменьшением негативного поведения, успешной коррекцией нарушений сна и эмоциональной лабильности у детей с расстройством аутичного спектра.
- Описать и рекомендовать для клинической практики варианты диагностики нарушений микробиоценоза кишечника, использованные в описываемом исследовании.
- Предложить потенциальные терапевтические стратегии и противовоспалительные протоколы питания для (1) борьбы с чрезмерным разрастанием конкретных патогенных бактериальных и грибковых инфекций и (2) коррекции нарушений микробиоценоза кишечника.
Материалы исследования
Связь микробиома и негативного поведения изучалась в течение 14 месяцев на базе Центра интегративной медицины «Miraculum», Тбилиси, Грузия (Integrative Medicine Center Miraculum LLC, State Registry Identification Number #405298244; www.facebook.com/autism.ge) в рамках общего исследования зависимости негативного поведения детей с расстройством аутичного спектра от разнообразных патологических состояний. Всего в исследовании принял участие 71 пациент в возрасте от 3 до 12 лет. Диагнозы: детский аутизм (F.84) и атипичный аутизм (F.84.1).
Для настоящей статьи рассмотренная выборка была ограничена только пациентами с патологическими изменениями структуры микрофлоры кишечника. Это 58% от всей выборки или 41 ребенок. Все дети были с тяжелой формой аутизма и не поддавались тестированию. Соответственно, оценку поведения проводили по опроснику родителей «Скрининговый инструмент для проведения функциональной оценки» (“Modified Checklist for Autism in Toddlers, Revised, with Follow-Up (M-CHAT-R/F)") [17], а также по тесту А.И. Захарова на оценку уровня тревожности ребенка [4]. Статистическая обработка данных исследования проводилась с помощью пакета статистических программ «Statistica 6.0». В качестве статистической обработки данных использовался метод непараметрической обработки, а именно коэффициент ранговой корреляции Спирмена. Для оценки силы корреляционных связей между переменными использовали шкалу Чеддока, с помощью которой проводили интерпретацию величины коэффициента.
Методы исследования
- Изучение анамнеза заболевания и жизни.
- Оценка физического развития.
- Осмотр гастроэнтерологом, неврологом, клиническим психологом и педиатром.
- Лабораторная диагностика:
4.1. Копрограмма и бактериологический посев кала с чувствительностью к бактериофагам и антибиотикам (Научно-исследовательский институт микробиологии, вирусологии и иммунологии им. Г.Элиава; Тбилиси, Грузия).
4.2. Измерение уровня фекального кальпротектина (Лаборатория Mrcheveli; Тбилиси, Грузия).
4.3. Измерение уровня зонулина в кале (Лабораторная служба Хеликс, Россия, г. Владикавказ)
4.4. «Оценка микроэкологического статуса человека методом хромато-масс-спектрометрии» по Г.А.Осипову (Лаборатория микробной хроматографии; Москва, Россия) [3].
Результаты исследования- У всех детей с нарушенной микрофлорой кишечника и преобладанием патогенных бактерий в ее структуре фиксировались: тревожность, агрессия/самоагрессия, неконтролируемые истерики, грубые нарушения сна и эмоциональная лабильность.
- Разрастание Candida albicans в кишечнике детей также приводило к частым эпизодам истерического смеха в течение суток, а инфицирование Helicobacter pylori вело к уменьшению концентрации внимания и "выключенности ребенка".
- Выявлены повышенные уровни фекального кальпротектина у пациентов с разрастанием патогенной флоры в толстом кишечнике и высокие уровни зонулина у пациентов с разрастанием патогенной флоры в тонком кишечнике.
- Установлена высокая корреляция между (1) появлением или усилением негативного поведения и других вышеупомянутых нарушений и (2) высоким уровнем кальпротектина в кишечнике, указывающим на развитие вялотекущего воспалительного процесса в толстом и/или тонком кишечнике.
- Коррекция патологических изменений микрофлоры кишечника и прекращение разрастания патогенных бактерий и грибков приводили к уменьшению или исчезновению негативного поведения и других нарушений.
- Одновременно была установлена высокая корреляция между (1) улучшением поведения и (2) снижением (нормализацией) уровня кальпротектина, что указывало на ослабление или прекращение вялотекущего воспалительного процесса в кишечнике.
В ходе исследования зарегистрированы следующие бактериальные и грибковые инфекции, присутствие которых свидетельствовало о патологических изменениях в кишечнике (расположены в порядке убывания, от часто к менее регистрируемым):
В толстом кишечнике:
- Hemolytic Escherichia coli,
- Helicobacter pylori,
- Candida albicans,
- Hemolytic enterococcus,
- Pseudomonas
В тонком кишечнике:
- Micromycetesspp,
- Streptococcus mutans,
- Clostridium perfringes,
- Candida albicans.
В свою очередь, исследование уровня фекального кальпротектина показало значительное его превышение у всех пациентов c нарушенной микрофлорой толстого кишечника: при норме в 50 мкг/г уровень кальпротектина составил от 90 до 145 мкг/г. А при разрастании патогенной флоры в тонком кишечнике выявлялись высокие уровни зонулина – от 85-110 нг/мл. Это подтверждало наше предположение о идущем в кишечнике вялотекущем воспалительном процессе.
Также с помощью отслеживания данных показателей мы могли оценить правильность и эффективность лечения, а также установить корреляционные связи между состоянием желудочно-кишечного тракта и негативным поведением детей с расстройством аутичного спектра и уровнем тревоги у данной группы детей.
Установлена устойчивая зависимость между дисбалансом микробиома кишечника с преобладанием патогенной флоры в его верхних и нижних отделах и негативными проявлениями поведения у детей с расстройством аутичного спектра.
ВведениеПервые публикации, рассматривавшие взаимосвязь нарушений структуры микробиоты кишечника и функционирования головного мозга человека, появились еще несколько лет назад [1]. С каждым годом интерес к этой теме нарастает, и сегодня число публикаций и исследований исчисляется уже сотнями [8]; [9]; [10]; [20]. В частности, доказано, что болезни Паркинсона и Альцгеймера могут напрямую зависеть от состояния микробиоты кишечника. Это не означает, что первопричиной заболеваний является именно поражение ЖКТ, но имеется в виду, что патологические процессы в ЖКТ усугубляют и ускоряют течение этих тяжелых заболеваний[18].
Взаимосвязь ЖКТ и аутизма длительное время не признавалась официальной медициной. Но и здесь в последние годы появились подвижки - опубликован ряд исследований, доказывающих, что негативное поведение у детей с аутизмом может быть связано с дисбалансом микробиома кишечника.
Различными учеными и докторами предлагаются разнообразные типы диет и противовоспалительных протоколов в качестве инструмента для стабилизации состояния микробиома [14]. С одной стороны, самые известные и передовые американские медицинские центры, занимающиеся проблемами аутизма, по-прежнему остаются в рамках DSM-5 ("Диагностическое и статистическое руководство по психическим заболеваниям", 5-е издание), которое традиционно относит аутизм к психическим заболеваниям [6]. С другой стороны, в то же время некоторые из них стали относить проблемы ЖКТ детей с расстройством аутичного спектра к сопутствующим аутизму заболеваниям, требующим приоритетного внимания. Например, Центр аутичного спектра (Autism Spectrum Center) Бостонской детской больницы (Boston Children's Hospital) на своей главной странице говорит о первоочередном внимании к гастроэнтерологическим проблемам детей с аутизмом [5]. Не менее известный Джонсоновский центр детского здоровья и развития (The Johnson Center for Child Health and Development) акцентирует внимание родителей и специалистов на широком использовании в своей практике "диетических вмешательств и лечебного питания" (Dietary intervention and Theurapetic nutrition) [11]. Такие заявления, на наш взгляд, являются своего рода вынужденным компромиссом между официальной доктриной и реальной клинической практикой, но, безусловно являются шагом вперед.
Увы, в большинстве стран мира понимание важности роли ЖКТ в работе с детьми с расстройством аутичного спектра не доходит до клинической практики, что лишает многих детей шансов на возможный прогресс в развитии. Наша практика в Грузии безусловно подтверждает этот тезис, и мы полагаем, что во многих странах ситуация не намного лучше. Подавляющее большинство врачей-клиницистов по-прежнему объясняют боли в желудке у детей и другие жалобы родителей диагнозом "аутизм"; соответственно, они пренебрегают лабораторной диагностикой для определения состояния микробиома кишечника у таких пациентов. В частности, все родители из рассматриваемой в статье выборки (41 ребенок) отметили при опросе, что они не получали должного внимания врачей к состоянию здоровья детей. Большая часть объяснений специалистов и их ответов на вопросы родителей, как правило, сводилась к диагнозу "аутизм", как необъяснимого и неизлечимого заболевания.
Для изменения этой ситуации принципиально важно постоянно привлекать внимание как родителей, так и специалистов, прежде всего, педиатров, гастроэнтерологов, а также психиатров и поведенческих аналитиков (которые работают с детьми) к тому, что негативное поведение зачастую вызвано патологическими изменениями микрофлоры кишечника. Скорректировав эти изменения, в большинстве случаев можно избавиться от негативного поведения и радикально повысить эффективность поведенческой терапии и когнитивного развития ребенка.
В настоящем исследовании мы отразили наш опыт ведения детей с расстройством аутичного спектра в качестве пациентов с проблемами ЖКТ. Показана связь патологических процессов в тонком и толстом кишечнике с проявлениями негативного поведения детей с расстройством аутичного спектра. Предложены потенциальные стратегии лечения.
Результаты исследования
Лабораторные исследования позволили зарегистрировать следующие патогенные бактериальные и грибковые инфекции, присутствие которых в микробиоме свидетельствовало о патологических изменениях в кишечнике:
Таблица 1 – Встречаемые нарушения микробиома толстого и тонкого кишечника у детей с расстройством аутичного спектра
Лабораторная диагностика микробиома толстого и тонкого кишечника
В современной мировой практике при исследовании микробиома кишечника в силу ряда исторических причин используется преимущественно только один анализ: исследуется микрофлора только толстого или только тонкого кишечника. На наш взгляд, это существенно снижает эффективность разрабатываемой терапевтической стратегии.
Основным исследовательским методом для толстого кишечника в США и других западных странах является 16SрРНК - секвенирование, который, как считают многие специалисты, дает достаточно информации на вопросы относительно состояния как толстого, так и тонкого кишечника. Однако по нашему опыту этот метод не способен предоставить четкую картину микробиома тонкого кишечника. А других, широко используемых лабораторных диагностических инструментов для тонкого кишечника пока нет. В настоящее время посмотреть состояние тонкого кишечника возможно только с помощью масс-спектрометрии, анализируя метаболиты кишечных бактерий, найденных в крови и в моче пациентов. Но в западной клинической лабораторной диагностике это совсем новое направление. Первые исследования только начинают появляться, а о практических тестах говорить пока преждевременно [13].
В России обратная ситуация. Здесь при анализе микробиома опираются, прежде всего, на исследование тонкого кишечника. В этой стране относительно давно вошел в практику анализ спектра органических кислот крови «методом газовой хроматографии с масс-спектрометрией (ГХ/МС) по Г.А.Осипову» [3]. За пределами России этот метод пока не получил широкого распространения. В свою очередь, в России также зачастую считается, что анализа тонкого кишечника будет достаточно, чтобы отследить все процессы, происходящие в верхнем и нижнем отделах кишечника.
Мы не считаем правильным использовать только моноанализы. Опираясь на результаты 16SрРНК – секвенирования, клиницист может скорректировать состояние только толстого кишечника без учета возможных проблем, имеющих место выше, в тонком кишечнике. Например, без учета синдрома интенсивного бактериального роста. С другой стороны, опираясь только на ГХ/МС-исследование, клиницист корректирует состояние тонкого кишечника, используя антибиотикотерапию и различного рода пробиотики/пребиотики. Но в итоге он может усугубить состояние толстого кишечника за счет разрастания условно-патогенной флоры, получившей дополнительное питание. А это, в свою очередь, приведет к ухудшению общего состояния ЖКТ и последующего усиления негативного поведения детей с расстройством аутичного спектра.
В силу вышесказанного мы применяли комплексный подход для диагностики состояния микробиома кишечника. Во время выполнения проекта в Грузии у нас не было возможности выполнить 16SрРНК-секвенирование микробиома для изучения толстого кишечника, поэтому для приблизительной оценки его состояния мы использовали анализ кала на дисбактериоз и копрограмму. Что же касается тонкого кишечника, то на сегодня ХМС по Г.А.Осипову - единственный доступный и относительно эффективный метод исследования тонкого кишечника, который мы постоянно применяем в нашей практике [3]. Соответственно, все терапевтические стратегии разрабатывались с учетом комплексной картины микрофлоры всех отделов кишечника.
Доступные нам лабораторные исследования позволили идентифицировать 7 бактериальных и 2 грибковые инфекции у детей с расстройством аутичного спектра, но при этом как в толстом, так и в тонком кишечнике. Исследование микробиома толстого кишечника на основании бактериологических посевов и ПЦР диагностики кала способны показать только незначительное количество типов бактерий и грибков: в диапазоне от 10 до 30, как и получилось в нашем исследовании. При 16S рРНК – секвенировании можно идентифицировать на два порядка больше патогенов - примерно 1700 бактерий и около 1000 разновидностей грибков. Такой куда более детальный анализ микробиома принципиально важен для подбора точечной фармакологический терапии и поддержки нормофлоры. Одному ребенку, например, пребиотик – инулин может принести хорошие результаты, а другому – будет противопоказан, т.к. на нем разрастется патогенная флора. То же самое касается других препаратов: и антибиотики, и бактериофаги должны подбираться по чувствительности на основании результатов детальных анализов.
В ближайшем будущем мы надеемся изыскать возможности для доказательной проверки этого очевидного тезиса на практике. Более глубокое комплексное и детальное изучение микробиома толстого и тонкого кишечника позволит точечно подбирать медикаментозную терапию и проводить эффективную коррекцию нормофлоры, в том числе за счет создания и применения новых бактериофагов против конкретных типов патогенной флоры. Это очень перспективное фармакологическое направление.
Наконец, анализ кала на фекальный кальпротектин и зонулин не имели сами по себе практической значимости, поскольку не объясняли природы воспаления и не предлагали путей борьбы с ним. Но были полезны и необходимы с точки зрения доказательного подтверждения и фиксации самого процесса вялотекущего воспаления, возникающего вследствие изменений в микробиоценозе тонкого и толстого кишечника и разрастания патогенной флоры. Следовательно, для клинического врача повышенный уровень кальпротектина и/или зонулина может являться биомаркером воспаления и обоснованным поводом начинать лабораторный поиск его причины.
Статистическая обработка данных исследования
В качестве статистической обработки данных использовался метод непараметрической обработки, а именно коэффициент ранговой корреляции Спирмена. Для оценки силы корреляционных связей между переменными использовали шкалу Чеддока, с помощью которой проводили интерпретацию величины коэффициента. В ходе исследования выявлялись прямые корреляционные связи между следующими показателями:
- корреляция между уровнем кальпротектина и симптоматикой аутизма (определявшейся тестами М-CHAT-R\F и А.И.Захарова), график 1 - до лечения, график 3 - после лечения;
- корреляция между уровнем зонулина и симптоматикой аутизма, график 2 - до лечения, график 4 - после лечения.
Всем пациентам до начала и после лечения был измерен уровень фекального кальпротектина и уровень зонулина в кале. Выявлено, что при разрастании патогенной флоры в области толстого кишечника поднимался уровень кальпротектина, при разрастании патогенной флоры в области тонкого кишечника – уровень зонулина. При изменении микробиоценоза и в верхнем, и в нижнем отделах кишечника, отмечалось повышение уровня обоих показателей. Но в зависимости от того, в каком из отделов нарушения растут быстрее и сильнее, там же быстрее растут и показатели кальпротектина и зонулина.
Сама тактика лечения выстраивалась исходя из диагностированных нарушений работы ЖКТ: коррекция по видам патогенной флоры, преодоление ферментативной недостаточности, борьба с эндотоксемией (подробнее о протоколах лечения см. ниже).
Для подтверждения нашей гипотезы о влиянии состояния желудочно-кишечного тракта на негативное поведение и уровень тревожности у детей с расстройством аутичного спектра мы проводили тестирование до начала лечения и после лечения данных пациентов. Тестирование включало в себя «Скрининговый инструмент для проведения функциональной оценки» (“Modified Checklist for Autism in Toddlers, Revised, with Follow-Up (M-CHAT-R/F)") [17], а также тест А.И.Захарова на оценку уровня тревожности ребенка [4].
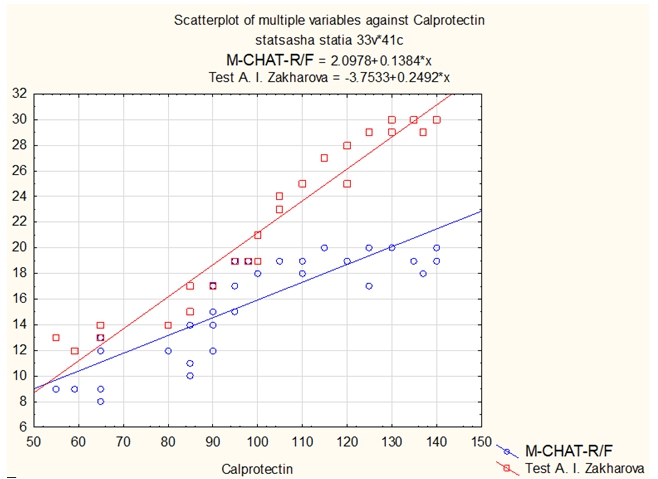
Рис. 1 – Влияние уровня фекального кальпротектина на количество симптомов аутизма по опроснику родителей М-CHAT-R\F и уровню тревожности по тесту А.И. Захарова
Коэффициент корреляции по Спирмену между уровнем кальпротектина:
- и показателями по тесту М-CHAT-R\F составил - 0,874064 (сильная зависимость).
- и показателями по тесту уровня тревожности А.И. Захарова составил - 0,988577 (очень сильная зависимость).
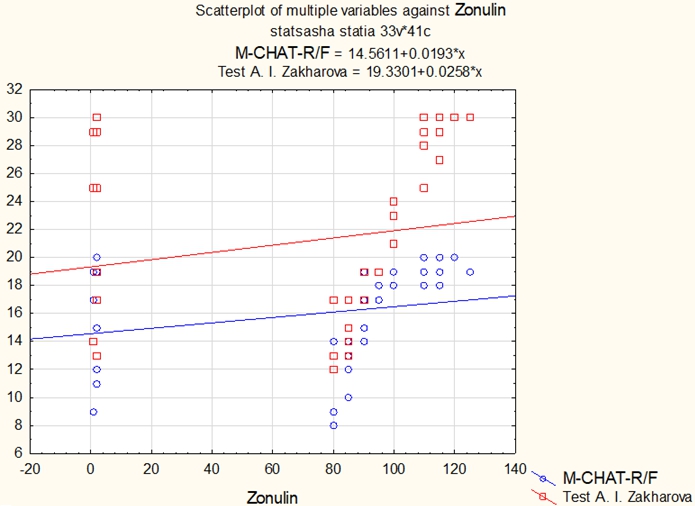
Рис. 2 – Влияние уровня зонулина на количество симптомов аутизма по опроснику родителей М-CHAT-R\F и уровню тревожности по тесту А.И. Захарова
Коэффициент корреляции по Спирмену между уровнем зонулина:
- и показателями по тесту М-CHAT-R\F составил - 0.470662 (средняя зависимость);
- и показателями по тесту уровня тревожности А.И. Захарова составил - 0.484298 (средняя зависимость).
Данные графиков 1 и 2 подтверждают прямую корреляцию между состоянием ЖКТ и негативным поведением / и уровнем тревожности. Но состояние толстого кишечника особенно сильно коррелирует с негативным поведением и уровнем тревоги. Возможно, это обусловлено возникновением абдоминальных висцеральных болей, а также сильной эндотоксемией при проблемах толстого кишечника.
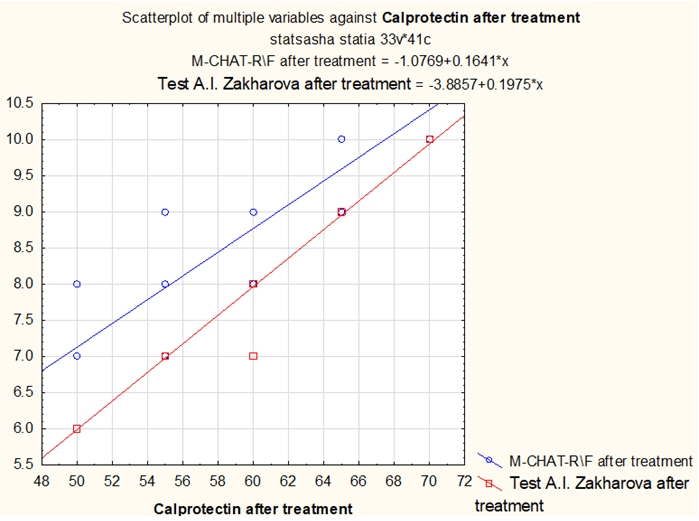
Рис. 3 – Влияние нормализации уровня фекального кальпротектина на количество симптомов аутизма по опроснику родителей М-CHAT-R\F и уровню тревожности по тесту А.И. Захарова
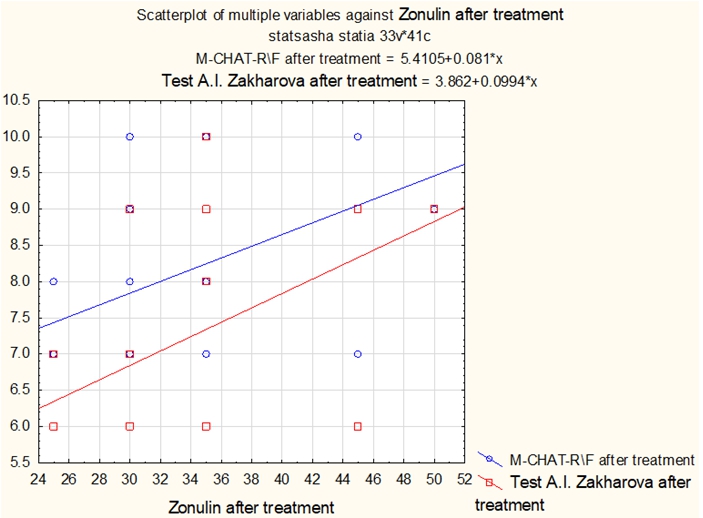
Коэффициент корреляции по Спирмену между уровнем кальпротектина после лечения: - и показателями по тесту М-CHAT-R\F составил - 0.922176 (очень сильная зависимость); . - и показателями по тесту уровня тревожности А.И. Захарова составил - 0.996724 (очень сильная зависимость).Рис. 4 – Влияние нормализации уровня зонулина на количество симптомов аутизма по опроснику родителей
М-CHAT-R\F и уровню тревожности по тесту А.И. Захарова
Коэффициент корреляции по Спирмену между уровнем зонулина после лечения:
- и показателями по тесту М-CHAT-R\F составил - 0.307596 (слабая зависимость);
- и показателями по тесту уровня тревожности А.И. Захарова составил - 0.293469 (слабая зависимость).
После лечения были проведены повторные тестирование и измерение уровней фекального кальпротектина и зонулина, результаты которых представлены в графиках 3 и 4. Очевидно, что улучшение состояния ЖКТ приводило к снижению негативного поведения и уровня тревожности. При этом, стабилизация состояния толстого кишечника значительно сильнее коррелирует со снижением негативного поведения и уровня тревоги по сравнению со стабилизацией состояния тонкого кишечника.
Особенности бактериальных и грибковых инфекций и связанных с ними проявлений негативного поведения. Особенности терапевтических вмешательств
- Hemolytic enterococcus, Hemolytic escherichia coli, Pseudomonasaeruginosa в толстом кишечнике (соответственно, 26 детей или 63% выборки, 9/22% и 8/20%).
Данные патологические изменения приводили в первую очередь к нарушению сна и низкой концентрации внимания. Изредка разрастание вышеназванной патологической флоры приводило к агрессии.
При этих патологических изменениях мы применяли антибиотикотерапию, подобранную на основании чувствительности, но, как правило – это были антибиотики цефалоспоринового ряда. Использовалась также стандартная терапия для поддержания нормофлоры кишечника –пробиотики (как правило HylakForte и Ultrabiotique) и пребиотик (Psillium). При необходимости применяли также ферментативные препараты типа Kreon. Лечение составляло 14 - 28 дней, после чего назначался противовоспалительный протокол питания (минимизация белка, исключение быстрых углеводов, сладкого и крахмала). Поведение стабилизировалось примерно через 3 недели от начала лечения. Всем пациентам было рекомендовано выполнять противовоспалительный протокол питания в течение довольно длительного времени после лечения во избежание рецидивов патологических изменений.
- Разрастание Candida albicansв толстом и тонком кишечнике (соответственно, 10/24% и 4/10%).
По опросу родителей, разрастание данного грибка в кишечнике выражалось в приступах внезапно возникающего истерического смеха, причем как в течение дня, так и ночью. Длительность составляла от одной до нескольких минут. Истерический смех зачастую заканчивался вспышками агрессии или самоагрессии. Нарушался сон: отмечалось чрезмерное беспокойство во время сна с ранним просыпанием и/или частыми эпизодическими просыпаниями посреди ночи, которые сопровождались плачем и/или сильнейшей агрессией.
Мы применяли стандартную противокандидозную терапию (Fluconazole и Enterosgel), антигистаминные средства (Aerius или Fenistil), а также пробиотик (Ultrabiotique). Интенсивная терапия занимала порядка 14 дней. Затем для поддержания стабильного состояния применяли антикандидозный протокол питания - исключение сладкого, в том числе сладких фруктов, и быстрых углеводов (различного рода хлебобулочных и макаронных изделий, выпечки, сладких газированных напитков) в сочетании с приемом Oregano Essential oil.
В течение первой недели лечения все родители отмечали существенное ухудшение состояния детей. На второй неделе лечения родители начинали фиксировать постепенное улучшение состояния. А примерно через месяц все негативные проявления поведения (агрессия, тревога, нарушения сна) исчезали.
- Инфицирование Helicobacter pylori (14 детей или 34% выборки).
Этот тип бактериальной инфекции привлек внимание ряда ученых и докторов, ему посвящены недавние исследования [19], [21]. В нашем проекте при такой инфекции главной жалобой родителей стали нарушения сна, гиперактивность или «выключенность ребенка». Дети проходили лечение с применением антибиотикотерапии, противовоспалительного протокола питания, диеты, курса про/пребиотиков по результатам анализов микробиома. Курс лечения составлял 1 месяц. После лечения родители отмечали значительное улучшение концентрации внимания, «включенности ребенка» и стабилизацию сна. При ротации использовали Helynorm.
- Micromycetes ssp в тонком кишечнике (29 детей или 71% выборки).
В отличие от Candida albicans разрастание этой грибковой флоры не вызывало истерического смеха, но приводило к вспышкам агрессии и самоагрессии. У 5 детей, для которых по нашим рекомендациям родители выполнили ЭЭГ-исследования, были зафиксировали очаги возбуждения. Но нарушения сна наблюдались далеко не всегда.
Лечение строилось на применении противокандидозных препаратов – Voriconazole, а также на терапии для поддержания нормофлоры кишечника – прием пробиотиков (как правило, HylakForte и Ultrabiotique) и пребиотика (Psillium). При необходимости в качестве ферментативного препарата использовался Kreon. Лечение составляло 14 - 28 дней. За лечением назначался противовоспалительный протокол питания (минимизация белка, исключение быстрых углеводов, сладкого и крахмала). При ротации использовали Oregano Essential oil. Поведение стабилизировалось примерно через месяц от начала лечения. Всем пациентам было рекомендовано выполнять противовоспалительный протокол питания в течение довольно длительного времени после лечения во избежание рецидивов патологических изменений.
- Streptococcus mutans в тонком кишечнике (22 ребенка или 54% выборки).
При этой бактериальной инфекции родители отмечали у детей высокий уровень тревоги и периодические вспышки агрессии и самоагрессии. Нарушения сна фиксировались не всегда.
В данном случае для борьбы с бактерией была использована фаготерапия (стрептококковый бактериофаг), которая применялась per os и per rectum. Лечение бактериофагами проводилось 21 день при одновременном использовании пробиотиков и пребиотиков, при необходимости –ферментативных препаратов. Протокол также включал усиление детоксикации за счет кремниевого сорбента. Противовоспалительный протокол питания вводился с первого дня начала лечения. Родители отмечали улучшение состояние ребенка и уменьшение негативного поведения уже через 7 дней после начала лечения.
- Clostridium perfringes в тонком кишечнике (21 ребенок или 51% выборки).
Разрастание этой бактерии приводило к нарушению сна, высокому уровню тревоги и эмоциональной лабильности. Последнее, вероятно, было связано преимущественно с регулярными болями в животе. Родители также отмечали периодически возникающие периоды внезапной тревоги. Описывали эти проявления, как «тревогу, возникающую без всякой причины». Проявление тревоги выражалось в зацикленности на чем-то, в стереотипных движениях и боязни всего вокруг.
Лечение проводилось с помощью антибиотикотерапии и поддержки нормофлоры. Из всех рассматриваемых нами патологических изменений, лечение Clostridium perfringes оказалось наиболее длительным и тяжелым. Дозы антибиотиков использовались в 5-6 раз ниже заявленной дозировки, но при этом до месяца удлинялась продолжительность лечения. Одновременно вводился противовоспалительный протокол питания. Родители отмечали улучшение через полтора месяца после начала лечения, но в отличие от других бактериальных и грибковых инфекций это улучшение носило очень нестабильный и обратимый характер. При малейшем нарушении режима питания возвращались как боли в животе, так и нарушения сна.
Повышение уровня фекального кальпротектина фиксировали у всех детей с патологическими изменениями в толстом кишечнике. При этом в случае регистрации патологии только в тонком кишечнике – кальпротектин не поднимался или поднимался до незначимых величин. А показатель зонулина изменялся в сторону увеличения. Но при этом, если фиксировались изменения и в толстом, и в тонком кишечнике оба показателя повышались, но там, где проблема была сильнее – показатель был выше. При стабилизации состояния ЖКТ в результате проведенного лечения показатели фекального кальпротектина и зонулина приходили в норму.
Данные показатели сами по себе не несут практической диагностической значимости, поскольку не указывают на причину их повышения. Но указывают на необходимость сделать необходимые дополнительные анализы, прежде всего, бактериологический посев в толстом кишечнике и анализ кала методом ХМС по Осипову. Иными словами, фекальный кальпротектин и зонулин являются важными маркерами доказательства идущего вялотекущего воспаления толстого и тонкого кишечника, пусть и без информации о его причинах.
Антимикробная функция прополиса
В качестве дополнительной терапевтической рекомендации отметим, что после интенсивной фазы лечения всем детям мы рекомендовали прием водорастворимой формы прополиса, который обладает антимикробной функцией [12]. В рамках нашего исследования прием прополиса оказывал положительное влияние на стабильность микробиома кишечника и на снижение рецидивов обострения заболеваний ЖКТ. Более того, в наших опросах родители отмечали факт снижения частоты острых респираторных заболеваний у детей, которое мы также, хотя бы частично, приписываем действию прополиса. Кстати, в настоящее время ведутся научные исследования по благотворному действию прополиса при болезни Паркинсона и ревматоидном артрите [7].
Механизмы запуска негативного поведения
В целом статистика фактических данных исследования позволяет утверждать, что преобладание патогенной микрофлоры в кишечнике приводит к проявлениям негативного поведения детей с расстройством аутичного спектра. Однако это является всего лишь наблюдением, а не объяснением. Поиск и доказательное описание механизмов запуска негативного поведения вследствие патогенных изменений в микробиоме - отдельная и самостоятельная тема научной работы. В этой же статье ограничимся лишь перечислением возможных вариантов таких механизмов запуска, способных функционировать как самостоятельно, так и в сцепке друг с другом:
- Прямое влияние метаболитов патогенных бактерий в качестве нейротоксинов.
- Опосредованное влияние метаболитов патогенных бактерий на вегетативную нервную систему, в частности, на блуждающий нерв и симпатический ствол.
- Возникновение висцеральных болей неясного генеза вследствие влияния нейротоксинов на вегетативную нервную систему.
- Висцеральные боли, возникающие при изменении давления в желудке и кишечнике при сокращении и расслаблении мускулатуры данных органов вследствие патологических изменений микробиоценоза кишечника и желудка.
- Висцеральные боли, возникающие вследствие ишемии тканей кишечника и желудка благодаря образованию кислых продуктов метаболизма патогенных бактерий
- Хроническая висцеральная боль, возникающая в результате центральной сенситизации и нарушенной вегетативной иннервации внутренних органов. Ее причинами могут являться:
- дисбаланс нейропептидов и субстанции Р у детей с расстройством аутичного спектра;
- прямое влияние нейротоксинов патогенных бактерий на NMDA-рецепторы.
- Абдоминальные боли разной локализации, связанные с СРК (синдром раздраженного кишечника) вследствие нарушенного микробиоценоза кишечника и разрастания патогенных бактерий, продуцирующих метаболиты для избыточного синтеза серотонина.
- Прямое влияние дисбаланса серотонина на ствол головного мозга и лимбическую систему вследствие нарушенного микробиоценоза кишечника.
- Прямое влияние избытка глютамата на нервную систему, возникающего вследствие содержания большого количества продуцентов данного нейромедиатора в кишечнике.
Взаимодействие патогенной микробиоты с другими патологиями
В большинстве случаев нарушения микробиоты сочетались и взаимодействовали с другими патологическими состояниями детей. Соответственно, проявления негативного поведения могли быть зафиксированы как изолированно при нарушениях микробиома кишечника, так и сцеплены с другими патологическими состояниями (разрастание патогенной флоры в области носоглотки и зева, низкий уровень железа в крови, повышение уровня ASLO, дисбаланс кортизола), описанными в другой нашей статье [2].
Вместе с тем стабилизация поведения, в первую очередь и всегда начинается со стабилизации работы ЖКТ. Кишечник является платформой для многих физиологических процессов в организме, обеспечивающих корректную работу иммунитета, центральной и вегетативной нервных систем, а также гипоталамо-гипофизарной надпочечниковой оси. Поэтому в нашей практике мы всегда начинаем именно со стабилизации ЖКТ. В том случае, если проявления негативного поведения сохраняются, мы определяем следующие патологические изменения для необходимой коррекции и намечаем последовательность взаимосвязанных протоколов лечения.
В то же время, поскольку аутизм является следствием запутанной коморбидной патологии, довольно часто бывает сложно или невозможно сразу определить основной (базовый) патологический фактор. Не подлежит сомнению, что выбор конкретного противовоспалительного протокола питания основан, прежде всего, на конкретной патогенной структуре микробиома кишечника. Однако окончательное решение (особенно в тяжелых случаях) должно приниматься с учетом гормонального фона, работы всех нейрометаболических систем и всех патологических факторов пациента, выявленных в процессе диагностики коморбидной патологии.
Исходя из нашей практики, зачастую просто невозможно использовать монодиету для коррекции состояния пациента. Крайне важно вовремя отслеживать скрытые ранее и проявившиеся в процессе лечения патологические нарушения и, соответственно, своевременно корректировать предписанный протокол питания (диету). Однако вопрос взаимодействия ЖКТ и других основных систем детского организма в процессе комплексного лечения сложной коморбидной патологии - отдельная тема для другой самостоятельной статьи.
Коморбидность аутизма не позволяет заниматься лечением только самых ярко выраженных проявлений аутизма, которые, как правило, связаны именно с нарушениями работы ЖКТ и нервной системы. Необходимо последовательно обследовать все основные системы и органы пациента с целью выявления скрытых или вяло протекающих патологических процессов. Это диктует обязательность междисциплинарного медицинского подхода к лечению аутизма и поиску взаимосвязанных механизмов его запуска.
Выводы
Проведенное исследование установило высокую прямую положительную корреляционную связь между состоянием кишечника и негативным поведением / уровнем тревожности у детей с расстройством аутичного спектра. При этом уменьшение негативного поведения и тревожности особенно высоко зависит от стабилизации работы толстого кишечника.
Исследованием также установлено, какие именно проявления аутизма зависят от нарушений микробиоценоза кишечника и могут быть устранены при коррекции его работы: тревожность, агрессия/самоагрессия, неконтролируемые истерики, истерический смех), нарушения сна и эмоциональная лабильность.
В ходе исследования было выявлено 9 бактериальных и 2 грибковых инфекций, приводивших к чрезмерному разрастанию патогенной микрофлоры кишечника. В толстом кишечнике это были идентифицированы Hemolytic Escherichia coli, Helicobacter pylori, Candida albicans, Hemolytic enterococcus и Pseudomonas aeruginosa. В тонком кишечнике – Micromycetes spp, Streptococcus mutans, Clostridium perfringes, Candida albicans. Патологические изменения в кишечнике детей с расстройством аутичного спектра во всех случаях без исключения приводили к таким проявлениям их негативного поведения, как нарушения сна, агрессия/самоагрессия, неконтролируемые истерики и повышенная тревожность. В двух случаях к общим проявлениям добавлялись специфические: (1) разрастание Candida аlbicans приводила к вспышкам истерического смеха с последующими приступами агрессии, (2) при инфицировании Helicobacter pylori родители также отмечали появление гиперактивности, снижение концентрации внимания и "выключенность ребенка".
Механизмы запуска негативного поведения могли быть связаны:
- с дисбалансом нейромедиатров,
- с влиянием метаболитов патогенных бактерий в качестве нейротоксинов,
- или с возникновением висцеральных и абдоминальных болей на фоне прямого и опосредованного влияния на блуждающий нерв и симпатический ствол у детей с расстройством аутичного спектра.
Но при любом механизме запуска негативное поведение детей уменьшалось или исчезало по мере того, как благодаря избранным терапевтическим стратегиям останавливалось разрастание патогенной микрофлоры и/или происходила позитивная коррекция микробиоценоза кишечника. Это отметили родители всех детей без исключения. Стабилизировался сон, исчезли тревожность, истерики, приступы агрессии/самоагрессии и истерического смеха, улучшилась концентрация внимания и "включенность" ребенка в когнитивный процесс.
Такое доказанное практикой наблюдение позволяет сделать следующие выводы и рекомендации:
- Родители и медицинские специалисты не должны списывать все проявления негативного поведения на особенности аутизма. Следует помнить, что эти проявления могут быть результатом патологических изменений в ЖКТ ребенка, которые необходимо диагностировать и корректировать. Соответственно, надо добиваться или направлять ребенка на консультацию к гастроэнтерологу и другим профильным специалистам.
- Эти рекомендации непосредственно касаются психологов, поведенческих аналитиков, дефектологов, тьюторов и других специалистов, которые постоянно работают с детьми при диагнозе "расстройство аутичного спектра". При подозрении на существование медицинских причин негативного поведения следует отправлять детей на профильную консультацию, а не увеличивать коррекционную и когнитивную нагрузку на детей. Тем более, что при исчезновении негативного поведения эффективность любой поведенческой и коррекционной терапии вырастает многократно. Это подтверждается опытом работы Ресурсного класса (для школьников12-13 лет) и Детской ресурсной группы (для малышей 3-6 лет) при нашем Центре "Миракулум" для детей, которые прошли или проходят медицинские протоколы.
- Появление приступов истерического смеха может быть симптомом разрастания Candida albicans. Соответственно, такое негативное поведение может быть дополнительным диагностическим признаком как для родителей, так и для специалистов.
- ЖКТ является платформой для многих физиологических процессов в организме, обеспечивающих корректную работу иммунитета, центральной и вегетативной нервных систем, а также гипоталамо-гипофизарной надпочечниковой оси. Поэтому стабилизацию работы основных систем детского организма следует начинать именно с кишечника. Но при этом иметь в виду, что нарушения работы ЖКТ могут быть сцеплены с патологическими изменениями в других системах организма. Это диктует необходимость междисциплинарного медицинского подхода при диагностике патологических состояний у детей с расстройством аутичного спектра.
- Наконец, связь микробиоценоза кишечника и негативного поведения обязательно необходимо учитывать при назначении медикаментозной терапии для детей с расстройством аутичного спектра. Зачастую при высоком уровне тревоги, возбуждении и/или нарушений сна детям с расстройством аутичного спектра назначают антидепрессанты, снотворные и/или нейролептики. Но врачам-клиницистам, прежде всего, следует обратить внимание на возможные патологические процессы, ставшие первопричиной негативного поведения. Только после того, как патологические состояния с уверенностью исключены из списка причин негативного поведения, врач может рассматривать возможность подключения к терапии препаратов из класса психотропов.
Заявления о согласии пациентов
Все опекуны пациентов подписывали соглашение об участии в данном исследовании.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Детский аутизм: исследования и практика / ред. В.Н. Касаткин. – Москва: РОО 'Образование и здоровье', 2008. – 402 с. – ISBN 978-5-9900666-3-2
- Максимова А.А. «Связь патологических изменений с негативным поведением детей с расстройством аутичного спектра» [Электронный ресурс]. / А.А. Максимова // Журнал Universum: медицина и фармакология – июль 2020 – URL - https://7universum.com/ru/med/archive/item/9814 (дата обращения: 17.08.2020)
- Струкова Е.Г. Определение микроэкологического статуса и диагностики инфекций организма человека с использованием метода хромато-масс-спектрометрии [Электронный ресурс]. / Е.Г. Струкова, А.А. Ефремов, А.А. Гонтова // Журнал Сибирского Федерального Университета. Серия: Химия. Издательство: Сибирский федеральный университет (Красноярск) – 2009 – URL - http://elib.sfu-kras.ru/handle/2311/1657?show=full (дата обращения: 17.08.2020)
- Тест А.И.Захарова на оценку уровня тревожности ребенка [Электронный ресурс] –2000 - URL - https://nsportal.ru/detskiy-sad/materialy-dlya-roditeley/2015/01/15/test-a-i-zakharova-na-otsenku-urovnya-trevozhnosti (дата обращения: 17.08.2020)
- Boston Children's Hospital. Autism Spectrum Center. [Electronic resource] – 2000 - URLhttp://www.childrenshospital.org/centers-and-services/programs/a-_-e/autism-spectrum-center-program (accessed: 17.08.2020)
- Diagnostic and Statistical Manual of Mental Disorders (DSM–5) – 2010 – [Electronic resource] : URL : https://www.psychiatry.org/psychiatrists/practice/dsm (accessed: 17.08.2020)
- Emmanuel Tiyo Ayikobua Synergistic action of propolis with levodopa in the management of Parkinsonism in Drosophila melanogaster // Emmanuel Tiyo Ayikobua , Josephine Kasolo , Keneth Iceland Kasozi. – 2020 – [Electronic resource] URL - https://pubmed.ncbi.nlm.nih.gov/32386191/ (accessed: 17.08.2020)
- Scheperjans F. Gut microbiota are related to Parkinson's disease and clinical phenotype. Movement Disorders / Filip Scheperjans Velma Aho, Pedro A B Pereira - 2014 [Electronic resource] – URL-https://doi.org/10.1002/mds.26069 (accessed: 17.08.2020)
- Wood H. Gut reactions—can changes in the intestinal microbiome provide new insights into Parkinson disease? // Heather Wood. // Nature Reviews Neurology - 2015 - volume 11 – p. 66
- Jaqueline S Generoso The role of the microbiota-gut-brain axis in neuropsychiatric disorders / Jaqueline S Generoso, Vijayasree V Giridharan, Juneyoung Lee // Brazilian Journal of Psychiatry -2020 – [Electronic resource] URL- On-line version ISSN 1809-452X. Braz. J. Psychiatry (accessed: 17.08.2020)
- Johnson Center for Child Health and Development – [Electronic resource] : URL - http://www.johnson-center.org/healthcare (accessed: 17.08.2020)
- Leonardo Petruzzi Antifungal and Antibacterial Effect of Propolis: A Comparative Hit for Food-Borne Pseudomonas, Enterobacteriaceae and Fungi / Leonardo Petruzzi, Maria Rosaria Corbo. // Journal Foods -2020 – 559 p.
- ŁukaszPaprotny.Development and validation of GC-MS/MS method useful in diagnosing intestinal dysbiosis / . ŁukaszPaprotny, Agnieszka Celejewska , MałgorzataFrajberg // Journal of Chromatography B. -2019 - Volumes 1130–1131
- Gogou M Is there place for nutrition in the treatment of children with autism spectrum disorder? / . M Gogou, G Kolios . // Journal published by the HellenicPsychiatric Association - 2018
- Maria Salem Ibrahim Tooth sealing formulation with bacteria-killing surface and on-demand ion release/recharge inhibits early childhood caries key pathogens / Maria Salem Ibrahim, Abdulrahman A Balhaddad, Isadora M Garcia . // Journal of Biomedical Materials Research First published - 2020
- Michael Van Ameringen. The gut microbiome in psychiatry: A primer for clinicians. / Michael Van Ameringen, Jasmine Turna , Beth Patterson. // [Electronic resource] - URL - https://onlinelibrary.wiley.com/doi/abs/10.1002/da.22936 (accessed: 17.08.2020)
- Modified Checklist for Autism in Toddlers, Revised, with Follow-Up (M-CHAT-R/F). © 2009 Diana Robins, Deborah Fein, & Marianne Barton // [Electronic resource] URL - https://mchatscreen.com/wp-content/uploads/2015/09/M-CHAT-R_F_NoShade_Aug2018.pdf (accessed: 17.08.2020)
- Paolo Riccio Undigested Food and Gut Microbiota May Cooperate in the Pathogenesis of Neuroinflammatory Diseases: A Matter of Barriers and a Proposal on the Origin of Organ Specificity. Nutrients. 2019 Nov; 11(11): 2714.Published online 2019 Nov 9. doi: 3390/nu11112714 PMCID: PMC6893834 PMID: 31717475 (accessed: 17.08.2020)
- Rosalind M Tucker Role of Helicobactersin Neuropsychiatric Disease: A Systematic Review in Idiopathic Parkinsonism / Rosalind M Tucker , Aisha D Augustin , Bu' Hussain Hayee // Journal of Clinical Medicine - 2020, 9 (7), 2159
- Shyuan T Ngo Progression and survival of patients with motor neuron disease relative to their fecal microbiota / Shyuan T Ngo, Restuadi Restuadi, Allan F McCrae . // Journal. Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration - 2020
- Sylvia M Dobbs Antimicrobial surveillance in idiopathic parkinsonism: indication-specific improvement in hypokinesia following Helicobacter pylori eradication and non-specific effect of antimicrobials for other indications in worsening rigidity / Sylvia M Dobbs, André Charlett, R John Dobbs, Clive Weller. // Journal Helicobacter pylori – 2013.
Список литературы на английском языке / References in English
- Detskij autizm: issledovaniya i praktika [Childhood autism: research and practice] / red. V.N. Kasatkin. – Moskva: ROO 'Obrazovaniе i zdorov`e', 2008. – 402 p. – ISBN 978-5-9900666-3-2[in Russian]
- Maksimova A.A. «Svyaz` patologicheskix izmenenij s negativny`mpovedeniem detej s rasstrojstvom autichnogo spektra» [The realation of pathological changes to the negative behavior of children having autism spectrum disorder] [Electronic resource]. Maksimova A.A. // Zhurnal Universum: medicina i farmakologiya – iyul` 2020 - URL https://7universum.com/ru/med/archive/item/9814(accessed: 17.08.2020) [in Russian]
- Strukova E.G., Efremov A.A., Gontova A.A. O «Opredelenie mikroe`kologicheskogo statusa i diagnostiki infekcij organizma cheloveka s ispol`zovaniem metoda xromato-mass-spektrometrii» [Determination of the microecological status and diagnostics of human body infections using the method of chromatography-mass spectrometry] [Electronic resource] Strukova E.G., Efremov A.A., Gontova A.A. // Zhurnal Sibirskogo Federal`nogo Universiteta. Seriya: Ximiya. Publishing house: Sibirskij federal`ny`juniversitet (Krasnoyarsk) – 2009 – URL - http://elib.sfu-kras.ru/handle/2311/1657?show=full(accessed: 17.08.2020) [in Russian]
- Test A.I. Zaxarova na ocenku urovnya trevozhnosti rebenka [A.I. Zakharov test for the assessment of the level of a child’s anxiety] [Electronic resource] – 2000 - URL - https://nsportal.ru/detskiy-sad/materialy-dlya-roditeley/2015/01/15/test-a-i-zakharova-na-otsenku-urovnya-trevozhnosti(accessed: 17.08.2020) [in Russian]
- Boston Children's Hospital. Autism Spectrum Center. [Electronic resource] – 2000 - URLhttp://www.childrenshospital.org/centers-and-services/programs/a-_-e/autism-spectrum-center-program (accessed: 17.08.2020)
- Diagnostic and Statistical Manual of Mental Disorders (DSM–5) – 2010 – [Electronic resource] : URL : https://www.psychiatry.org/psychiatrists/practice/dsm (accessed: 17.08.2020)
- Emmanuel Tiyo Ayikobua Synergistic action of propolis with levodopa in the management of Parkinsonism in Drosophila melanogaster // Emmanuel Tiyo Ayikobua , Josephine Kasolo , Keneth Iceland Kasozi. – 2020 – [Electronic resource] URL - https://pubmed.ncbi.nlm.nih.gov/32386191/ (accessed: 17.08.2020)
- Scheperjans F. Gut microbiota are related to Parkinson's disease and clinical phenotype. Movement Disorders / Filip Scheperjans Velma Aho, Pedro A B Pereira - 2014 [Electronic resource] – URL-https://doi.org/10.1002/mds.26069 (accessed: 17.08.2020)
- Wood H. Gut reactions—can changes in the intestinal microbiome provide new insights into Parkinson disease? // Heather Wood. // Nature Reviews Neurology - 2015 - volume 11 – p. 66
- Jaqueline S Generoso The role of the microbiota-gut-brain axis in neuropsychiatric disorders / Jaqueline S Generoso, Vijayasree V Giridharan, Juneyoung Lee // Brazilian Journal of Psychiatry -2020 – [Electronic resource] URL- On-line version ISSN 1809-452X. Braz. J. Psychiatry (accessed: 17.08.2020)
- Johnson Center for Child Health and Development – [Electronic resource] : URL - http://www.johnson-center.org/healthcare (accessed: 17.08.2020)
- Leonardo Petruzzi Antifungal and Antibacterial Effect of Propolis: A Comparative Hit for Food-Borne Pseudomonas, Enterobacteriaceae and Fungi / Leonardo Petruzzi, Maria Rosaria Corbo. // Journal Foods -2020 – 559 p.
- ŁukaszPaprotny.Development and validation of GC-MS/MS method useful in diagnosing intestinal dysbiosis / . ŁukaszPaprotny, Agnieszka Celejewska , MałgorzataFrajberg // Journal of Chromatography B. -2019 - Volumes 1130–1131
- Gogou M Is there place for nutrition in the treatment of children with autism spectrum disorder? / . M Gogou, G Kolios . // Journal published by the HellenicPsychiatric Association - 2018
- Maria Salem Ibrahim Tooth sealing formulation with bacteria-killing surface and on-demand ion release/recharge inhibits early childhood caries key pathogens / Maria Salem Ibrahim, Abdulrahman A Balhaddad, Isadora M Garcia . // Journal of Biomedical Materials Research First published - 2020
- Michael Van Ameringen. The gut microbiome in psychiatry: A primer for clinicians. / Michael Van Ameringen, Jasmine Turna , Beth Patterson. // - URL - https://onlinelibrary.wiley.com/doi/abs/10.1002/da.22936 (accessed: 17.08.2020)
- Modified Checklist for Autism in Toddlers, Revised, with Follow-Up (M-CHAT-R/F). © 2009 Diana Robins, Deborah Fein, & Marianne Barton // URL - https://mchatscreen.com/wp-content/uploads/2015/09/M-CHAT-R_F_NoShade_Aug2018.pdf (accessed: 17.08.2020)
- Paolo Riccio Undigested Food and Gut Microbiota May Cooperate in the Pathogenesis of Neuroinflammatory Diseases: A Matter of Barriers and a Proposal on the Origin of Organ Specificity. Nutrients. 2019 Nov; 11(11): 2714.Published online 2019 Nov 9. doi: 3390/nu11112714 PMCID: PMC6893834 PMID: 31717475 (accessed: 17.08.2020)
- Rosalind M Tucker Role of Helicobactersin Neuropsychiatric Disease: A Systematic Review in Idiopathic Parkinsonism / Rosalind M Tucker , Aisha D Augustin , Bu' Hussain Hayee // Journal of Clinical Medicine - 2020, 9 (7), 2159
- Shyuan T Ngo Progression and survival of patients with motor neuron disease relative to their fecal microbiota / Shyuan T Ngo, Restuadi Restuadi, Allan F McCrae . // Journal. Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration - 2020
- Sylvia M Dobbs Antimicrobial surveillance in idiopathic parkinsonism: indication-specific improvement in hypokinesia following Helicobacter pylori eradication and non-specific effect of antimicrobials for other indications in worsening rigidity / Sylvia M Dobbs, André Charlett, R John Dobbs, Clive Weller. // Journal Helicobacter pylori – 2013.