INFLUENCE OF NUTRIENT MEDIUM COMPOSITION ON THE MORPHOLOGY OF MYCELIUM INONOTUS OBLIQUUS PELLETS AND HISPIDIN CONTENT IN BIOMASS AND CULTURE FLUID
INFLUENCE OF NUTRIENT MEDIUM COMPOSITION ON THE MORPHOLOGY OF MYCELIUM INONOTUS OBLIQUUS PELLETS AND HISPIDIN CONTENT IN BIOMASS AND CULTURE FLUID
Abstract
In the work, it is shown that the composition of nutrient medium influences the morphology of mycelial pellets and the content of hispidin (HP) in fungal biomass and culture medium when growing basidiomycete Inonotus obliquus under submerged conditions. It was found that in nutrient media PD (potato-dextrose), YM (based on malt and yeast extracts) and S (Sabouraud) the growth of large mycelial pellets (up to 4–7 mm in diameter) with numerous short (1–3 mm long) bundles of hyphae was observed. During cultivation, the fungus synthesises and secretes HPs into nutrient media. Similar dynamics of the analyte content in PD, YM and S media was found: firstly, an increase in the level of HP in the medium and then its decrease after reaching a maximum. The maximum content of HP in these nutrient media is determined on the 7th–10th day of fungal cultivation and varies from 0.20 to 0.27 mg of analyte per 1 ml of medium. At these times, the maximum HP content in mycelium samples obtained during cultivation in the above media ranges from 0.54 to 0.94 mg of analyte per 1 g of biomass. Significant differences in mycelial pellet morphology and HP content were found when basidiomycete I. obliquus was cultivated in nutrient media ME (based on malt extract) and PS (potato-sugar). Cultivation in these media is accompanied by the growth of mycelial pellets of small size (1–3 mm in diameter) with numerous number of long (up to 4–5 mm and more) bundles of surface hyphae. ME and PS media did not detect the presence of HPs on 5–12 days of cultivation. Compared to mycelium obtained during cultivation in PD, YM and S media, mycelium grown in ME and PS media has 2–3 degrees of magnitude lower HP content. The results of this study demonstrate the possibility of increasing HP production when cultivating the fungus I. obliquus in submerged conditions and PS media creates prerequisites for the development of biotechnology for the production of this fungal metabolite, which has a number of valuable pharmacological effects.
1. Введение
Базидиальные грибы представляют значительный интерес для исследователей, как перспективные природные источники большого количества биологически активных веществ разных классов, востребованных в медицине, биологии, фармакологии, пищевой и химической промышленности, сельском хозяйстве , , , , , а также , , . Базидиомицеты используют для получения биополимерных материалов , ; соединений, которые обладают фармакологической активностью , , , ; ферментов, катализирующих расщепление природных биополимеров , , , , . Следует сказать, что использование высших грибов в биотехнологическом получении биоактивных веществ связано с необходимостью изучения возможностей увеличения их продукции в грибной биомассе на стадии культивирования. Например, в работах разных авторов было показано, что состав и соотношение компонентов питательной среды, используемой для выращивания биомассы базидиомицетов, оказывает влияние на уровень продукции в ней биоактивных веществ , , , . Это позволяет говорить о том, что состав питательной среды является одним из принципиально важных факторов, который следует учитывать при создании биотехнологий производства целевых биопродуктов на основе базидиальных грибов.
Необходимо заметить, что среди биологически активных соединений, продуцируемых высшими грибами, интерес для медицинских и фармакологических приложений представляют соединения класса стирилпиронов, являющиеся природными антиоксидантами . В частности, к этому классу веществ принадлежит гиспидин (ГП) — вторичный метаболит высших грибов, проявляющий ценные фармакологические эффекты , , , : противовоспалительный, иммуномодулирующий, противовирусный, противоопухолевый, цитостатический , , , . При этом известно, что базидиальный гриб Inonotus obliquus (трутовик скошенный, медицинский гриб чага) наряду со значительным набором биологически активных соединений продуцирует также стирилпироны, включая ГП , , . В недавних исследованиях мы установили , что при глубинном культивировании базидиомицет I. obliquus синтезирует и секретирует ГП в питательную среду. В свою очередь, это свидетельствует о применимости данного гриба для биотехнологического производства ГП.
Исходя из вышеизложенного, в представленной работе мы исследовали морфологию формирующихся пеллет мицелия и уровни содержания ГП в грибной биомассе и питательных средах разного состава при культивировании гриба Inonotus obliquus в погруженных условиях.
2. Материалы и методы исследований
Для исследований использовали мицелий базидиального гриба I. obliquus IBSO 2430 из Коллекции микроорганизмов CCIBSO 836 Института биофизики ФИЦ КНЦ СО РАН (Красноярск). Образцы мицелия получали при погруженном культивировании гриба в жидких питательных средах разного состава. Выращивание биомассы проводили в конических колбах объемом 300 мл, которые содержали по 100 мл жидких питательных сред. В качестве инокулята для культивирования гриба в погруженных условиях использовали мицелий I. obliquus, предварительно выращенный в чашках Петри (TTP, Швейцария) на агаризованной среде PD (HiMedia Laboratory, Индия) при температуре 24°С (термостат ТСО 1/80 СПУ, Россия). Для приготовления инокулята выросший пленочный мицелий срезали с поверхности твердой питательной среды в стерильных условиях (ламинар Labconco, США) и протирали через металлическое сито (размер пор 1/1 мм). Измельченную биомассу (инокулят) вносили в жидкие питательные среды в объеме, составляющем 2–5% от объема сред. Культивирование в погруженных условиях проводили при температуре 25°С и постоянном орбитальном перемешивании питательных сред со скоростью 140–170 об/мин на шейкере-инкубаторе ES-20 (BIOSAN, Латвия).
В настоящей работе нами были использованы готовые к применению питательные среды и их ингредиенты, полученные от фирмы HiMedia Laboratory:
– среда PD — картофельно-декстрозная (картофельный экстракт — 4 г/л, глюкоза — 20 г/л);
– среда YM — на основе дрожжевого и солодового экстрактов (дрожжевой экстракт — 3 г/л, солодовый экстракт — 3 г/л, декстроза — 10 г/л, микологический пептон — 5 г/л);
– среда S — Сабуро (декстроза — 40 г/л, микологический пептон — 10 г/л);
– среда ME — на основе солодового экстракта (декстроза — 2 г/л, солодовый экстракт — 20 г/л, микологический пептон — 1 г/л);
– среда PS — картофельно-сахарозная (бульон из свежесваренного картофеля — 200 г/л, сахароза – 20 г/л).
Все приготовленные питательные среды перед использованием автоклавировали в течение 15 мин при 120°С.
В процессе выращивания гриба каждые сутки, начиная с 5-го дня от старта культивирования, в стерильных условиях (ламинар Labconco) отбирали пробы питательных сред объемом 500 мкл для тестирования ГП. Взятые пробы центрифугировали при 16000g (Centrifuge 5415R, Eppendorf, Германия) в течение 5 мин при 4°С для удаления мелких фрагментов мицелия. Супернатанты отбирали и определяли в них наличие ГП биолюминесцентным методом с помощью ферментной люминесцентной системы, выделенной из светящегося базидиомицета Armillaria borealis . Ранее было доказано, что ГП является предшественником люциферина светящихся высших грибов . При функционировании грибной люминесцентной системы ГП сначала преобразуется НАДФН-зависимой гидроксилазой в люциферин (3-гидрокси-ГП), который окисляется люциферазой с излучением кванта видимого света. Люминесцентный метод тестирования ГП является высокочувствительным и позволяет выявлять этот аналит в биологических пробах с пределом обнаружения 1,3 ⋅ 10–11 г .
Люминесцентным методом оценивали также наличие ГП в биомассе грибного мицелия. Для тестирования использовали водные экстракты из грибной биомассы, которые получали следующим образом. Выросшие пеллеты мицелия извлекали из питательных сред и промывали деионизированной (ДИ) водой (Milli-Q system, Millipore, США) для удаления остатков сред и метаболитов. После промывки пеллет жидкую часть отделяли фильтрацией через бумажный фильтр и определяли вес сырой биомассы каждого образца. Отмытые пеллеты мицелия измельчали протиранием через металлическое сито, как это изложено выше. К образцам измельченной биомассы добавляли ДИ воду в объемном соотношении 1:2 (вода : биомасса). Полученные пробы перемешивали до однородных суспензий, помещали в микроволновую печь MW 712BR (Samsung, Малайзия) и нагревали при 800 Вт до закипания. После этого образцы охлаждали в ледяной бане и центрифугировали при 16000g (Centrifuge 5415R) в течение 10 мин при 4°С. Супернатанты отбирали и использовали для люминесцентного определения ГП.
Биолюминесцентное тестирование ГП в приготовленных образцах питательных сред и экстрактах из грибной биомассы проводили следующим образом. В прозрачные пластиковые пробирки объемом 1,5 мл (Eppendorf, Германия) вносили 50 мкл препарата ферментной люминесцентной системы, пробирки помещали в люменометр (Glomax® 20/20, Promega BioSystems Sunnyvale, Inc., США) и регистрировали исходный уровень свечения. Затем к препарату добавляли 5 мкл раствора 10 мМ НАДФН (Serva, Германия), приготовленного in situ в ДИ воде, и регистрировали развитие люминесцентного сигнала. Наличие светового сигнала в ответ на добавку НАДФН свидетельствует о присутствии в препарате люминесцентной системы A. borealis эндогенного ГП, который утилизируется в реакции излучения, и является показателем функциональной активности ферментов системы . После снижения амплитуды светового сигнала до стационарного уровня к системе добавляли 5 мкл образца питательной среды (или экстракта из биомассы мицелия) и вновь регистрировали повышение интенсивности свечения, отражающего наличие ГП в тестируемой пробе. Интенсивность люминесценции регистрировали в режиме 1 измерение в 1 секунду и выражали в относительных единицах. Концентрацию ГП в изучаемых пробах рассчитывали по максимальному уровню их световой эмиссии, используя для расчетов калибровочный график, полученный ранее при тестировании проб с известной концентрацией высокочистого ГП (Sigma-Aldrich, США) .
3. Результаты и обсуждение
Использование высших грибов в биотехнологическом производстве биологически активных веществ предполагает необходимость изучения уровня их продукции в грибной биомассе и возможности его повышения при культивировании. В частности, известно, что на эффективность биосинтеза биоактивных соединений в грибном мицелии влияет состав питательной среды и условия выращивания. Например, в ряде исследований было показано, что от состава и соотношения компонентов питательной среды и технических параметров процесса культивирования в погруженных условиях (скорость перемешивания, температура, аэрация кислородом, время выращивания и др.) зависит выход биомассы грибного мицелия и уровень продукции в нем экзополисахаридного матрикса и внеклеточных ферментов , , , .
В настоящей работе выбор жидких питательных сред для глубинного культивирования гриба I. obliquus определялся тем, что они эффективно применялись ранее при выращивании биомассы мицелия высших грибов разных видов , , , . Как показали выполненные в настоящей работе исследования, выращивание базидиомицета I. obliquus в выбранных нами питательных средах и использованных технологических параметрах погруженного культивирования сопровождается ростом грибного мицелия в форме шарообразных пеллет с большим количеством поверхностных пучков гиф. При этом было показано, что состав питательной среды влияет на морфологию получаемых при выращивании пеллет мицелия.

Рисунок 1 - Морфология пеллет мицелия базидиомицета I. obliquus, полученных при погруженном культивировании гриба в питательных средах разного состава:
а – PD; б – S; в – YM
Примечание: регистрация изображения с помощью фотокамеры PowerShot S50 (Canon, Япония); масштабная линейка – 5 мм
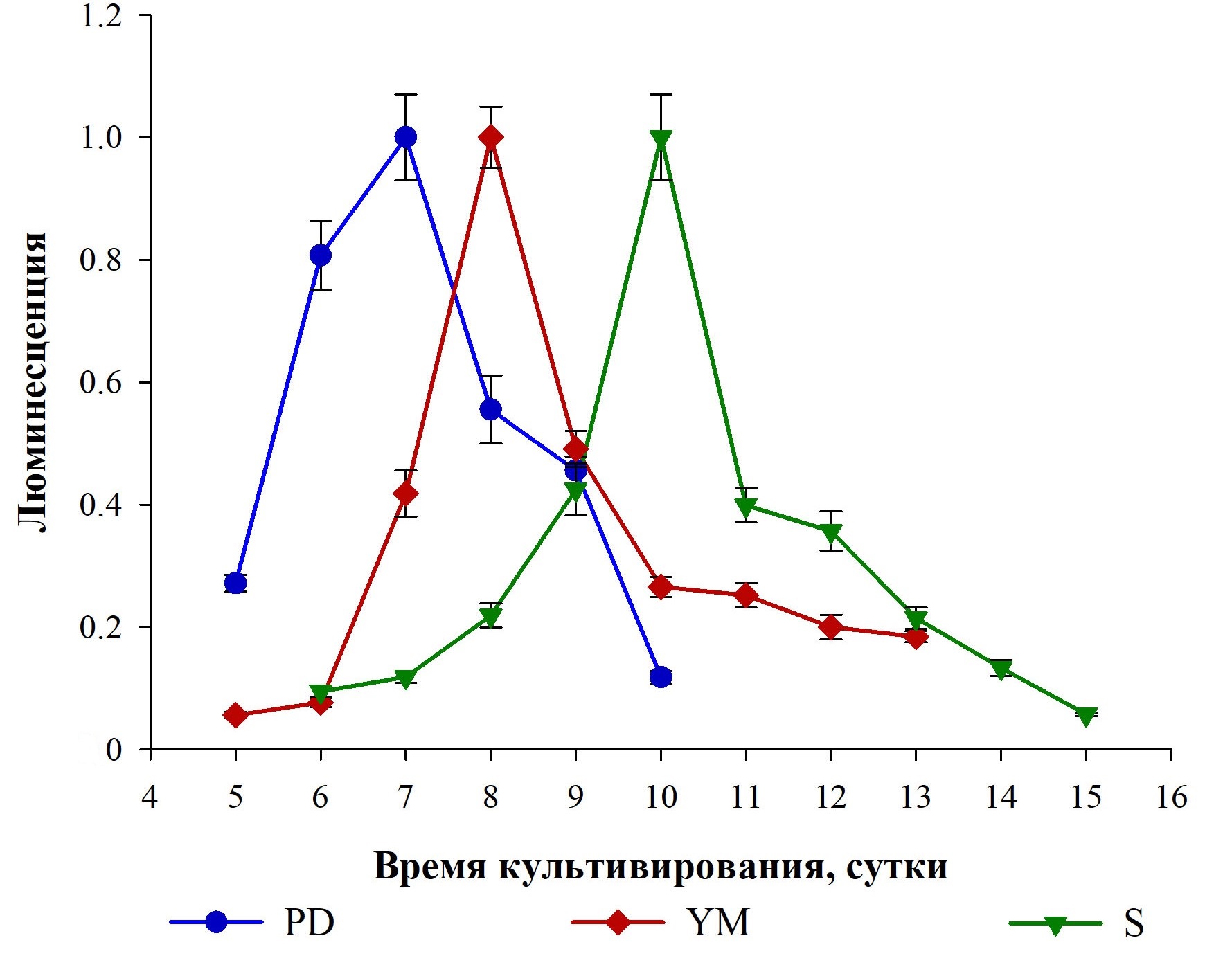
Рисунок 2 - Интенсивность люминесценции, отражающая динамику содержания ГП в разных питательных средах при культивировании базидиомицета I. obliquus в погруженных условиях
Примечание: данные нормированы на максимумы люминесценции в рядах измерений
Таблица 1 - Содержание ГП в питательных средах разного состава и в биомассе мицелия базидиомицета I. obliquus при культивировании гриба в погруженных условиях
| Питательная среда | Биомасса мицелия | |||
Среда | ГП (мг/мл) | Σ ГП (мг) | ГП (мг/г) | Σ Вес (г) | Σ ГП (мг) |
PS | - | - | 0,0021±0,0001 | 3,7±0,2 | 0,0077±0,0004 |
ME | - | - | 0,032±0,002 | 2,6±0,2 | 0,083±0,005 |
PD | 0,27±0,02 | 27±2 | 0,94±0,07 | 12,7±1,1 | 11,94±0,84 |
YM | 0,20±0,01 | 20±1 | 0,71±0,06 | 21±1 | 14,91±1,34 |
S | 0,25±0,02 | 25±2 | 0,54±0,04 | 8,96±0,8 | 4,84±0,34 |
По сравнению с представленными выше результатами в настоящей работе мы обнаружили значительные отличия в морфологии пеллет и содержании ГП при культивировании базидиомицета I. obliquus в питательных средах ME и PS. В экспериментах было установлено, что выращивание гриба в этих средах сопровождается ростом пеллет мицелия малых размеров (около 1–3 мм в диаметре) с большим количеством длинных (до 4–5 мм и более) пучков поверхностных гиф (рис. 3). При этом в образцах питательных сред ME и PS мы не выявили наличие ГП люминесцентным методом при культивировании гриба в течение 5-ти – 12-ти суток. Кроме того, по сравнению с мицелием, полученным при выращивании в средах PD, YM и S, в мицелии, выращенном в средах ME и PS, люминесцентным методом было зарегистрировано на 2-3 порядка меньшее содержание ГП (таблица 1).
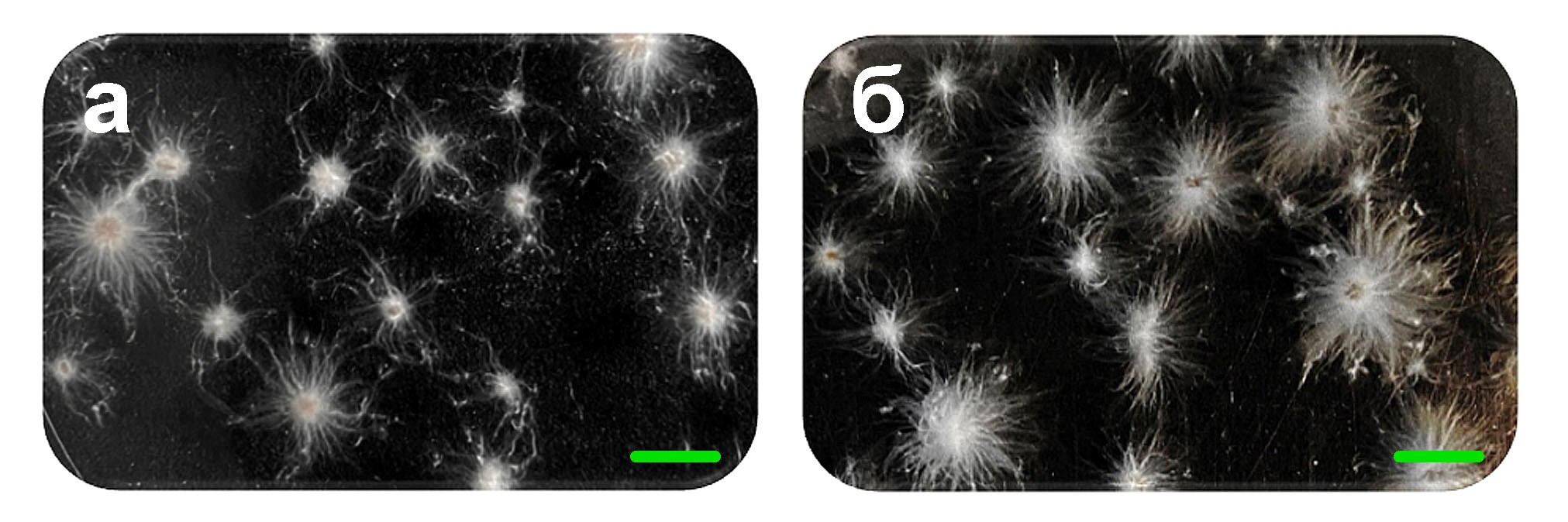
Рисунок 3 - Морфология пеллет мицелия базидиомицета I. obliquus, полученных при глубинном культивировании гриба в разных питательных средах:
а – PS; б – ME
Примечание: регистрация изображения с помощью фотокамеры PowerShot S50 (Canon, Япония); масштабная линейка – 5 мм
4. Заключение
В работе установлено, что выращивание базидиомицета I. obliquus в погруженных условиях при постоянном радиальном перемешивании культивационной среды сопровождается ростом грибного мицелия в виде шарообразных пеллет, морфология которых зависит от состава питательной среды. В питательных средах PD, YM и S наблюдается рост крупных пеллет мицелия с большим количеством коротких пучков гиф на поверхности, а при выращивании базидиомицета в питательных средах ME и PS наблюдается рост пеллет мицелия малых размеров с большим количеством длинных пучков поверхностных гиф. При этом также установлено, что состав питательной среды влияет на уровень биосинтеза ГП в грибе. Это может использоваться для увеличения продукции ГП на стадии культивирования базидиомицета I. obliquus за счет выбора оптимальной питательной среды. Так, в работе установлено, что выращиваемый в средах PD, YM и S грибной мицелий продуцирует и секретируют ГП в питательные среды. При этом наиболее подходящими средами для получения ГП являются среды PD и S, поскольку в них регистрируется максимальный уровень целевого продукта — 0,27 и 0,25 мг аналита на 1 мл среды соответственно. Среда YM также может быть использована в биотехнологическом получении ГП, однако в ней отмечается на 20–25% меньший уровень аналита, по сравнению со средами PD и S. Следует сказать, что питательные среды ME и PS не подходят для биотехнологического производства ГП. Выращиваемый в этих средах мицелий I. obliquus продуцирует крайне малое количество ГП и не секретирует целевой продукт в питательные среды. В целом, полученные в работе результаты создают предпосылки для разработки на основе гриба I. obliquus биотехнологического производства ГП — ценного целевого продукта, обладающего положительными фармакологическими эффектами.
