SECRETION OF BACILLUS CEREUS IN WOUND INFECTION
SECRETION OF BACILLUS CEREUS IN WOUND INFECTION
Abstract
The secretion of B. cereus from clinical specimens obtained from extraintestinal sterile and non-sterile loci is often regarded as contamination. No reports of wound infection associated with B. cereus have been found in the domestic literature. A case of severe local wound infection associated with B. cereus is described. A 39-year-old patient was admitted to a specialized surgical hospital on the 5th day after a gunshot wound of the left shin. In spite of active surgical treatment, i.e. repeated staged wound treatment, application of controlled negative pressure dressings and empirical antibacterial therapy, wound infection was progressing. During bacteriological examination, a monoculture of B. cereus resistant to cephalosporins used in empirical therapy was identified. After changing the surgical tactics and antibacterial drug, the wounded patient improved and recovered.
1. Введение
B. cereus – палочковидные, аэробные или факультативно-анаэробные, подвижные, хемоорганотрофные, условно-патогенные бактерии из семейства Bacillaceae. Они широко распространены в природе и выделяются из почвы, воды и ризосферы растений, кишечного тракта насекомых и млекопитающих, обсеменяют продукты питания и различные поверхности. Благодаря способности к спорообразованию, эти бактерии могут выживать в экстремальных условиях среды обитания, а также проявлять устойчивость к различным химическим веществам и физическим факторам, включая влажный пар, высушивание, ультрафиолетовое и гамма-излучение, вакуум и окисляющие агенты
. Спектр потенциальной токсичности B. cereus варьирует от штаммов, используемых в качестве пробиотиков, до возбудителей пищевых отравлений, а также тяжелых местных или системных внекишечных инфекций, таких как пневмония, септицемия, эндофтальмит, эндокардит, менингит, остеомиелит, послеоперационные, посттравматические и ожоговые раневые инфекции, неклостридиальный мионекроз , , , . Выделение B. cereus из образцов клинического материала, полученных из внекишечных стерильных и нестерильных локусов, зачастую расценивается как контаминация. В отечественной литературе описания случаев раневой инфекции, связанной с B. cereus, не обнаружено.Цель исследования – описать случай тяжелого течения местного раневого процесса, ассоциированного с Bacillus cereus.
2. Материалы и методы исследования
Пациент 39 лет, поступил в специализированный хирургический стационар на 5 сутки после осколочного слепого ранения мягких тканей левой голени с формированием раневого дефекта в нижней и средней трети. На предыдущих этапах проводился туалет раны, первичные и вторичные хирургические обработки. Антибактериальная профилактика и терапия 5 суток проводилась в эмпирическом режиме и включала цефуроксим (1,5 гр в/м 3 раза в сутки) и метронидазол (500 мг в/в 3 раза в сутки). Вводился подкожно 1 мл столбнячного анатоксина. При поступлении в стационар пациент предъявлял жалобы на наличие раны в области голени, боль, отечность стопы. В нижней трети левой голени на внутренней поверхности имелась рана с явлениями раневой инфекции.
Для бактериологического исследования был взят материал из глубины раны и направлен в бактериологическую лабораторию. Мазок окрашивали по Грамму и микроскопировали. Первичный посев клинического материала производили на 5%-й кровяной агар с эритроцитами барана, хромогенную среду «Уриселект», желточно-солевой агар Чистовича, тиогликолевую среду и агар Шедлера. После 24-часовой инкубации при 370С выросшие культуры идентифицировали методом времяпролетной масс-спектрометрии (масс-спектрометр BactoSCREEN (НПФ Литех, Россия)). Определение чувствительности к антибиотикам проводили диско-диффузионным методом в связи с отсутствием специализированных карт к автоматическим анализаторам. Результаты оценивали на основании критериев интерпретации, представленных в отечественных рекомендациях 2023 года
.3. Обследование на момент госпитализации
Состояние при поступлении средней степени тяжести. Тяжесть повреждения по шкале ВПХ-П (ОР) 2,8 баллов (повреждение тяжелое), по шкале SOFA – 0 баллов. Объективно: температура тела 37,50С, положение активное, передвигается самостоятельно с опорой на костыли. Левая нижняя конечность иммобилизована гипсовой повязкой. Кожные покровы обычной окраски. Периферические лимфатические узлы не увеличены. Пульс равномерный, ритмичный, 78 ударов в минуту. Артериальное давление 130 и 75 мм. рт. ст. Частота дыхательных движений 18 в минуту. Дыхание жесткое, хрипов нет. Сатурация O2 99% при дыхании атмосферным воздухом. Живот мягкий, при пальпации безболезненный. Печень и селезенка не увеличены.
Локальный статус: в нижней трети левой голени на внутренней поверхности имеется рана неправильной звездчатой формы в виде дефекта кожи, подкожно-жировой клетчатки и мышечной ткани с явлениями околораневого воспаления. Размеры раны 15х11 см. Кожа по краям раны с некротическими очагами застойно-синюшно-бордового цвета, переходящими без четкой демаркационной линии в неповрежденный кожный покров. Дно раны представлено поврежденными камбаловидной мышцей и длинным сгибателем пальцев, а также надкостницей большеберцовой кости. Мышцы в ране багрового цвета с множественными некрозами в виде участков «вареного мяса». Окружающие ткани умеренно гиперемированы, отечны, пальпация их болезненная. Отделяемое серозное, мутное. Признаков подкожной эмфиземы, восходящего тромбофлебита, лимфангита, а также тромбоза вен не отмечено (Рис. 1). Стопа теплая на ощупь, определяется пульсация на периферических артериях стопы. Движения в левом голеностопном суставе, пальцев левой стопы ограничены болевым синдромом. Периферических неврологических нарушений не отмечено. Уровень лейкоцитов составил 12,9х109/л, без сдвига лейкоцитарной формулы влево, уровень прокальцитонина не превышал референтных значений. Обращало на себя внимание отсутствие выраженных признаков системной воспалительной реакции, несмотря на выраженные признаки инфекционного процесса на голени.
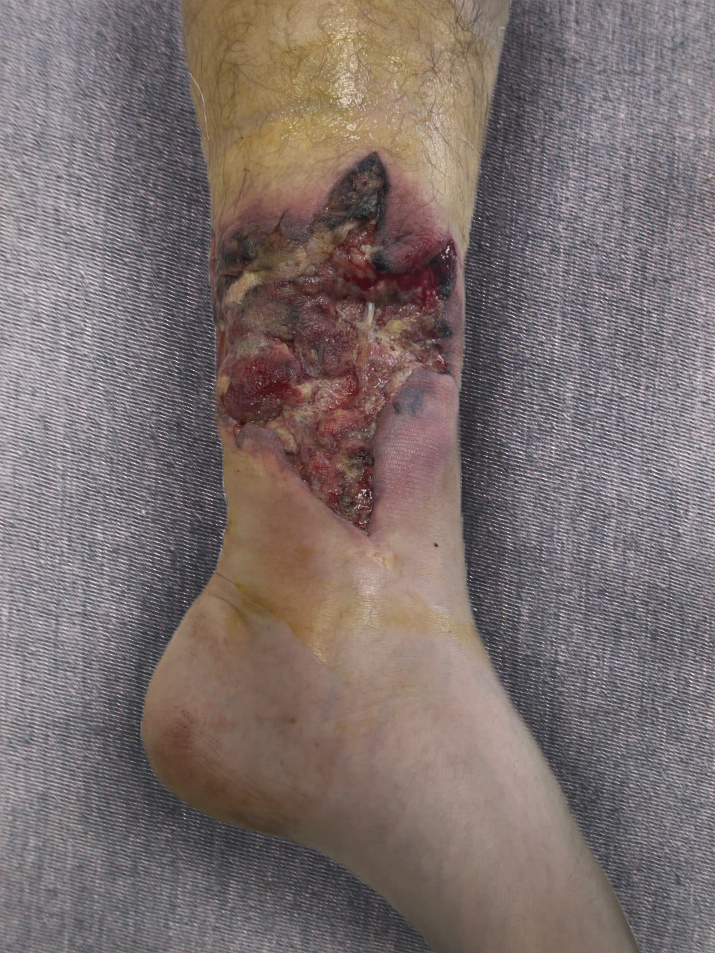
Рисунок 1 - Рана левой голени в день госпитализации
Примечание: 5 сутки от момента ранения
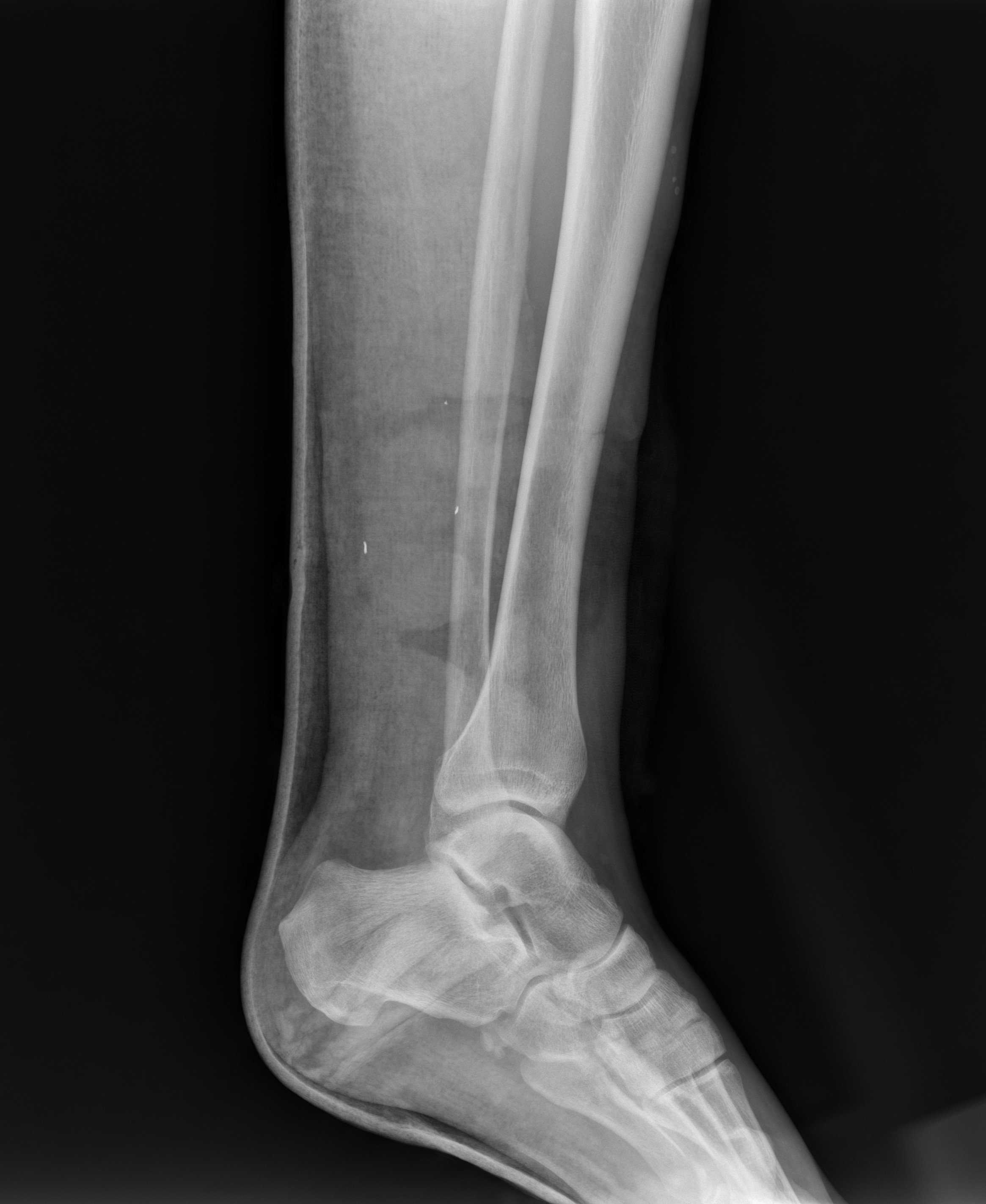
Рисунок 2 - Рентгенограмма левой голени
Примечание: видны мелкие инородные тела и незавершенный перелом нижней трети большеберцовой кости
Установлен окончательный диагноз: «Осколочное слепое ранение мягких тканей нижней трети левой голени с повреждением камбаловидной мышцы, длинного сгибателя пальцев с формированием дефекта мягких тканей, неполным переломом левой большеберцовой кости, множественные инородные тела».
При бактериологическом исследовании выявлены грамположительные факультативно-анаэробные спорообразующие гемолитически активные и продуцирующие лецитиназу палочковидные бактерии, идентифицированные как B. cereus (Рис. 3А, 3Б). Выделенная культура была устойчива к пенициллину, цефазолину, цефтриаксону, цефепиму и чувствительна к имипенему, меропенему, ципрофлоксацину, левофлоксацину, ванкомицину, эритромицину, клиндамицину и линезолиду. Роста анаэробной флоры не выявлено.
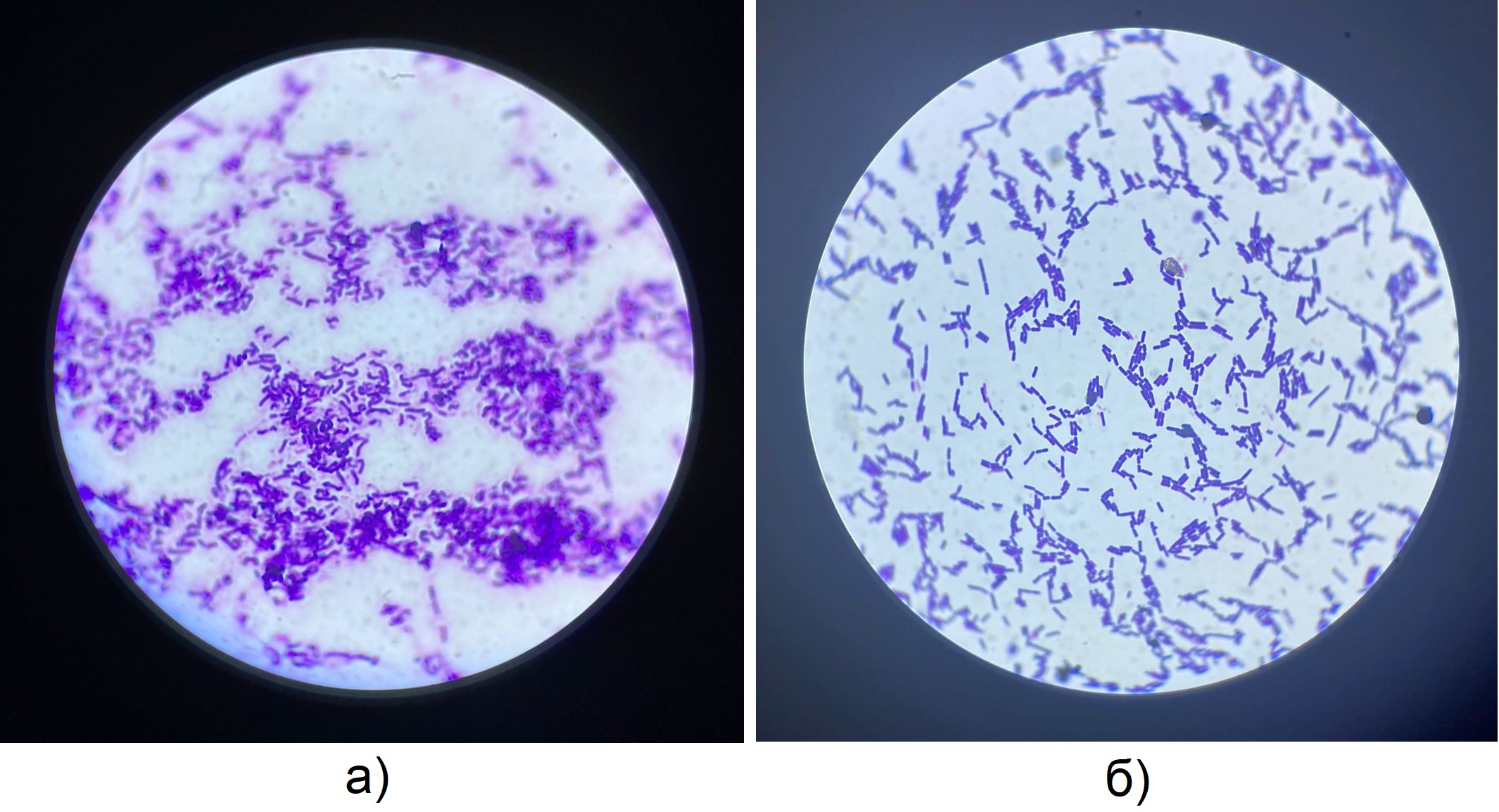
Рисунок 3 - Нативный мазок из раны (а) и со среды обогащения (б)
Примечание: окраска по Грамму; увеличение х100
4. Результаты
Пациент получал комплексную терапию: местное лечение, антибактериальную терапию. Проводилась профилактика тромбоэмболических осложнений, симптоматическая терапия.
Ежедневно выполнялись вторичные хирургические обработки раны под общей анестезией. Отсутствие гнойного отделяемого, характера некротических измнений говорил в пользу анаэробного процесса, в связи с этим, на первых этапных санациях система лечения ран отрицательным давлением не использовалась. Проводились ультразвуковая кавитация раны, этапные некрэктомии, перевязки с раневыми покрытиями в зависимости от фазы процесса. Дополнительно, в начале перевязки – сеансы локального ультрафиолетового облучения раны. Продолжалась лечебная иммобилизация конечности.
Особенностями течения раневого процесса являлись выраженные нарушения микроциркуляции (не отмечено капиллярных кровотечений), отсутствие признаков регенерации в ране на протяжении первых 14 суток лечения (Рис. 4, 5). С другой стороны, отмечалась повышенная кровоточивость из сосудов малого диаметра при активной санации. Еще одной особенностью являлась необходимость проводить экономные резекции только явно нежизнеспособных тканей для сохранения и восстановления функции конечности в связи с малым объемом мягких тканей в нижней трети голени.
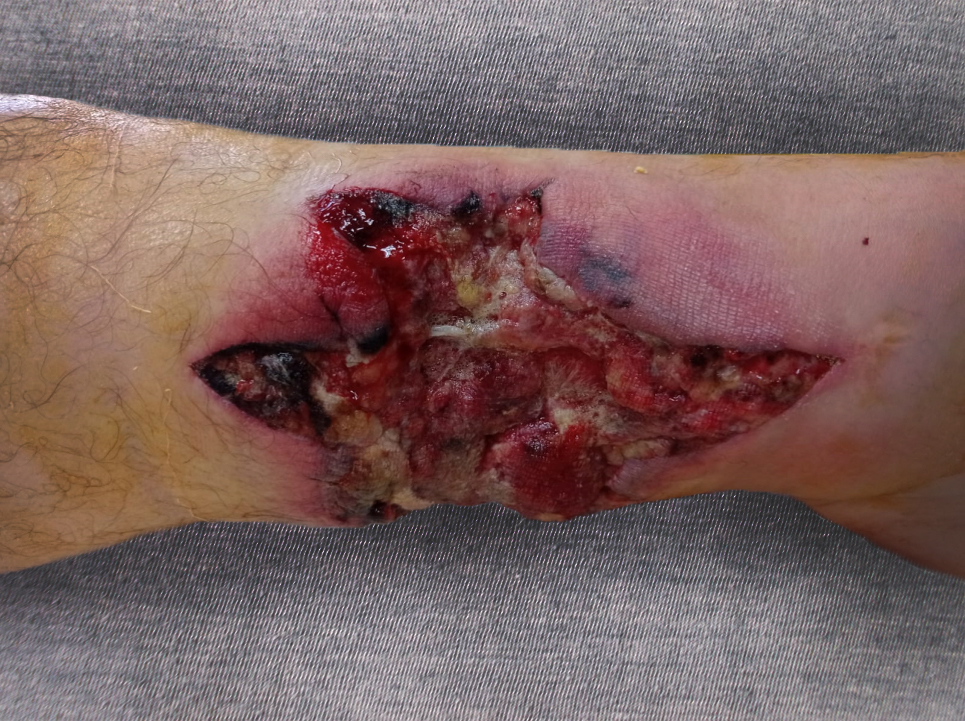
Рисунок 4 - Вид раны на 14-е сутки лечения
Примечание: появление первых признаков регенерации
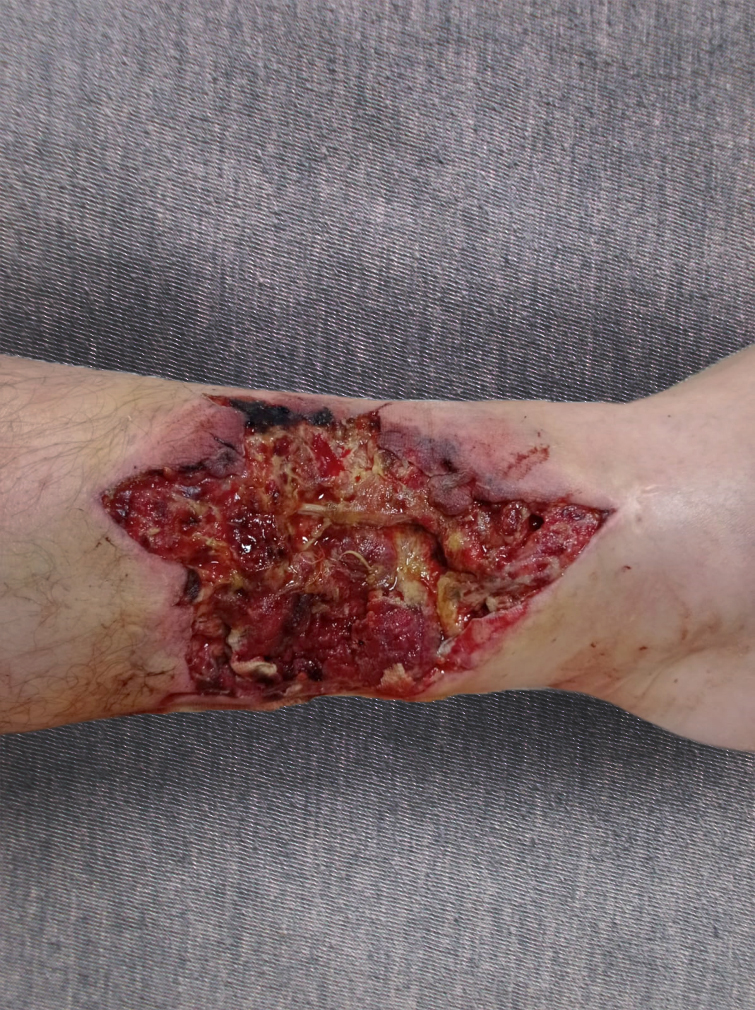
Рисунок 5 - Вид раны на 21-е сутки лечения
Примечание: восстановление микроциркуляции, появление контактной кровоточивости
В результате лечения к 30-м суткам общие и местные признаки раневой инфекции купированы (Рис. 5). Рана заполнилась сочными, контактно кровоточащими грануляциями. Достигнуто клиническое выздоровление. На 45-е сутки пациент переведен на реабилитационный этап лечения, на котором пациенту выполнена операция пластика островковым суральным лоскутом на дистальной ножке и аутодермопластика местными тканями (Рис. 6, 7А, 7Б, 7В).
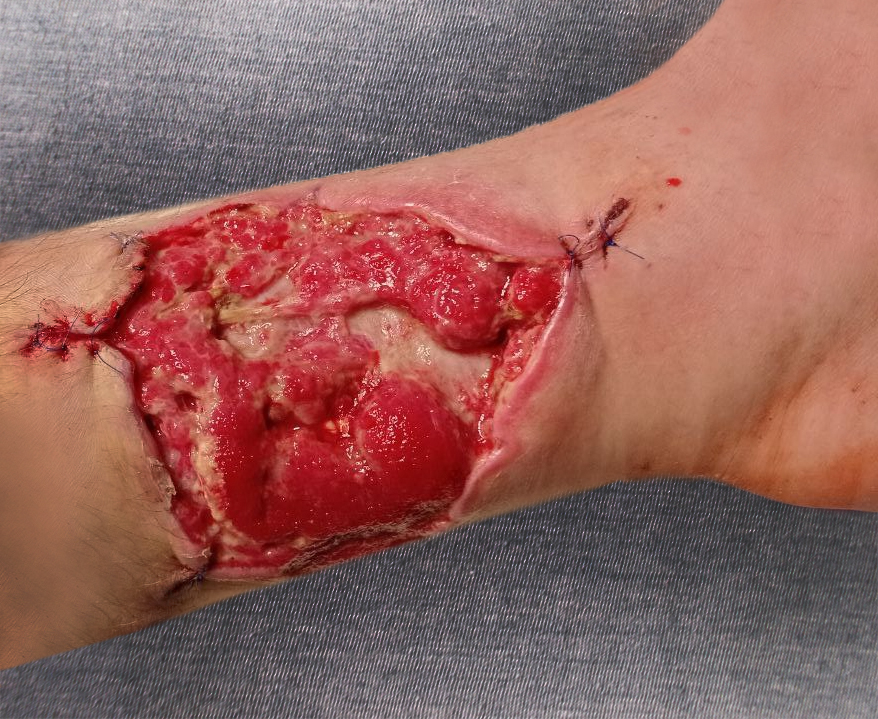
Рисунок 6 - Вид раны на 30-е сутки лечения
Примечание: перед закрытием дефекта
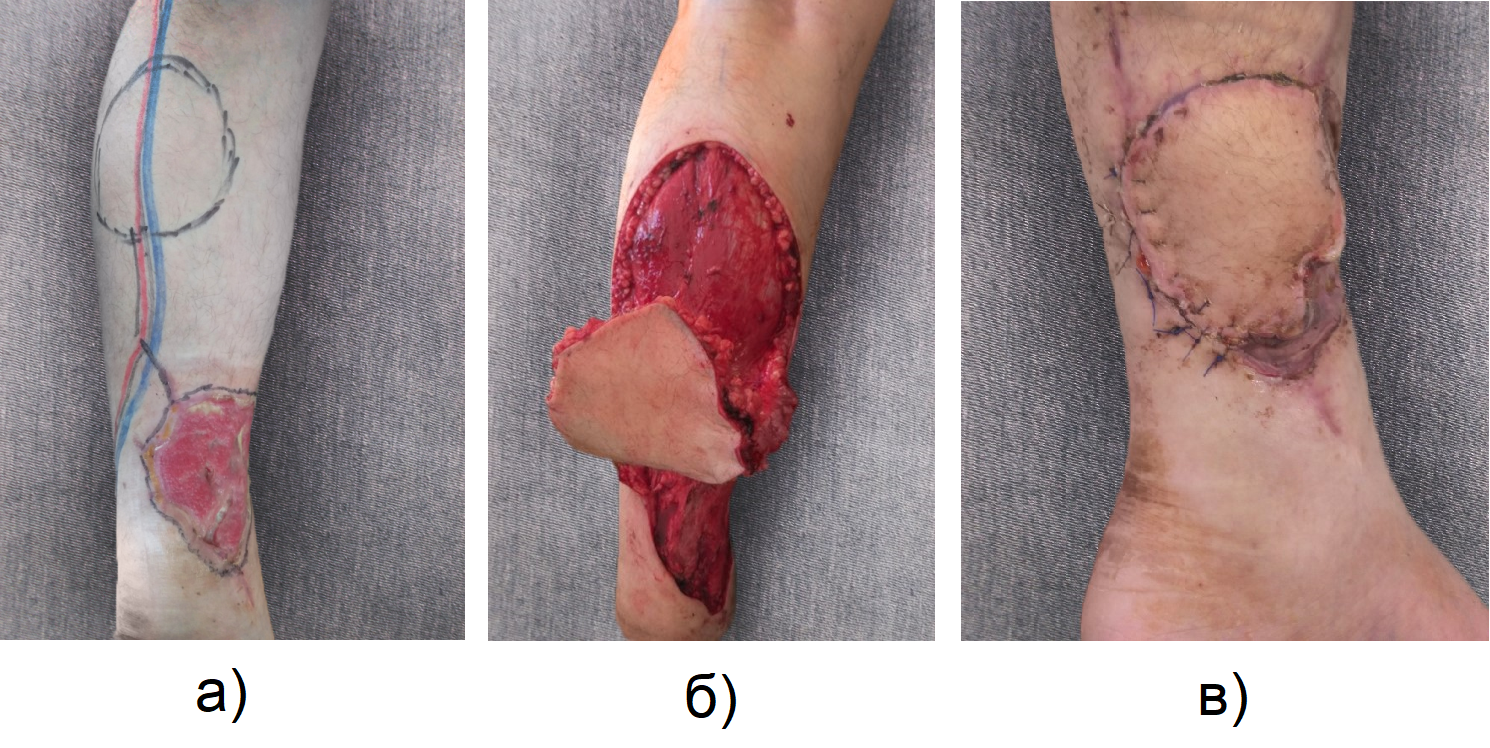
Рисунок 7 - Пластика раны суральным лоскутом на дистальной ножке:
а - подготовка операционного поля; б - ход операции; в - результат
5. Обсуждение
В настоящее время в структуре ранений ведущими локализациями являются повреждения конечностей (до 70%), что может быть связано как с широким применением взрывного оружия, так и с использованием современных бронежилетов, защищающих область груди и живота от большинства пуль и осколков , . При применении разрывных боеприпасов в раны могут попасть как представители собственной микрофлоры раненого, так и содержащиеся в почве вегетативные клетки и споры бактерий , , . Часть их вытесняется в процессе формирования микрофлоры раны, часть погибает под действием профилактически введенных антибактериальных препаратов. Оставшиеся в ране устойчивые микроорганизмы сохраняют возможность роста и размножения.
Наиболее угрожающими раневыми инфекциями, развивающимися в ранних сроках после ранения, являются некротизирующие инфекции мягких тканей. К ним относятся клостридиальный мионекроз (газовая гангрена) и полимикробная инфекция, вызванная грамположительными кокками Peptostreptococcus, Staphylococcus, Enterococcus, грамотрицательными бактериями порядка Enterobacterales и родов Pseudomonas, Acinetobacter, а также анаэробными палочками родов Prevotella, Bacteroides, которые могут вызвать быстро прогрессирующую инфекцию в подкожной клетчатке и/или в мышцах путем выработки экзотоксинов и привести к бактериемии, токсемии и септическому шоку
. Выделение из ран B. cereus, как правило, расценивается как контаминация. Однако инфекция B. cereus может клинически имитировать клостридиальный мионекроз или стрептококковый некротический фасциит , . Кроме того, этот микроорганизм способен к образованию биопленки и, как правило, устойчив к бета-лактамным антибиотикам за счет продукции ферментов бета-лактамаз и метронидазолу – препаратам эмпирического выбора при анаэробной инфекции .6. Заключение
Лечение антибиотиками иногда бывает неадекватным из-за неправильной интерпретации клинического и бактериологического диагноза инфекций, вызванных B. cereus. В описанном нами случае селективные преимущества оказались у B. cereus, устойчивого к цефалоспоринам за счет присущей ему продукции бета-лактамаз, поэтому своевременное выявление возбудителя и назначение адекватной антибактериальной терапии способствовали выздоровлению раненого.
