PHYSIOLOGICAL PARAMETERS AND ANTIOXIDANT ACTIVITY OF CELLS OF PHOTOMIXOTROPHIC CALLUS CULTURE TRIGONELLA FOENUM-GRAECUM L. UNDER THE INFLUENCE OF SELENIUM
ФИЗИОЛОГИЧЕСКИЕ ПОКАЗАТЕЛИ И АНТИОКСИДАНТНАЯ АКТИВНОСТЬ КЛЕТОК ФОТОМИКСОТРОФНОЙ КАЛЛУСНОЙ КУЛЬТУРЫ TRIGONELLA FOENUM-GRAECUM L. ПРИ ДЕЙСТВИИ СЕЛЕНА
Научная статья
ORCID: 0000-0002-0084-9069,
Белорусский государственный университет, Минск, Беларусь
* Корреспондирующий автор (hanna.lohvina[at]gmail.com)
АннотацияПредставлены результаты определения параметров роста, содержания и соотношения фотосинтетических пигментов, уровня накопления фенольных соединений и антирадикальных свойств клеток фотомиксотрофной каллусной культуры пажитника греческого (Trigonella foenum-graecum L.) при введении в состав питательной среды неорганического источника селена (Se) в форме селенита натрия в концентрациях 10-8-10-3 М. Установлено, что токсической для каллусной ткани является концентрация селенита, равная 10-3 М. На это указывает полное ингибирование ростовых процессов культуры, а также изменения, происходящие в содержании и соотношении фотосинтетических пигментов, являющиеся свидетельствами значительного подавления работы фотосинтетического аппарата. При более низких концентрациях экзогенного вещества значимый ответ со стороны физиологических показателей каллусной культуры либо вовсе отсутствует (10-8-10-5 М), либо негативные последствия касаются только ростовых процессов (10-4 М), не затрагивая функционирование пигментной системы фотосинтетического аппарата. Небольшое снижение уровня фотосинтетических пигментов происходит под действием 10-5 и 10-3 М тестируемого вещества. Положительная корреляция между содержанием фенольных соединений и антирадикальной активностью водно-спиртовых экстрактов каллусной ткани при варьировании концентрации селенита натрия в питательной среде свидетельствует о значительной роли данных метаболитов в проявлении антиоксидантных свойств объекта.
Ключевые слова: Trigonella foenum-graecum, пажитник греческий, каллус, культура клеток in vitro, селенит натрия, селен, индекс роста, фотосинтетические пигменты, фенольные соединения, антирадикальная активность, DPPH.
PHYSIOLOGICAL PARAMETERS AND ANTIOXIDANT ACTIVITY OF CELLS OF PHOTOMIXOTROPHIC CALLUS CULTURE TRIGONELLA FOENUM-GRAECUM L. UNDER THE INFLUENCE OF SELENIUM
Research article
Logvina A.O.*
ORCID: 0000-0002-0084-9069,
Belarusian State University, Minsk, Belarus
* Corresponding author (hanna.lohvina[at]gmail.com)
AbstractThe current study presents the results of determining the growth parameters, the content and ratio of photosynthetic pigments, the level of accumulation of phenolic compounds and antiradical properties of cells of a photomixotrophic callus culture of fenugreek (Trigonella foenum-graecum L.) when an inorganic source of selenium (Se) in the form of sodium selenite in concentrations of 10-8-10-3 M is introduced into the nutrient medium. It was found that the concentration of selenite equal to 10-3 M is toxic for the callus tissue. This is indicated by the complete inhibition of the growth processes of the culture as well as changes in the content and ratio of photosynthetic pigments, which are evidence of significant suppression of the photosynthetic apparatus. At lower concentrations of the exogenous substance, there is a significant response from the physiological parameters of the callus culture or there is no response (10-8-10-5 M), or negative consequences relate only to growth processes (10-4 M) without affecting the functioning of the pigment system of the photosynthetic apparatus. A slight decrease in the level of photosynthetic pigments occurs when introducing 10-5 and 10-3 M of the tested substance. The positive correlation between the content of phenolic compounds and the antiradical activity of water-alcohol extracts of callus tissue with varying concentrations of sodium selenite in the nutrient medium indicates a significant role of these metabolites in the manifestation of the antioxidant properties of the object.
Keywords: Trigonella foenum-graecum, fenugreek, callus, cell culture in vitro, sodium selenite, selenium, growth index, photosynthetic pigments, phenolic compounds, antiradical activity, DPPH.
Введение
Культуры клеток растений in vitro на протяжении многих десятилетий являются важными объектами биологических исследований. Применение клеточных культур обеспечивает возможность постановки полностью контролируемого эксперимента с использованием клеток практически любых видов растений (в том числе экзотических и редких), позволяет получать результаты в относительно короткие сроки, моделировать действие любых экзогенных факторов, а также нивелировать влияние посторонних воздействий.
Одновременно с этим результаты по изучению влияния экзогенных факторов на физиологические показатели и биосинтетический потенциал клеточных культур являются основой для создания промышленной технологии получения лекарственных препаратов, пищевых добавок и т.д. В процессе таких экспериментов варьированию подвергаются как физические факторы культивирования, так и качественный и количественный состав питательной среды [1]. Зачастую питательные среды дополняются новыми компонентами, одним из которых может являться селен (Se).
Известно, что Se повышает устойчивость растений к действию неблагоприятных факторов среды за счет активизации работы ферментативной антиоксидантной системы и накопления низкомолекулярных антиоксидантов. Наряду с чем, одной из его функций является непосредственное участие в антиоксидантных процессах за счет включения в составе кофактора в глутатионпероксидазу [2], [3]. Кроме этого, указанный элемент выступает в качестве элиситора, стимулируя рост и увеличивая продуктивность растений [4], а также может регулировать их вторичный синтез [5]. В целом влияние Se на метаболизм различных организмов связано с важной ролью Se-содержащих и Se-зависимых ферментов, таких как редуктаза, фосфолипиддегидропероксидаза, формиатдегидрогеназа, дейодиназа и др. Таким образом, хотя данный металл и не относится к числу жизненно необходимых для растений элементов, его важнейшая роль в нормальном протекании многих внутриклеточных процессов не подвергается сомнению.
Выращивание клеточных культур растений в присутствии Se предположительно может замедлить процесс старения клеток, увеличивая тем самым продолжительность стационарной фазы роста, вследствие активизации системы антиоксидантной защиты. В то же время элиситорные свойства Se могут привести к повышению уровня накопления биомассы и/или целевых метаболитов в культуре растительных клеток. Так, добавление Se-содержащих компонентов в питательную среду может значительно улучшить характеристики данных объектов. При этом особенности влияния Se на физиологические показатели клеточных культур, как и на их биосинтетические свойства и антиоксидантный потенциал, как отмечается в работе [6], до сих пор мало изучены, что, несомненно, определяет актуальность подобных исследований. Кроме этого, в литературе отсутствуют сведения о влиянии соединений металла на функционирование фотосинтетического аппарата в клетках in vitro, хотя именно хлоропласты являются основными сайтами ассимиляции Se [7].
В этой связи, целью данной работы было установление закономерностей воздействия одной из основных неорганических форм Se – селенита натрия – на некоторые физиологические показатели, в том числе содержание фотосинтетических пигментов, а также антиоксидантные свойства фотомиксотрофной каллусной культуры пажитникого греческого (Trigonella foenum-graecum L.). T. foenum-graecum представляет собой важное пряно-ароматическое и пищевое растение, обладающее также широким спектром терапевтических эффектов, обусловленных высоким содержанием комплекса фармакологически важных веществ (сапонинов, фенольных соединений, алкалоидов и др.). Культура клеток данного растения на протяжении нескольких десятилетий привлекает внимание ученых как альтернативный источник получения указанных метаболитов [8], [9]. Se же может сыграть существенную роль в повышении уровня ее продуктивности. При этом наличие хлоропластов в используемой каллусной линии, позволяет провести изучение влияния минерального элемента на характеристики фотосинтетического аппарата клеток в условиях in vitro.
Методы и принципы исследования
Объект исследования – фотомиксотрофная каллусная культура T. foenum-graecum. Была получена из гетеротрофного каллуса листового происхождения T. foenum-graecum ярового сорта Ovari 4, путем продолжительного (более 6 месяцев) культивирования на свету в условиях фитостата (14 ч свет/10 ч темнота, интенсивность освещения 3000 лк) при комнатной температуре. Выращивание тестируемой каллусной ткани осуществляли на агаризованной среде Мурасиге и Скуга, дополненной 4% сахарозы и фитогормонами 2,4-дихлорфеноксиуксусной кислотой, 3-индолилуксусной кислотой и кинетином в концентрации 2,0 мг/л [10].
В качестве Se-содержащего соединения применяли одну из основных неорганических форм элемента, эффективно поглощаемую и метаболизируемую растительными клетками, – селенит натрия (Na2SeO3) [11]. Концентрация селенита натрия в средах составляла 10-8, 10-7, 10-6, 10-5, 10-4 и 10-3 М. Контрольной служила питательная среда без добавления данного вещества.
Для оценки активности ростовых процессов каллусной культуры рассчитывали индекс роста по сырой и сухой биомассе [12].
Определение содержания фотосинтетических пигментов (хлорофиллов a, b и каротиноидов) в ацетоновых вытяжках проводили спектрофотометрически по общепринятой методике [13].
Общее содержание фенольных соединений находили спектрофотометрически по методу Фолина-Чокальтеу [14]. Экстракцию осуществляли 70 %-ным этанолом (соотношение сырье : экстрагент – 1 : 100), путем настаивания смеси в течение 24 ч при непрерывном помешивании при комнатной температуре с последующим нагреванием на водяной бане в течение 1 ч при 70°С. Сумму фенолов выражали в мг/г сухой массы в эквиваленте галловой кислоты.
Антирадикальную активность тех же экстрактов определяли спектрофотометрически методом DPPH (2,2-дифенил-1-пикрилгидразил). Сперва рассчитывали процент ингибирования радикалов DPPH. После чего по калибровочной кривой, построенной для аскорбиновой кислоты, находили антирадикальную активность экстрактов, которую выражали в мг/г сухой массы в эквиваленте активности аскорбиновой кислоты [15].
Эксперименты проводили в трех биологических и трех-четырех аналитических повторностях. Данные представлены в виде средних значений и стандартной ошибки средней. Оценку линейной связи между количественными переменными проводили с помощью коэффициента Пирсона. Гипотезу о наличии достоверной положительной корреляции считали подтвержденной при р≤0,05.
Основные результаты
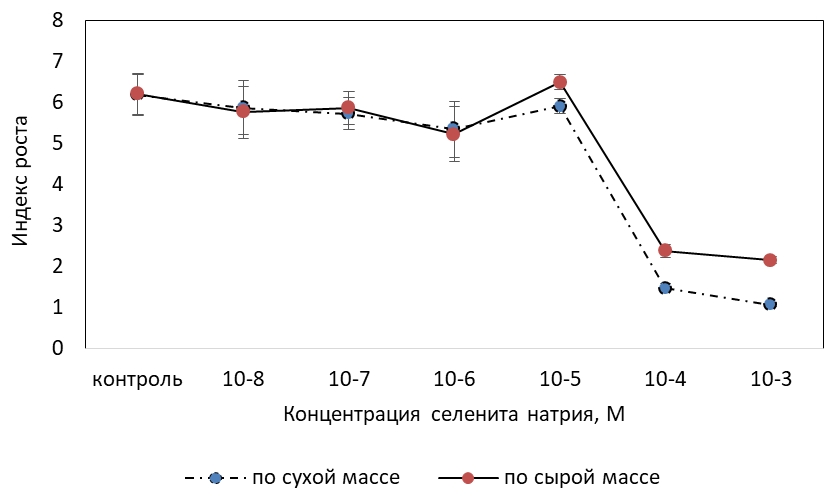
На первом этапе исследования был установлен характер действия селенита натрия на активность роста фотомиксотрофной каллусной культуры T. foenum-graecum (см. рисунок 1).
Показано, что добавление в среду селенита натрия в концентрациях 10-8–10-5 М существенно не отразилось на индексе роста каллуса, найденном как по сырой, так и по сухой биомассе. При использовании питательной среды, дополненной 10-4 и 10-3 М Se-содержащей соли, наблюдалось сильное торможение ростовых процессов. Эффект ингибирования по сырой массе составил более 80%, по сухой массе – около 60%.
Рис. 1 – Влияние селенита натрия на индекс роста фотомиксотрофной каллусной культуры пажитника греческого по сырой и сухой массе
Достоверных отличий в темпах роста каллусной ткани по сухой массе, выращиваемой в присутствии селенита в данных концентрациях, не было. Тогда как ростоингибирующее действие, оцененное по индексу роста по сырой массе, под действием 10-3 М селенита натрия оказалось более выраженным, чем для среды, включающей 10-4 М Se. Исходя из чего, снижение интенсивности роста каллусной культуры, вызванной селенитом натрия в концентрациях 10-4 М и, особенно, 10-3 М, происходило, в том числе вследствие уменьшения оводненности клеток.
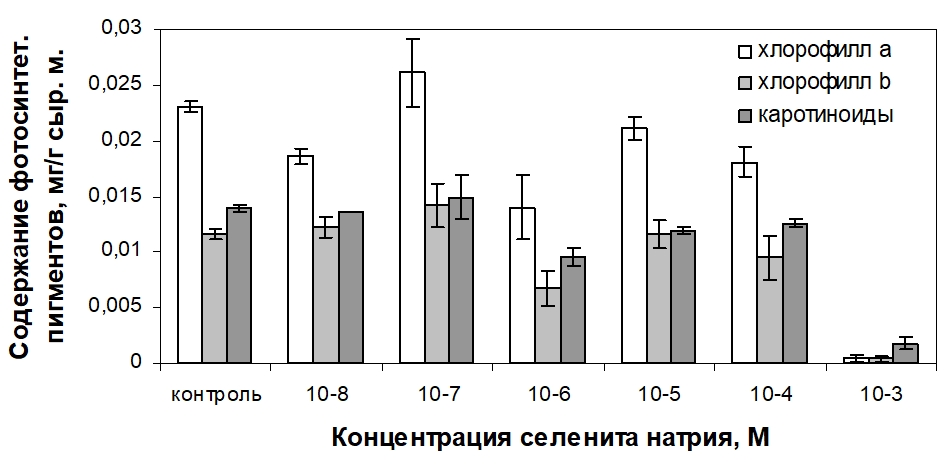
На рисунке 2 приведены данные по количественному содержанию фотосинтетических пигментов. Как уже отмечено выше, исследования по установлению действия соединений Se на содержание фотосинтетических пигментов в клеточных культурах ранее не проводились.
Рис. 2 – Влияние селенита натрия на содержание фотосинтетических пигментов в фотомиксотрофной каллусной культуре пажитника греческого
Внесение в питательную среду селенита натрия в концентрациях 10-8 и 10-6 М привело к снижению содержания фотосинтетических пигментов в 1,5 раза по сравнению с контролем. Селенит натрия в концентрациях 10-5 и 10-4 М вызвал небольшое уменьшение уровня хлорофилла а, тогда как содержание хлорофилла b и каротиноидов достоверно не изменилось. Значительный негативный эффект наблюдался при добавлении в состав среды соли Se в концентрации 10-3 М. В данном случае биосинтез зеленых пигментов был практически подавлен, и количественно преобладали каротиноиды. И лишь в присутствии селенита натрия в концентрации 10-7 М наблюдалась тенденция к повышению содержания фотосинтетических пигментов в каллусе, однако достоверных различий с контролем обнаружено не было.
Согласно расчетам суммарного содержания хлорофиллов а и b, отражающего изменения, происходящие в общем пуле зеленых пигментов, обнаруживается заметное снижение общего содержания хлорофиллов при действии селенита натрия в концентрациях 10-6 и 10-4 М. Чрезвычайно низкое значение показателя было продемонстрировано на питательной среде с 10-3 М селенита натрия, что стало результатом практически полного ингибирования накопления хлорофилла обеих форм.
Соотношение хлорофиллов демонстрирует изменение в балансе между хлорофиллами а и b, в первую очередь, вследствие их взаимопревращения. Применение селенита натрия в диапазоне концентраций 10-8–10-4 М не повлекло за собой значимого смещения соотношения хлорофиллов по сравнению с контролем. Только в случае введения в среду 10-3 М селенита наблюдалось практически двукратное снижение показателя, указывающего на повышение уровня хлорофилла b относительно хлорофилла а.
Для растительных клеток важным показателем является также отношение суммарного содержания хлорофиллов к содержанию каротиноидов. Данный показатель обычно стабилен и его значительные изменения наблюдаются, как правило, при воздействии неблагоприятных факторов среды. Установлено, что селенит натрия в диапазоне концентраций 10-8–10-4 М не оказывает существенного влияния на соотношение пигментов разных групп. Сильное падение значения данного показателя происходит лишь в случае наиболее высокой из тестируемых концентраций селенита вследствие существенного превышения содержания каротиноидов над уровнем хлорофиллов.
Фенольные соединения представляют собой один из наиболее распространенных и многочисленных классов природных биологически активных веществ. Будучи продуктами вторичного метаболизма растений, они принимают активное участие в окислительно-восстановительных процессах, выработке иммунитета, регуляции роста, а благодаря особенностям структуры, являются эффективными природными антиоксидантами. Влияние Se на накопление вторичных метаболитов, в частности фенольных соединений, в культуре клеток in vitro мало изучено.
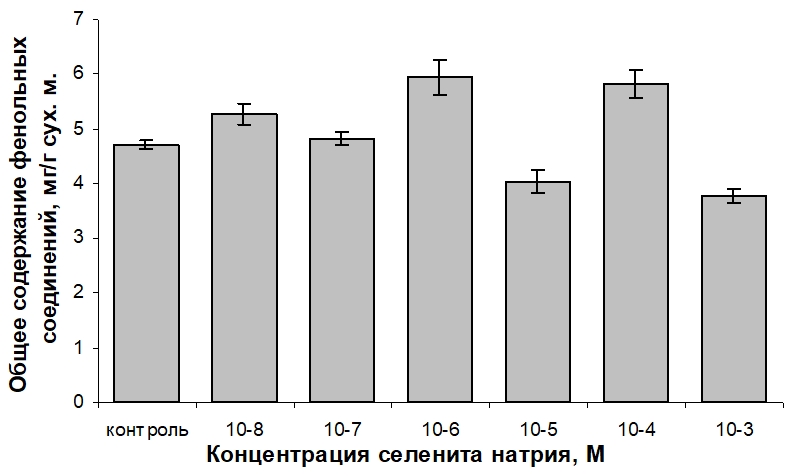
На рисунке 3 представлена зависимость общего содержания фенольных соединений в клеточной культуре от концентрации селенита натрия в питательной среде.
Важно отметить, что довольно высокий уровень фенольных соединений регистрировался во всех вариантах опыта. Так, статистически достоверный стимулирующий накопление фенольных соединений эффект от введения в среду селенита натрия наблюдался в случае применения его в концентрациях 10-8, 10-6 и 10-4 М. Причем повышение значений данного показателя для селенита в концентрациях 10-6 и 10-4 М практически достигло 30 % от контроля. В присутствии селенита натрия в концентрации 10-7 М уровень метаболитов фенольной природы в клетках каллуса T. foenum-graecum существенно не изменился. Уменьшение показателя обнаружено для вариантов сред с 10-5 и 10-3 М селенита (на 15 и 20 % относительно контроля соответственно).
Рис. 3 – Влияние селенита натрия на общее содержание фенольных соединений в фотомиксотрофной каллусной культуре пажитника греческого
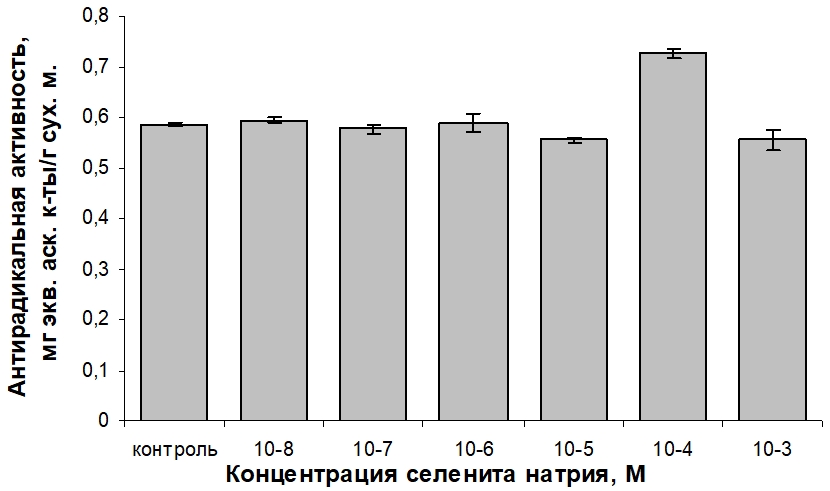
Важнейшей функцией Se является его непосредственное участие в антиоксидантных процессах. Однако повышенное содержание ионов металлов в питательной среде по сравнению с нормой является одним из факторов стресса для растительной клетки. Воздействие же стресс-факторов ведёт к накоплению свободных радикалов в клетках и активизации антиоксидантной системы защиты. Исходя из указанных соображений, следующим этапом исследования было определение антирадикальной активности водно-спиртовых экстрактов каллусной культуры T. foenum-graecum при варьировании экзогенной концентрации селенита натрия. Полученные данные представлены на рисунке 4.
Рис. 4 – Влияние селенита натрия на антирадикальную активность водно-спиртовых экстрактов фотомиксотрофной каллусной культуры пажитника греческого
Введение в состав среды селенита натрия в интервале концентраций 10-8–10-6 М не оказало достоверного по сравнению с контролем изменения антирадикальной активности экстрактов каллуса T. foenum-graecum. Небольшое снижение способности ингибировать свободные радикалы экстрактом каллуса отмечено при применении соли Se в концентрациях 10-5 и 10-3 М. Существенная (25 %-ная) стимуляция антирадикальной активности наблюдается для варианта среды, дополненной селенитом натрия в концентрации 10-4 М.
Корреляционный анализ выявил наличие достоверной положительной связи между общим содержанием фенольных соединений в фотомиксотрофном каллусе T. foenum-graecum и антирадикальной активностью его водно-спиртовых экстрактов в условиях варьирования концентрации селенита натрия в среде (коэффициент Пирсона равен 0,67 при количестве степеней свободы 5 при p≤0,05), что указывает на доминирующую роль фенолов в проявлении противорадикальных свойств каллусных клеток.
ОбсуждениеИзвестно, что влияние соединений селена на растительные объекты носит дозозависимый характер. При его действии в высоких концентрациях, как правило, наблюдаются негативные последствия, что является результатом следующих процессов. Так, под действием Se может происходить ингибирование метаболических путей за счет замещения данным элементом серы (S) в S-содержащих аминокислотах – цистеине (Цис) и метионине (Мет) – с образованием Se-Цис и Se-Мет [11]. Кроме этого, Se может действовать как прооксидант, индуцируя накопление активных форм кислорода (АФК), в результате чего растительные клетки подвергаются окислительному стрессу. Также он может принимать непосредственное участие в генерации АФК через реакцию с редуцированным глутатионом. При этом, как сказано ранее, метаболизация Se осуществляется, главным образом, в хлоропластах. Поэтому всем описанным негативным реакциям, в первую очередь, подвергаются данные пластиды (нарушается структура хлоропластной ДНК, белков, мембранных липидов под действием АФК, Se заменяет S в S-содержащих составляющих фотосинтетического аппарата) [7]. По этой причине снижение значений параметров фотосинтетического аппарата, в частности содержания фотосинтетических пигментов, может служить чувствительным индикатором токсического действия Se.
В представленном исследовании токсической для каллусной ткани является концентрация селенита, равная 10-3 М. На это указывает полное ингибирование ростовых процессов культуры, а также изменения, происходящие в содержании и соотношении фотосинтетических пигментов, являющиеся свидетельствами значительного подавления работы фотосинтетического аппарата. Содержание фенольных соединений поддерживается на довольно высоком уровне, хотя и уступает контролю. При этом антирадикальная активность соответствует контрольному показателю, что может свидетельствовать об увеличении в фенольном комплексе структур с повышенной антиоксидантной способностью, либо о вкладе в проявление указанной активности других соединений.
В диапазоне концентраций от 10-8 до 10-5 М селенит натрия не оказывает значительного влияния на рост фотомиксотрофного каллуса T. foenum-graecum и содержание в нем фотосинтетических пигментов. Уровень фенольных метаболитов хотя несколько варьирует относительно контрольного значения в присутствии селенита в концентрациях 10-8–10-5 М, тем не менее, это не отражается на антирадикальной активности.
Неоднозначный эффект селенита наблюдается при его концентрации 10-4 М. С одной стороны, происходит существенное торможение роста каллусной ткани, и возрастание содержания фенольных соединений, сопровождающееся сильным подъемом антирадикальной активности (причем последнее зафиксировано только для данной концентрации). С другой стороны, содержание фотосинтетических пигментов, как и их соотношение, мало изменяется относительно контроля, что не позволяет отнести данную концентрацию Se-содержащего вещества к ряду токсических. При этом описанные реакции со стороны ростовых процессов и синтеза фенольных соединений являются типичными для растительных клеток при стрессовом воздействии и направлены на нивелирование вызванных им негативных последствий. И важная роль при этом отводится именно фенольным соединениям, как эффективным антиоксидантам [16]. Побочным же эффектом увеличения содержания фенольных соединений могло стать усиление ингибирования ростовых процессов каллусной культуры. Таким образом, селенит натрия в концентрации 10-4 М запускает стрессовый ответ, однако мобилизация защитных систем клеток, проявляющаяся в частности в повышении накопления фенолов, еще способна блокировать токсическое действие Se.
Необходимо подчеркнуть, что полученные в ходе настоящего исследования данные подтверждают имеющиеся в литературе сведения, согласно которым Se стимулирует работу антиоксидантной системы защиты клеток, тем самым повышая резистентность к действию стрессоров [2]. Так, в некоторых вариантах опыта – при концентрациях селенита натрия 10-8 и 10-6 М – наблюдалось существенное возрастание содержания фенольных соединений в каллусной ткани T. foenum-graecum при сохранении средних значений других определяемых показателей. Также примечательно, что в соответствии с полученными результатами, токсический порог Se для каллусных клеток T. foenum-graecum находится в диапазоне высоких концентраций – >10-4 М и ≤10-3 М. Анализ литературы показал, что для подавляющего большинства клеточных культур токсические для них концентрации Se-содержащих соединений как минимум на порядок ниже по сравнению с фотомиксотрофной каллусной культурой T. foenum-graecum, что указывает на более высокую устойчивость последней по отношению к высоким концентрациям Se.
ЗаключениеТаким образом, установлено, что типичный для растительных объектов двойственный характер воздействия селена, заключающийся в зависимом от дозы проявлении как положительного (как правило, при низких концентрациях), так и отрицательного эффектов (как правило, при высоких концентрациях), для данной каллусной культуры зарегистрирован не был. Фотомиксотрофная каллусная культура T. foenum-graecum проявляет повышенную устойчивость к Se в высоких концентрациях, о чем свидетельствует достаточно высокий токсический порог действия данного элемента, находящийся в ряду концентраций >10-4 М и ≤10-3 М, и отсутствие ингибирования работы антиоксидантной системы клеток даже под влиянием 10-3 М селенита натрия.
Выраженного стимулирующего эффекта селенита натрия в низких концентрациях на рост и/или уровень накопления фенольных соединений, как практически важных вторичных метаболитов, выявлено не было, что делает нецелесообразным регулярное внесение данного элемента в состав питательной среды для культивирования фотомиксотрофной каллусной культуры пажитника греческого.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Носов А. М. Регуляция синтеза вторичных соединений в культуре клеток растений / А. М. Носов // Биология культивируемых клеток и биотехнология растений. Под ред. Бутенко Р. Г.– М: Наука, 1991. – С. 5–20.
- Feng R. The roles of selenium in protecting plants against abiotic stresses / R. Feng, C. Wei, S. Tu // Environ. Exp. Bot. – 2013. – Vol. 87. – P. 58–68. DOI: 10.1016/j.envexpbot.2012.09.002
- Sieprawska A. Involvement of selenium in protective mechanisms of plants under environmental stress conditions – Review / A. Sieprawska, A. Kornaś, M. Filek // Acta Biologica Cracoviensia s. Botanica. – 2015. Vol. 57 (1). – P. 9–20. DOI: 10.1515/abcsb-2015-0014
- Turakainen M. Effects of selenium treatments on potato (Solanum tuberosum L.) growth and concentrations of soluble sugars and starch / M. Turakainen, H. Hartikainen, M. M. Seppanen // J. Agric. Food Chem. – 2004. – Vol. 52 (17). – 5378–5382.
- Ramakrishna A. Influence of abiotic stress signals on secondary metabolites / A. Ramakrishna, G. A. Ravishankar // Plant Signal Behav. – 2011. – Vol. 6 (11). – P. 1720–1731.
- Сиянова Н. С. Оптимизация условий выращивания культуры ткани раувольфии змеиной / Н. С. Сиянова, С. Н. Неуструева // Ученые записки Казанского государственного университета. – 2008. – Т. 150 (2). – С. 201–224.
- Freeman J. L. Molecular mechanisms of selenium tolerance and hyperaccumulation in Stanleya pinnata / J. L. Freeman, M. Tamaoki, C. Stushnoff et al. // Plant Physiology. – 2010. – Vol. 153 (4). – P. 1630–1652. DOI: 10.1104/pp.110.156570
- Mehrafarin A. A review on biology, cultivation and biotechnology of fenugreek (Trigonella foenum-graecum L.) as a valuable medicinal plant and multipurpose / A. Mehrafarin, S. Rezazadeh, H. Naghdi Badi et al. // Journal of Medicinal Plants. –2011. – Vol. 10 (37). – P. 6–24.
- Логвина А. О. Физиолого-биохимические характеристики клеточных культур Trigonella foenum-graecum: дисc. … канд. биол. наук: 03.01.05: защищена 16.06.15: утв. 20.11.2015 / Логвина Анна Олеговна. – Мн., 2015. – 239 с.
- Lohvina H. Fenugreek cell culture in vitro as a potential source of phenolic antioxidants / H. Lohvina, V. Yurin // Scientific enquire in the contemporary world: theoretical basics and innovative approach. Natural sciences. 3rd edition. – San Francisco, 2014. – P. 8–12.
- Terry N. Selenium in higher plants / N. Terry, A. M. Zayed, M. P. De Souza // Annu. Rev. Plant Biol. – 2000. – Vol. 51. – P. 401–432.
- Носов А. М. Методы оценки и характеристики роста культур клеток высших растений / А. М. Носов // Молекулярно-генетические и биохимические методы в современной биологии растений. – М.: Бином. Лаборатория знаний, 2011. – С. 386–403.
- Мокроносов А. Т. Малый практикум по физиологии растений / А. Т. Мокроносов. – М.: Издательство Московского университета, 1994. – 183 с.
- Slinkard K. Total phenol analysis: automation and comparison with manuel methods / K. Slinkard, V. L. Singleton // American journal of enology and viticulture. – 1977. – Vol. 28. – P. 49–55.
- Marxen K. Determination of DPPH radical oxidation caused by methanolic extracts of some microalgal species by linear regression analysis of spectrophotometric measurements / K. Marxen, K. H. Vanselow, S. Lippemeier et al. // Sensors. – 2007. – Vol. 7. – P. 2080–2095.
- Achnine L. Colocalization of L-phenylalanine ammonia-lyase and cinnamate 4-hydroxylase for metabolic channeling in phenylpropanoid biosynthesis / L. Achnine, E. B. Blancaflor, S. Rasmussen // The Plant Cell. – 2004. – Vol. 16. – P. 3098–3109. DOI: 10.1105/tpc.104.024406
Список литературы на английском языке / References in English
- Nosov A. M. Reguljacija sinteza vtorichnyh soedinenij v kul'ture kletok rastenij [Regulation of the synthesis of secondary compounds in a plant cell culture] / A. M. Nosov // Biologija kul'tiviruemyh kletok i biotehnologija rastenij [Biology of cultured cells and plant biotechnology]. / edited by Butenko R. G. – M: Nauka, 1991. – P. 5–20. [in Russian]
- Feng R. The roles of selenium in protecting plants against abiotic stresses / R. Feng, C. Wei, S. Tu // Environ. Exp. Bot. – 2013. – Vol. 87. – P. 58–68. DOI: 10.1016/j.envexpbot.2012.09.002
- Sieprawska A. Involvement of selenium in protective mechanisms of plants under environmental stress conditions – Review / A. Sieprawska, A. Kornaś, M. Filek // Acta Biologica Cracoviensia s. Botanica. – 2015. Vol. 57 (1). – P. 9–20. DOI: 10.1515/abcsb-2015-0014
- Turakainen M. Effects of selenium treatments on potato (Solanum tuberosum L.) growth and concentrations of soluble sugars and starch / M. Turakainen, H. Hartikainen, M. M. Seppanen // J. Agric. Food Chem. – 2004. – Vol. 52 (17). – 5378–5382.
- Ramakrishna A. Influence of abiotic stress signals on secondary metabolites / A. Ramakrishna, G. A. Ravishankar // Plant Signal Behav. – 2011. – Vol. 6 (11). – P. 1720–1731.
- Sijanova N. S., Neustrueva S. N. Optimizacija uslovij vyrashhivanija kul'tury tkani rauvol'fii zmeinoj [Optimization of conditions for growing rauvolfia zmeina tissue culture] / N. S. Sijanova, S. N. Neustrueva // Uchenye zapiski Kazanskogo gosudarstvennogo universiteta [Scientific Notes of the Kazan State University]. – 2008. – №150 (2). – P. 201–224. [in Russian]
- Freeman J. L. Molecular mechanisms of selenium tolerance and hyperaccumulation in Stanleya pinnata / J. L. Freeman, M. Tamaoki, C. Stushnoff et al. // Plant Physiology. – 2010. – Vol. 153 (4). – P. 1630–1652. DOI: 10.1104/pp.110.156570
- Mehrafarin A. A review on biology, cultivation and biotechnology of fenugreek (Trigonella foenum-graecum L.) as a valuable medicinal plant and multipurpose / A. Mehrafarin, S. Rezazadeh, H. Naghdi Badi et al. // Journal of Medicinal Plants. –2011. – Vol. 10 (37). – P. 6–24.
- Logvina A. O. Fiziologo-biohimicheskie harakteristiki kletochnyh kul'tur Trigonella foenum-graecum [Physiological and biochemical characteristics of Trigonella foenum-graecum cell cultures]: dis. ... of PhD in Biology: 03.01.05: defense of the thesis16.06.15: approved 20.11.2015 / Logvina Anna Olegovna. – Mn., 2015. – 239 p. [in Russian]
- Lohvina H. Fenugreek cell culture in vitro as a potential source of phenolic antioxidants / H. Lohvina, V. Yurin // Scientific enquire in the contemporary world: theoretical basics and innovative approach. Natural sciences. 3rd edition. – San Francisco, 2014. – P. 8–12.
- Terry N. Selenium in higher plants / N. Terry, A. M. Zayed, M. P. De Souza // Annu. Rev. Plant Biol. – 2000. – Vol. 51. – P. 401–432.
- Nosov A. M. Metody ocenki i harakteristiki rosta kul'tur kletok vysshih rastenij [Methods of assessment and characteristics of growth of cell cultures of higher plants] / A. M. Nosov // Molekuljarno-geneticheskie i biohimicheskie metody v sovremennoj biologii rastenij rastenij [Molecular, genetic and biochemical methods in modern plant biology]. – M.: Binom. Laboratorija znanij, 2011. – P. 386–403. [in Russian]
- Mokronosov A. T. Malyj praktikum po fiziologii rastenij [Brief practicum on plant physiology] / A. T. Mokronosov. – M.: Izdatel'stvo Moskovskogo universiteta, 1994. – P.183. [in Russian]
- Slinkard K. Total phenol analysis: automation and comparison with manuel methods / K. Slinkard, V. L. Singleton // American journal of enology and viticulture. – 1977. – Vol. 28. – P. 49–55.
- Marxen K. Determination of DPPH radical oxidation caused by methanolic extracts of some microalgal species by linear regression analysis of spectrophotometric measurements / K. Marxen, K. H. Vanselow, S. Lippemeier et al. // Sensors. – 2007. – Vol. 7. – P. 2080–2095.
- Achnine L. Colocalization of L-phenylalanine ammonia-lyase and cinnamate 4-hydroxylase for metabolic channeling in phenylpropanoid biosynthesis / L. Achnine, E. B. Blancaflor, S. Rasmussen // The Plant Cell. – 2004. – Vol. 16. – P. 3098–3109. DOI: 10.1105/tpc.104.024406