REPRODUCTION AND CLINICAL MANIFESTATIONS OF GIARDIASIS INVASION
Криушинская Г.В.
Соискатель кафедры микробиологии ульяновского государственного педагогического университета им.И.Н.Ульянова, преподаватель кафедры гуманитарных и социально-экономических дисциплин филиала РГГУ в г. Домодедово
ВОСПРОИЗВЕДЕНИЕ И КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ЛЯМБЛИОЗНОЙ ИНВАЗИИ
Аннотация
Заключается в том, что автором разработан и подтвержден опытно- экспериментальным алгоритм исследования сыворотки крови, который позволяет повысить эффективность диагностики и лечения гастроэнтерологических заболеваний. Установлены показатели липидного и белкового обмена при гастроэнтерологических заболеваниях невыясненной этиологии.
Ключевые слова: липидный обмен, белковый обмен, лямблиозная инвазия.
Kriushinsky Galina Vladimirovna
Competitor of the Department of Microbiology, Ulyanovsk State Pedagogical University n. I. N. Ulyanov, Lecturer, Socioeconimic sciences and humanities department, Russian State University for the Humanities
REPRODUCTION AND CLINICAL MANIFESTATIONS OF GIARDIASIS INVASION
Abstract
The authors developed and approved by an experimental algorithm research of blood serum, wich increases the efficiency of diagnosis and treatment of gastrointestinal diseases. Established lipid and protein metadolism in the gastrointestinal diseases of unknown etymology.
Keywords: lipid metabolism, protein metabolism, giardiasis invasion.
ЦЕЛЬ ИССЛЕДОВАНИЯ: изучение особенностей кишечного лямблиоза у экспериментальных крыс на разных этапах развития.
Степень выраженности инвазивных свойств лямблий определяли методом внутрибрюшинного заражение белых крыс (масса 200-250±1,5 г). Экспериментальный лямблиоз воспроизводили по методике К.Т. Moe (1997) на крысах-самцах[2].
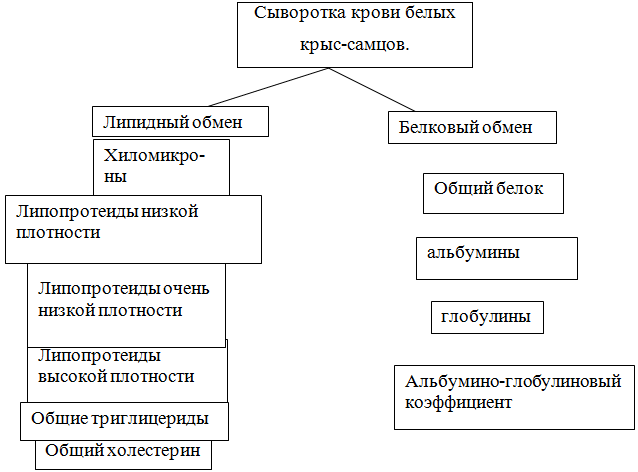
Для изучения липидного и белкового обменов использовали следующие методы исследования. В сыворотке крови определялось изменение липидного обмена (холистерина, триглицерида, липопротеидов высокой плотности, липопротеидов низкой плотности, липопротеидов очень низкой плотности, хиломикрона) и уровень белкового обмена: общего белка, альбуминов, глобулинов, альбумино- глобулинового коэффициента. Показатели сыворотки крови изучали на многоканальном автоматическом биохимическом анализаторе Берингейм Мангейм / Хитачи 911 производства Австрии. Определение альбумина проводили методом с использованием бромкрезолового зелёного. Определение концентрации общего белка выявляли унифицированным методом по биуретовой реакции. Для определения триглицеридов, холистерина использовали ферментативный колориметрический тест.
Результаты исследований и их обсуждение
экспериментальная модель КИШЕЧНОГО ЛЯМБЛИОЗА
Воспроизведение и клинические проявления лямблиозной инвазии
Определив патогенность штаммов L.intestinalis методом внутрибрюшинного заражения лабораторных животных, далее в работе мы использовали модель кишечного лямблиоза K.T. Moe (1997) в модификации Потатуркиной - Нестеровой Н.И. Всех животных (200 крыс) разделили на 4 группы по 50 в каждой. Животных 1-й группы заражали авирулентными лямблиями, 2-й группы – лямблиями со слабой выраженностью данного признака (LD50/lg 2,74±0,12), 3-й группы – лямблиями умеренной патогенности LD50/lg 4,3±0,15 и 4-й группы - с наиболее выраженными свойствами (LD50/lg 5,38±0,14). В результате через 12 часов после заражения per os у 29 крыс 4-й группы отмечались проявления заболевания (табл. 2). Через 24 часа после заражения признаки лямблиоза наблюдались у всех 50 животных 4-й группы и 13 крыс 3-й группы. внутрибрюшинного заражения лабораторных животных, далее в работе мы использовали модель кишечного лямблиоза в модификации Н.И. Потатуркиной - Нестеровой[1] по шаблону K.T. Moе (1997)[2].Другие методы заражения лямблиями экспериментальных животных, такие как внутримышечный и интрацекальный, по нашему мнению, не позволяют воспроизвести данное заболевание адекватно его естественным условиям возникновения и развития, когда простейшие попадают в организм фекально-оральным путем и основной патологический процесс развивается в кишечнике, который и является основным органом-мишенью при данном заболевании.
Организация исследований
Объект исследования
гастроэнтерологические больные n=350
группа сравнения n=110
Методы исследования
Лабораторные
- Биологические.
- Биохимические.
- Статистические.
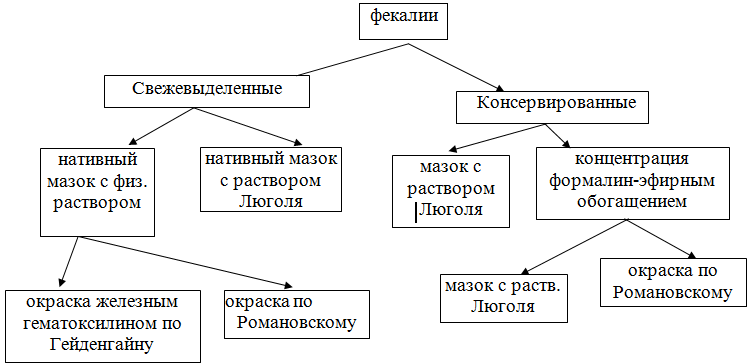
Рис. 1 - Схема проведения исследования
Материалы исследований: эксперименты проводили на нелинейных крысах массой 200-250±1,5 г, которых содержали в условиях постоянного температурного режима (20-25 о С) и стабильной освещённости. Животные получали полноценное питание. Клинические изоляты Lamblia intestinalis выделяли из фекалий детей в возрасте от 3 до 7 лет и взрослых в возрасте от 30 до 45 лет, находящихся на стационарном лечении с диагнозами: язвенная болезнь, хронический гастрит, хронический холецистит, хронический гепатит, неспецифический язвенный колит, цирроз печени, желчно-каменная болезнь, синдром оперированного желудка и синдром раздраженной кишки.Для получения культур Lamblia intestinalis использовали среду Suresh. Изучение паразитоценоза проводили в соответствии с методическим указанием МУК 4.2.735-99 «Паразитологические методы лабораторной диагностики гельминтозов и протозоозов», утвержденным главным государственным санитарным врачом РФ 25.02.1999 г. Степень выраженности инвазивных свойств лямблий определяли методом внутрибрюшинного заражение белых крыс (масса 200-250±1,5 г). Экспериментальный лямблиоз воспроизводили по методике К.Т. Moe (1997) на крысах-самцах. Для изучения липидного и белкового обменов использовали следующие методы исследования. В сыворотке крови определялось изменение липидного обмена (холестерина, триглицерида, липопротеидов высокой плотности, липопротеидов низкой плотности, липопротеидов очень низкой плотности, хиломикрона) и уровень белкового обмена: общего белка, альбуминов, глобулинов, альбумино - глобулинового коэффициента. Показатели сыворотки крови изучали на многоканальном автоматическом биохимическом анализаторе «Берингейм Мангейм/Хитачи 911» производства Австрии. Определение альбумина проводили методом с использованием бромкрезолового зелёного. Определение концентрации общего белка выявляли унифицированным методом по биуретовой реакции. Для определения триглицеридов, холестерина использовали ферментативный колориметрический тест.
Рис. 2 - Регламент лабораторной диагностики сыворотки крови белых крыс
Для получения клинических изолятов лямблий фекалии собирали в чисто вымытые флаконы, не содержащие следов химических реактивов, дезинфицирующих веществ и антибиотиков. При доступе свободного кислорода лямблии гибнут в течение нескольких часов, поэтому материал для посева использовали сразу после получения. Пробы фекалий заливали равным объемом (1:1) физиологического раствора, суспендировали и фильтровали через один слой марли. Фильтрат в объеме 0,5-1,0 мл вносили в пробирку с питательной средой, засевали одновременно 5-6 пробирок и культивирование проводили при температуре 37о С. Для получения культур Lamblia intestinalis использовали среды Павловой, Zierdt, Джонсона и Suresh. Среда Павловой содержит лошадиную сыворотку, однозамещенный фосфорнокислый калий и двузамещенный фосфорнокислый натрий. Перед посевом в каждую пробирку добавляют 1-2 петли мелкого стерильного рисового крахмала. В двухфазной яичной среде Циерта в качестве твердой фазы использовали коагулированное в скошенном положении содержимое куриного яйца. Жидкая фаза представляла собой раствор Хенкса или Среду 199 с добавлением сыворотки крови кур, крупного рогатого скота, лошади. Анаэробные условия достигались путем наслаивания на среду 1-2 мл стерильного масла, рН среды 7,0-7,2.
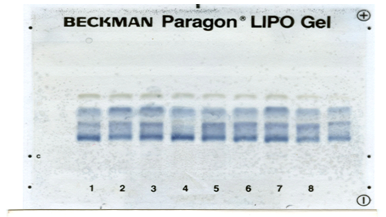
Рис. 3 - Результаты электрофоретического разделения липопротеидов сыворотки крови крыс, заражённых лямблиями на 12-е сутки эксперимента.
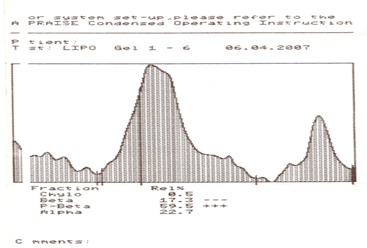
Рис. 4 - Результаты изучения уровней хиломикронов, ЛПНП, ЛПОНП, ЛПВП-α у интактных животных на 12-е сутки эксперимента.
К 24-м суткам у экспериментальных животных 3-й и 4-й групп сохранялось повышенное содержание большинства фракций липидов. У крыс 1-й и 2-й групп количественное содержание липидных фракций статистически не отличался от таковых контрольной группы
У заболевших животных отмечались вялость, потеря аппетита, температура, изменение характера шерсти, диарея с примесью крови и слизи, ахолия фекалий. Через 48 часов признаки кишечного лямблиоза наблюдались у всех животных 3-й группы и 13 крыс 2-й группы. На 3 сутки патологический процесс развился у остальных животных 2-й группы и у 11 крыс 1-й группы, однако степень выраженности была различна.
После указанных сроков развития заболевания у экспериментальных животных отмечалось улучшение состояния: исчезала вялость, нормализовалась температура, взъерошенность шерсти, вновь появлялся аппетит, фекалии приобретали нормальную консистенцию и цвет.
Таким образом, проведенные исследования показали, что введение peros вегетативных форм лямблий приводило к развитию патологического процесса, тогда как исследования K. Suresh свидетельствуют о том, что экспериментальный лямблиоз развивается у животных при заражении их только цистами данных простейших[3].
Данные исследования демонстрируют возможность развития лямблиозной инвазии при введении в макроорганизм не только цист, но и вегетативных форм возбудителя. Основными проявлениями данного протозооза у экспериментальных животных являлись вялость, потеря аппетита, жажда, изменение состояния шерсти, ахолия фекалий, развитие диареи с примесью крови и слизи. Длительность и тяжесть течения инфекционного процесса находились в прямой зависимости от вирулентности инокулированных лямблий.
Литература
- Потатуркина-Нестерова Н.И., Арбузова Ю.Ю., Чебан Н.М., Ильина Н.А., Богомолова Л.К. Изучение этиопатогенетической роли Blastocystis hominis в патологии желудочно-кишечного тракта // Санкт - Петербург Гастро-2000: Материалы 2 Объединенной Всеармейской научной конференции, 20-22 сентября 2000. - Санкт-Петербург, 2000. -№ 1-2.-С.294.
- МоеT., Singh M., Howe J., Ho L.C., Tan S.W., Chen X.Q., Hg G.C., Yap E.H. Experimental Blastocystis hominis infection in laboratory mice // Parasitol. Res. 1998. - V.83. - P.319-325.
- Suresh K., Chong S.I., Howe J. Tubulovesicular elements in B. hominis from the caecum of experimentally infected rats // Int. J. Parasitol. 1995. - V.25, № 1.-P. 123-126.
References
- Potaturkina-Nesterova N.I., Arbuzova Ju.Ju., Cheban N.M., Il'ina N.A., Bogomolova L.K. Izuchenie jetiopatogeneticheskoj roli Blastocystis hominis v patologii zheludochno-kishechnogo trakta // Sankt - Peterburg Gastro-2000: Materialy 2 Ob#edinennoj Vsearmejskoj nauchnoj konferencii, 20-22 sentjabrja 2000. - Sankt-Peterburg, 2000. -№ 1-2.-S.294.
- МоеT., Singh M., Howe J., Ho L.C., Tan S.W., Chen X.Q., Hg G.C., Yap E.H. Experimental Blastocystis hominis infection in laboratory mice // Parasitol. Res. 1998. - V.83. - P.319-325.
- Suresh K., Chong S.I., Howe J. Tubulovesicular elements in B. hominis from the caecum of experimentally infected rats // Int. J. Parasitol. 1995. - V.25, № 1.-P. 123-126.