INVESTIGATION OF MECHANISMS OF PROOXIDANT EFFECTS OF NANOPARTICLES TRANSITION METALS IN THE TEST TRITICUM VULGARE
Короткова А.М.1, Лебедев С.В.2, Сизова Е.А.3
1аспирант; 2профессор, доктор биологических наук; 3кандидат биологических наук, доцент, Оренбургский государственный университет, г. Оренбург
Работа выполнена при финансовой поддержке Гранта РНФ соглашение №14-36-00023 от 15.09.2014 г. и Государственного задания №342 от 01.02.2014 г.
ИССЛЕДОВАНИЕ МЕХАНИЗМОВ РАЗВИТИЯ ПРООКСИДАНТНЫХ ЭФФЕКТОВ НАНОЧАСТИЦ МЕТАЛЛОВ ПЕРЕМЕННОЙ ВАЛЕНТНОСТИ В ТЕСТЕ TRITICUM VULGARE
Аннотация
Изучено влияние сферических наночастиц металлов переменной валентности (железа, меди и никеля) в концентрациях 0,1 М на корневую часть 4-х дневных проростков пшеницы Triticum vulgarе. После обработки растений наночастицами регистрировалось увеличение флуоресценции дихлорофлуоресцеина и малонового диальдегида (МДА), причем указанные эффекты имели прямой дозозависимый характер. Флюоресцентная микроскопия и оценка жизнеспособности клеток по количеству мертвых клеток показали увеличение гибели клеток растений после увеличения НЧ в среде.
Ключевые слова: Triticum vulgare – наночастицы металлов переменной валентности – активные формы кислорода –окислительный стресс – жизнеспособность
Korotkova A.M.1, Lebedev S.V.2, Sizova E.A.3
1postgraduate student; 23PhD in biology, professor; 3PhD in biology, assosiate professor, Orenburg State University, Orenburg Sity
INVESTIGATION OF MECHANISMS OF PROOXIDANT EFFECTS OF NANOPARTICLES TRANSITION METALS IN THE TEST TRITICUM VULGARE
Abstract
The effects of spherical nanoparticles of transition metals (iron, copper and nickel) in concentrations of 0,1 M to the root of the 4-days seedlings of Triticum vulgare are studied. After treatment of nanoparticles plants recorded an increase in fluorescence of dihlorofluorescein and malondialdehyde (MDA), and these effects were dose-dependent direct. Fluorescence microscopy assessment of viability and cell count of dead cells showed an increase in cell death after the plants increase in medium NPs.
Key words: Triticum vulgare - nanoparticles of transition metals - reactive oxygen species – oxidative stress - viability
Введение. Решение проблем, связанных с адаптацией живых организмов к окислительному стрессу, является одним из актуальных направлений научных исследований. Под действием неблагоприятных факторов среды происходит повышение концентрации активных форм кислорода (АФК) и запуск окислительных реакций, приводящих к деструкции жизненно важных клеточных компонентов [1]. С этой позиции растения не являются исключением и практически постоянно подвергаются сильному воздействию АФК [2, 3], особенно в присутствии ионов металлов переменной валентности [4, 5]. Наиболее пролонгированные и вредные последствия возникают при прямом и опосредованном воздействии наноформ, или наночастиц (НЧ) указанных металлов [6-8]. Результатом такого воздействия является образование окисленных продуктов ДНК [9, 10], снижение митотического индекса, увеличение количества пикнотических микроядер [11] и другие цитотоксические эффекты [7, 12]. Безусловно, растения используют различные механизмы для адаптации к повышенному содержанию металлов в среде, однако этих механизмов недостаточно для предотвращения ряда цито- и генотоксических эффектов НЧ [13-18]. В этой связи актуальность исследования эффектов НЧ металлов переменной валентности как индукторов окислительного повреждения подтверждает необходимость детального раскрытия механизмов предполагаемых процессов у растений.
Материалы и методы исследования. В исследованиях использовали коммерчески доступные сферические НЧ железа Fe˚, меди Cu˚ и никеля Ni˚, приобретенные в Advanced powder technologies LLC, ООО «Передовые порошковые технологии» (Россия, г. Томск) и полученные методом электрического взрыва проводника в атмосфере аргона. Материаловедческая аттестация препаратов включала: электронную сканирующую, просвечивающую, атомно-силовую микроскопии с использованием LEX T OLS4100, JSM 7401F, JEM-2000FX («JEOL», Япония); размерное распределение частиц исследовалось на анализаторе НЧ Brookhaven 90Plus /BIMAS ZetaPALS и Photocor Compact («Фотокор», Россия) в лиозолях, полученных методом диспергирования на ультразвуковом диспергаторе УЗДН-2Т (Россия), при условиях f-35 кГц, N-300 Вт, А-10 мкА, в течение 30 мин; размер НЧ определяли с использованием электронного микроскопа JSM-740 IF. По итогам аттестации установлено, что НЧ Fe˚ имеют размер –91±0,3 нМ и Z-потенциал – 13±0,5мВ, НЧ Cu˚ – 77±20,3 и 31±0,1 мВ, и НЧ Ni˚ – 70±0,3 нм и 25±0,5 мВ, соответственно.
Методология проведенных исследований заключалась в использовании обработанных НЧ металлов семян Triticum vulgare, которые предварительно дезинфицировали 0,01 % раствором KMnO4 в течение 5 мин и после трехкратного промывания дистиллированной водой помещали по 20 штук на подложку из фильтровальной бумаги в пластиковые чашки Петри и выращивали в климатической камере («Agilent», США) при 12-часовом освещении и температуре 23±1 °С в течение 4 суток. Во избежание высыхания все образцы через день поливали 5 мл дистиллированной воды [17]. Затем каждый анализируемый образец поливали 5 мл растворами 0,1 М НЧ Fe˚, Cu˚ и Ni˚ (концентрация по металлу), приготовленных на бидистиллированной воде и обработанных ультразвуком с частотой 35 кГц в источнике ванного типа Сапфир ТТЦ («Сапфир», Россия) в течение 15 мин. Группу контрольных растений обрабатывали дистиллированной водой. После 4-х часовой инкубации корневую часть растений использовали для анализа [19].
Об уровне перекисного окисления липидов (ПОЛ) судили по степени накопления продукта реакции малонового диальдегида (МДА) с тиобарбитуровой кислотой (ТБК). Для этого 100 мг ткани пшеницы растирали с 200 мкл 20% трихлоруксусной кислотой (ТХУ). Полученный гомогенат центрифугировали в течение 5 мин при 12 000 g. В плотно закрывающиеся пробирки вносили по 100 мкл супернатанта и добавляли в контрольные пробы 100 мкл 20% ТХУ, в опытные – 0,5% раствора ТБК. Пробы инкубировали на кипящей водяной бане (100 °С) в течение 30 мин, после охлаждали при комнатной температуре и измеряли оптическую плотность при длине волны 532 нм, а также при 600 нм для корректировки неспецифического поглощения. Расчет производили по формуле: С = ((D/155)∙Х∙V)/(m∙l) (С – количество МДА, ммоль/г сырого веса; D –оптическая плотность образца при 532 нм; 155 – коэффициент экстинкции МДА при 532 нм, мМ-1см-1; Х – разведение, V – объём вытяжки, мл; m – масса сырой навески, г; l – длина оптического пути, см) [20]. Уровень ПОЛ выражали в процентах, за 100% принимали количество ТБК-прореагировавших продуктов, содержащихся в клетках корней растений, обработанных стандартным окислителем – 10 мМ паракватом (метилвиологеном), PQ («Sigma», США) в течение 1 часа.
Для исследования уровня внутриклеточного содержания АФК и окислительно-восстановительного состояния клетки под воздействием НЧ использовали краситель 2,7-дихлородигидрофлуоресцеин диацетат (DCFН-DA) (Sigma, USA), который попадая в клетку под действием АФК окисляется до флуоресцентного 2,7-дихлорфлюоресцеина (DCF) [21]. Для измерения АФК от проростков пшеницы, после 4-х часового воздействия НЧ, отрезали апикальную часть и инкубировали в 10 мкл 0,25 мкМ DCFН-DA в атмосфере 5% СО2 в течение 40 мин при температуре 37° С [19]. Непосредственно перед микроскопическим анализом клетки отмывали от избытка флюорохромов свежеприготовленным фосфатно-солевым буфером (ФСБ) (из таблеток «Ambresco», США) и сканировали давленный микропрепарат на люминесцентном тринокулярном микроскопе «Микромед-3 ЛЮМ» («Микромед», Россия) с камерой Levenhuk C800WG.
Параллельно проводили измерение флуоресценции DCF в клетках при λех=485 нм, λem=530 нм на многопланшетном ридере «Infinite 200 Pro» («Tecan», Австрия). Для этого предварительно готовили клеточную суспензию: добавляли 40 мг апикальной корневой части растений и растирали тефлоновым пестиком в пробирках типа Эппендорф с 200 мкл охлажденного ФСБ. Далее полученные суспензии центрифугировали при 13000 об/мин в течение 10 мин, осадок охлаждали 10 мин на льду (для осаждения белковых фракций), еще раз центрифугировали и забирали 100 мкл в лунки. Затем в них добавляли 10 мкл раствора красителя и инкубировали при +37ºС. Далее клетки дважды промывали в растворе ФСБ и измеряли интенсивность флюоресценции.
Жизнеспособность суспензионных культур пшеницы определялась по модифицированному методу [22]. Метод основан на cпектрофотометрическом определении жизнеспособности клеточной культуры по степени удержания красителя Эванса синего мёртвыми клетками, который не способен проникать в живые клетки. Для проведения теста анализа приготовленные (как описано выше) клеточные суспензии в количестве 100 мкл смешивали с 10 мкл 0,025 % раствора Эванса синего («Sigma», США) в 96-луночном планшете, и инкубировали в течение 15 мин при комнатной температуре. Затем отмывали образцы от избыточного и несвязанного красителя дистиллированной водой и 1 мл 1% раствора додецилсульфата натрия (ДСН), выдержали на водяной бане при 60 °С в течение 30 мин и центрифугировали 10 мин при 9 000 g. Каждой пробе соответствовал контроль сравнения, т.е. образец, состоящий на 100% из мёртвых клеток. Для получения контроля сравнения суспензию клеток выдерживали в растворе 10 мМ PQ в течение 1 часа. После этого проводили измерение оптической плотности при длине волны 600±10 нм. Количество мертвых клеток (в %) рассчитывали из соотношения оптической плотности опытных проб к значению PQ за вычетом фонового поглощения ДСН. Параллельно проводили подсчет мертвых клеток в зоне растяжения корневой части растений по сравнению с PQ. Лабораторные опыты проводили в 3-х кратной биологической повторности, достоверность данных оценивали с помощью программ «Statistica 10.0».
Результаты и их обсуждение. Некоторые исследователи обнаружили, что в присутствии металлических НЧ происходит разрушение эпидермиса апикальной части корня [23], т.к. именно в этой части наблюдается максимальное образование АФК при окислительном стрессе [3-5]. В подтверждении этому мы проанализировали данные об уровне перекисного окисления липидов и локализации АФК в апикальной части пшеницы после 4-х часовой экспозиции с наночастицами металлов переменной валентности.
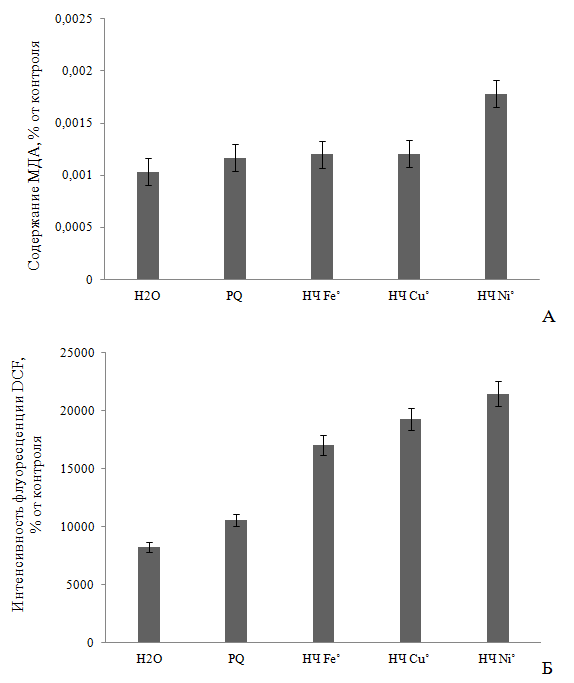
окислительных процессов в растениях под воздействием НЧ может свидетельствовать уровень ПОЛ после воздействия по накоплению МДА, диеновых конъюгатов и других ТБК-активных продуктов. Судя по уровню ПОЛ, при внесении на 4 часа в среду выращивания 0,1 М НЧ Fe˚ и Cu˚ количество МДА увеличивалось всего на 14 и 14,5 % выше относительно отрицательного контроля (H2O) и на 17,8 и 20,1 % – положительного контроля (PQ). При этом, содержание МДА после экспозиции с НЧ Ni˚ составляло уже 0,0017819 ммоль/г сырого веса, что на 36,7 и 42% вышеприведенных контролей, соответственно (Р<0,05) (Рис. 1А). наряду с этим, инкубация с красителем DCFН-DA показала выраженную дозозависимую активность НЧ металлов в виде увеличения выхода дихлорофлуоресцеина DCF. Так, наблюдалось увеличение данного показателя на 51,4 % в случае с НЧ Fe˚, на 57 % Cu˚ и 61,4 % Ni˚ по сравнению с фоновой флуоресценцией красителя, соответственно (Рис. 1Б), что коррелирует с данными по содержанию МДА.
Рис. 1 - Влияние 4-х часовой экспозиции 0,1 М НЧ металлов на содержание малонового диальдегида (А) и интенсивность флуоресценции DCF (Б) в четырехдневных проростках корней пшеницы Triticum vulgare (достоверность Р<0,05).
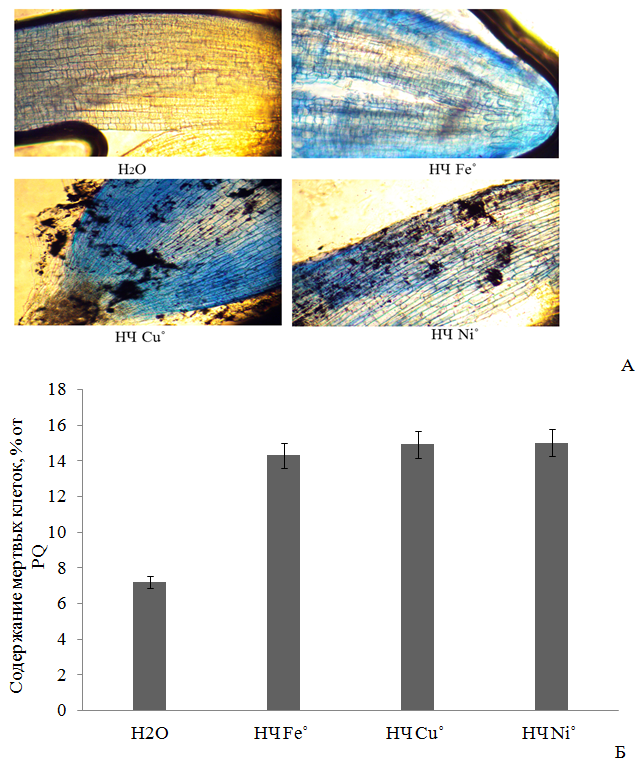
Рис. 2 - Жизнеспособность клеток Triticum vulgare после 4-х часового воздействия 0.1 М НЧ металлов: световая микроскопия зоны растяжения корня, увеличение x100 (А); количество мертвых клеток, % от PQ (Б).
Увеличение концентрации ТБК-активных продуктов и интенсивности флуоресценции DCF при воздействии НЧ исследуемых металлов свидетельствует об избыточной выработке перекиси водорода Н2О2 и др. АФК (за исключением О2∙-) [21], о вероятной индукции активности фермента супероксиддисмутазы [12], переводящей супероксид-анион радикал О2∙- в Н2О2 [16, 24]. Вероятно, исследованные НЧ металлов переменной валентности способствуют также выработке такой АФК [25, 26], как гидроксильный радикал, который приводит к развитию цитогенетических эффектов за счет окисления липидов клеточных мембран и молекул ДНК [25, 27, 28], с последующим некрозом клеток. Подтверждением этого является увеличение количества мертвых клеток в наших экспериментах на 49-52 % выше относительно дистиллированной воды, причем эффект также возрастал в ряду Fe˚<Cu˚<Ni˚, как и по показателям содержания МДА и АФК. Однако указанное действие на растительные клетки проявлялось менее интенсивно, чем в случае с PQ, при внесении которого содержание мертвых клеток составляло 100% (Р≤0,05) (Рис. 2). Различия в биологической активности НЧ металлов можно объяснить различием в способности частиц осаждаться в золе раствора, и тем самым оказывать менее токсичный эффект, либо наоборот, высвобождать ионы из оксидной пленки, и вызывать более сильное повреждение клетки [12, 15].
Таким образом, исследованные НЧ металлов переменной валентности мультиплексно способствуют выработке АФК и развитию цитогенетических повреждений пшеницы за счет окисления липидов клеточных мембран, и вероятном некрозе клеток.
Литература
- Weidinger A., Kozlov A.V. Biological activities of reactive oxygen and nitrogen species: oxidative stress versus signal transduction // 2015. .№5. С. 472-484.
- Креславский В.Д., Лось Д.А., Аллахвердиев С.И., Кузнецов В.В. Сигнальная роль активных форм кислорода при стрессе у растений // Физиология растений. 2012. Т. 59. С. 163-178.
- Nath K, Lu Y. A paradigm of reactive oxygen species and programmed cell death in plants // J. Cell Sci. Ther. Vol. 6. doi: 10.4172/2157-7013.1000202.
- Hernández-Barrera A., Velarde-Buendía A., Zepeda I., Sanchez F. et al. Hyper, a hydrogen peroxide sensor, indicates the sensitivity of the Arabidopsis root elongation zone to aluminum treatment // 2015. № 15. С. 855-867.
- Karkone A., Kuchitsu K. Reactive oxygen species in cell wall metabolism and development in plants // Phytochemistry. 2015. № С. 22-32.
- He D., Jones A.M., Garg S., Pham A.N., Waite T.D. Silver nanoparticle-reactive oxygen species interactions: application of a charging-discharging model // J. Phys. Chem. 2011. № 115. С. 5461-5468.
- Atha D.H., Wang H., Petersen E.J. et al. Copper oxide nanoparticle mediated DNA damage in terrestrial plant models // Environmental Science and Technology. 2012. 46. № 3. С. 1819-1827.
- Donald H., Huanhua W., Elijah J.P., Leveland D., Holbrook R.D., Jaruga P., Dizdaroglu M., Xing B., Nelson B.C. Correction to copper oxide nanoparticle mediated DNA damage in terrestrial plant models // Environ. Sci. Technol. 2014. № 48(20). С. 12473-12473.
- Song M-F., Li Y-S., Kasai H., Kawai Metal nanoparticle-induced micronuclei and oxidative DNA damage in mice // J. Clin. Biochem. Nutr. 2012. № 50(3). С. 211-216.
- Manke , Wang L., Rojanasakul Y., Mechanisms of nanoparticle-induced oxidative stress and toxicity // BioMed Research International. Date Views 10.10.2013 [http://dx.doi.org/10.1155/2013/9429160].
- Rodriguez E., Raquel A., Pedro F., Conceicаo Cr(VI) Induces DNA damage, cell cycle arrest and polyploidization: a flow cytometric and comet assay study in Pisum sativum // Chem. Res. Toxicol. 2011. № 24(7). С. 1040-1047.
- Mirzajani F., Askari H., Hamzelou S., Schober Y., Rоmpp A., Ghassempour A., Spengler B. Proteomics study of silver nanoparticles toxicity on Oryza sativa L. // Ecotoxicology and environmental safety. 2014. № 108. С. 335-339.
- Zhao L., Peng, Hernandez-Viezcas J.A., Rico C., Sun Y., Peralta-Videa J.R. et al. Stress response and tolerance of Zea mays to CeO2 nanoparticles: cross talk among H2O2, heat shock protein, and lipid peroxidation // ACS Nano. 2012. № 6. С. 9615-9622.
- Krishnaraj E.G., Ramachandran R., Abirami S.M., Mohan N., Kalaichelvan P.T. Effect of biologically synthesized silver nanoparticles on Bacopamonnieri (Linn.) // Process Biochem. 2012. № 47(4). С. 651-658.
- Pokhrel L.R. Dubey B. Evaluation of development al responses of two crop plants exposed to silver and zinc oxide nanoparticles // Sci. Tot. Environ. 2013. № 452. С. 321-332.
- Короткова А.М, Лебедев С.В. Эффекты наночастиц меди на изменение антиоксидантного статуса Triticum vulgare Vill. // Микроэлементы в медицине, ветеринарии, питании: перспективы сотрудничества и развития, НПК 24-26 сентября 2014 г. Одесса, 2014, С. 130-136.
- Lebedev S.V., Korotkova A.M., Osipova E.A. Influence of Fe0 nanoparticles, magnetite Fe3O4 nanoparticles, and iron (II) sulfate (FeSO4) solutions on the content of photosynthetic pigments in Triticum vulgare // Russian Journal of Plant Physiology. 2014. № 61(4). С. 564-569.
- Liu Y., Tourbin M., Lachaize S., Guiraud P. Nanoparticles in waste waters: hazards, fate and remediation // Powder Technol. 2014. № 255. С. 149-156.
- Faisal M., Saquibb Q., Alatara A.А., Al-Khedhairyb A.A., Hegazya A.K., Musarratd J. Phytotoxic hazards of NiO-nanoparticles in tomato: a study on mechanism of cell death // Journal of Hazardous Materials. № 3. С. 250-251.
- Сибгатуллина Г.В., Хаертдинова Л.Р., Гумерова Е.А. и др. Методы определения редокс-статуса культивируемых клеток растений. Казанский Федеральный университет, 2011. 61 с.
- Held P. An introduction to reactive oxygen species measurement of ROS in cells // BioTek Instruments. 2015. № 4. С. 1-22.
- Castro-Concha L.A., Escobedo R.M., Miranda-Ham M.L. Measurement of cell viability in in vitro cultures // Methods in molecular biology. Humana Press Inc., 2006. p. 71-76.
- Lin D., Xing B. Root uptake and phytotoxicity of ZnO nanoparticles // Environ. Sci. Technol. 2008. № С. 5580-5585.
- Mohammadi R., Maali-Amiri R., Mantri N.L. Effect of TiO2 nanoparticles on oxidative damage and antioxidant defense systems in chickpea seedlings during cold stress / Russian Journal of Plant Physiology. Vol. 61. № 6. Р. 816-823.
- Wan R., Mo Y., Feng L., Chien S., Tollerud D.J., Zhang Q. DNA damage caused by metal nanoparticles: involvement of oxidative stress and activation of ATM // Chemical Research in Toxicology. № 25. С. 1402-1411.
- Huang Y-W., Wu Ch., Aronstam S. Toxicity of transition metal oxide nanoparticles: recent insights from in vitro studies // Materials. 2010. № 3. Р. 4842-4859.
- Kholmurodov Kh.T., Dushanov E.B., Krasavin H.K., ElHabashy Y.F., Galal A., Sweilam N.H., Yasuoka K. Molecular dynamics simulations of the DNA interaction with metallic nanoparticles and TiO2 Dubna, 2013. рp. 20.
- Ishino K., Kato T., Kato M., Shibata T., Watanabe M., Wakabayashi K., Nakagama H., Totsuka Y. Comprehensive DNA adduct analysis reveals pulmonary inflammatory response contributes to genotoxic action of magnetite nanoparticles // J. Mol. Sci. 2015. № 16. Р. 3474-3492.
References
- Weidinger A., Kozlov A.V. Biological activities of reactive oxygen and nitrogen species: oxidative stress versus signal transduction // 2015. .№5. S. 472-484.
- Kreslavskij V.D., Los' D.A., Allahverdiev S.I., Kuznecov V.V. Signal'naja rol' aktivnyh form kisloroda pri stresse u rastenij // Fiziologija rastenij. 2012. T. 59. S. 163-178.
- Nath K, Lu Y. A paradigm of reactive oxygen species and programmed cell death in plants // J. Cell Sci. Ther. Vol. 6. doi: 10.4172/2157-7013.1000202.
- Hernández-Barrera A., Velarde-Buendía A., Zepeda I., Sanchez F. et al. Hyper, a hydrogen peroxide sensor, indicates the sensitivity of the Arabidopsis root elongation zone to aluminum treatment // 2015. № 15. S. 855-867.
- Karkone A., Kuchitsu K. Reactive oxygen species in cell wall metabolism and development in plants // Phytochemistry. 2015. № S. 22-32.
- He D., Jones A.M., Garg S., Pham A.N., Waite T.D. Silver nanoparticle-reactive oxygen species interactions: application of a charging-discharging model // J. Phys. Chem. 2011. № 115. S. 5461-5468.
- Atha D.H., Wang H., Petersen E.J. et al. Copper oxide nanoparticle mediated DNA damage in terrestrial plant models // Environmental Science and Technology. 2012. 46. № 3. S. 1819-1827.
- Donald H., Huanhua W., Elijah J.P., Leveland D., Holbrook R.D., Jaruga P., Dizdaroglu M., Xing B., Nelson B.C. Correction to copper oxide nanoparticle mediated DNA damage in terrestrial plant models // Environ. Sci. Technol. 2014. № 48(20). S. 12473-12473.
- Song M-F., Li Y-S., Kasai H., Kawai Metal nanoparticle-induced micronuclei and oxidative DNA damage in mice // J. Clin. Biochem. Nutr. 2012. № 50(3). S. 211-216.
- Manke , Wang L., Rojanasakul Y., Mechanisms of nanoparticle-induced oxidative stress and toxicity // BioMed Research International. Date Views 10.10.2013 [http://dx.doi.org/10.1155/2013/9429160].
- Rodriguez E., Raquel A., Pedro F., Conceicao Cr(VI) Induces DNA damage, cell cycle arrest and polyploidization: a flow cytometric and comet assay study in Pisum sativum // Chem. Res. Toxicol. 2011. № 24(7). S. 1040-1047.
- Mirzajani F., Askari H., Hamzelou S., Schober Y., Rompp A., Ghassempour A., Spengler B. Proteomics study of silver nanoparticles toxicity on Oryza sativa L. // Ecotoxicology and environmental safety. 2014. № 108. S. 335-339.
- Zhao L., Peng, Hernandez-Viezcas J.A., Rico C., Sun Y., Peralta-Videa J.R. et al. Stress response and tolerance of Zea mays to CeO2 nanoparticles: cross talk among H2O2, heat shock protein, and lipid peroxidation // ACS Nano. 2012. № 6. S. 9615-9622.
- Krishnaraj E.G., Ramachandran R., Abirami S.M., Mohan N., Kalaichelvan P.T. Effect of biologically synthesized silver nanoparticles on Bacopamonnieri (Linn.) // Process Biochem. 2012. № 47(4). S. 651-658.
- Pokhrel L.R. Dubey B. Evaluation of development al responses of two crop plants exposed to silver and zinc oxide nanoparticles // Sci. Tot. Environ. 2013. № 452. S. 321-332.
- Korotkova A.M, Lebedev S.V. Jeffekty nanochastic medi na izmenenie antioksidantnogo statusa Triticum vulgare Vill. // Mikrojelementy v medicine, veterinarii, pitanii: perspektivy sotrudnichestva i razvitija, NPK 24-26 sentjabrja 2014 g. Odessa, 2014, S. 130-136.
- Lebedev S.V., Korotkova A.M., Osipova E.A. Influence of Fe0 nanoparticles, magnetite Fe3O4 nanoparticles, and iron (II) sulfate (FeSO4) solutions on the content of photosynthetic pigments in Triticum vulgare // Russian Journal of Plant Physiology. 2014. № 61(4). S. 564-569.
- Liu Y., Tourbin M., Lachaize S., Guiraud P. Nanoparticles in waste waters: hazards, fate and remediation // Powder Technol. 2014. № 255. S. 149-156.
- Faisal M., Saquibb Q., Alatara A.A., Al-Khedhairyb A.A., Hegazya A.K., Musarratd J. Phytotoxic hazards of NiO-nanoparticles in tomato: a study on mechanism of cell death // Journal of Hazardous Materials. № 3. S. 250-251.
- Sibgatullina G.V., Haertdinova L.R., Gumerova E.A. i dr. Metody opredelenija redoks-statusa kul'tiviruemyh kletok rastenij. Kazanskij Federal'nyj universitet, 2011. 61 s.
- Held P. An introduction to reactive oxygen species measurement of ROS in cells // BioTek Instruments. 2015. № 4. S. 1-22.
- Castro-Concha L.A., Escobedo R.M., Miranda-Ham M.L. Measurement of cell viability in in vitro cultures // Methods in molecular biology. Humana Press Inc., 2006. p. 71-76.
- Lin D., Xing B. Root uptake and phytotoxicity of ZnO nanoparticles // Environ. Sci. Technol. 2008. № S. 5580-5585.
- Mohammadi R., Maali-Amiri R., Mantri N.L. Effect of TiO2 nanoparticles on oxidative damage and antioxidant defense systems in chickpea seedlings during cold stress / Russian Journal of Plant Physiology. Vol. 61. № 6. R. 816-823.
- Wan R., Mo Y., Feng L., Chien S., Tollerud D.J., Zhang Q. DNA damage caused by metal nanoparticles: involvement of oxidative stress and activation of ATM // Chemical Research in Toxicology. № 25. S. 1402-1411.
- Huang Y-W., Wu Ch., Aronstam S. Toxicity of transition metal oxide nanoparticles: recent insights from in vitro studies // Materials. 2010. № 3. R. 4842-4859.
- Kholmurodov Kh.T., Dushanov E.B., Krasavin H.K., ElHabashy Y.F., Galal A., Sweilam N.H., Yasuoka K. Molecular dynamics simulations of the DNA interaction with metallic nanoparticles and TiO2 Dubna, 2013. rp. 20.
- Ishino K., Kato T., Kato M., Shibata T., Watanabe M., Wakabayashi K., Nakagama H., Totsuka Y. Comprehensive DNA adduct analysis reveals pulmonary inflammatory response contributes to genotoxic action of magnetite nanoparticles // J. Mol. Sci. 2015. № 16. R. 3474-3492.