PATTERNS OF METASTATIC DISEASE AND INVASION PATTERNS IN BREAST CANCER
ПАТТЕРНЫ МЕТАСТАТИЧЕСКОЙ БОЛЕЗНИ И ПАТТЕРНЫ ИНВАЗИИ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Обзорная статья
ORCID: 0000-0001-5625-6919,
Пензенский государственный университет, Пенза, Россия
* Корреспондирующий автор (vbrosalov[at]mail.ru)
АннотацияРак молочной железы остается одной из самых часто диагностируемых опухолей, по-прежнему вносящих значительный вклад в смертность от онкологических заболеваний. Несмотря на значительные успехи лечения рака молочной железы большая часть неблагоприятных прогнозов связана с развитием метастатической болезни. Метастатическая болезнь при раке молочной железы представляет собой группу форм опухолевого поражения различных органов-мишеней, которая в связи с массивным объемом опухолевой ткани и глубиной функциональных изменений может рассматриваться как системное заболевание. Однако все формы метастатической болезни стартуют с инвазии первичной опухоли, которая может развиваться по пути нескольких типовых паттернов. В свою очередь паттерны инвазии определяются характеристиками опухоли, в первую очередь наличием способных к инвазии фенотипов, и характеристиками ткани. Связь паттернов инвазии с клиническими вариантами метастатической болезни еще не анализировались в научной периодике. В работе анализируются описанные паттерны инвазии опухоли и их потенциальная связь с развитием тех или иных форм метастатической болезни.
Ключевые слова: опухолевая инвазия, внутриопухолевая гетерогенность, рак молочной железы.
PATTERNS OF METASTATIC DISEASE AND INVASION PATTERNS IN BREAST CANCER
Review article
Brosalov V.M.*
ORCID: 0000-0001-5625-6919,
Penza State University, Penza, Russia
* Corresponding author (vbrosalov[at]mail.ru)
AbstractBreast cancer remains one of the most frequently diagnosed tumors that still impact cancer mortality to a significant degree. Despite significant success in the treatment of breast cancer, most of the unfavorable prognoses are associated with the development of metastatic disease. Metastatic disease in breast cancer is a group of forms of tumor damage to various target organs, which, due to the massive volume of tumor tissue and the depth of functional changes, can be considered a systemic disease. However, all forms of metastatic disease start with the invasion of the primary tumor, which can develop in several typical patterns. In turn, the patterns of invasion are determined by the characteristics of the tumor, primarily the presence of invasion-capable phenotypes, and the characteristics of the tissue. The relationship of invasion patterns with clinical variants of metastatic disease has not yet been analyzed in scientific periodicals. The current article analyzes the described patterns of tumor invasion and their potential connection with the development of various forms of metastatic disease.
Keywords: tumor invasion, intra-tumor heterogeneity, breast cancer.
Введение
Несмотря на то, что в структуре смертности пациентов с раком молочной железы (РМЖ) на первое место выходят причины, не связанные с непосредственной прогрессией опухоли, прогрессия опухоли все еще остается распространенной причиной смерти среди онкологических больных [1], [2]. Прогрессия опухоли может развиваться по типу местного рецидива или формирования отдаленных метастазов, однако в итоге приводит к развитию метастатической болезни, которая заключается не только в диссеминации опухоли, но и системном изменении организма (наиболее яркие примеры подобных изменений – кахексия, паранеопластические синдромы) [3]. Локализация, размеры и тип опухолевых поражений при метастатической болезни, вызванной РМЖ, может существенно различаться, что позволяет выделить определенные паттерны метастатической болезни, которые встречаются с различной частотой [4]. При этом наибольшего разнообразия паттернов метастатическая болезнь достигает у более молодых пациентов, что добавляет актуальности проблеме [5].
Основная часть
Паттерны метастатической болезни
Несмотря на потенциальную возможность формирования отдаленных метастазов в самых разных органах и тканях, чаще всего метастатическому поражению при РМЖ подвергаются легкие, костный мозг и печень [4], [5]. Кроме очевидных гемодинамических причин все чаще преимущественное поражение этих органов объясняется их предрасположенностью к формированию метастатических ниш под действием первичной опухоли – микроокружения, благоприятного для выживания опухолевых клеток и формирования полноценного метастаза [6]. При этом поражения одного и того же органа могут существенно различаться по частоте развития, паттерну роста опухоли и прогнозу.
Так, процесс в легких может развиваться в виде узловых метастазов различного размера, очагов отсева на плевре с формированием карциноматоза или распространением опухолевых клеток в пределах лимфатических щелей легочной стромы с развитием лимфогенного карциноматоза [7], [8].
Метастазы в кости могут быть остеолитическими, когда они сопровождаются разрушением костной ткани, остеобластическими, когда происходит уплотнение и разрастание костной ткани вокруг них, а также смешанными, когда одновременно присутствуют оба паттерна [9], [10]. Кроме того, редко встречается замещение костного мозга опухолевой тканью, когда не происходит видимого изменения костной ткани, однако костный мозг какой-либо кости плотно инфильтрируется опухолевыми клетками без развития четко выделяемых очагов [11].
В печени обычно развиваются узловые метастазы, которые могут различаться по взаимоотношениям с окружающей тканью – отграничиваться от нее соединительной тканью при десмопластическом типе, формировать псевдокапсулу из сдавленной и атрофичной печеной ткани при экспансивном типе, а также инфильтрировать паренхиму печени, встраиваясь вместо гепатоцитов при замещающем типе [12].
Эти паттерны могут сочетаться и быть последовательными или альтернативными стадиями развития единого процесса колонизации органа опухолевыми клетками [13]. Кроме того, возможно одновременное распространение метастатического процесса в нескольких органах с разными паттернами в каждом. Соотношение паттернов распространения опухоли в различных органах при множественных поражениях представляет собой отдельную перспективную проблему для изучения.
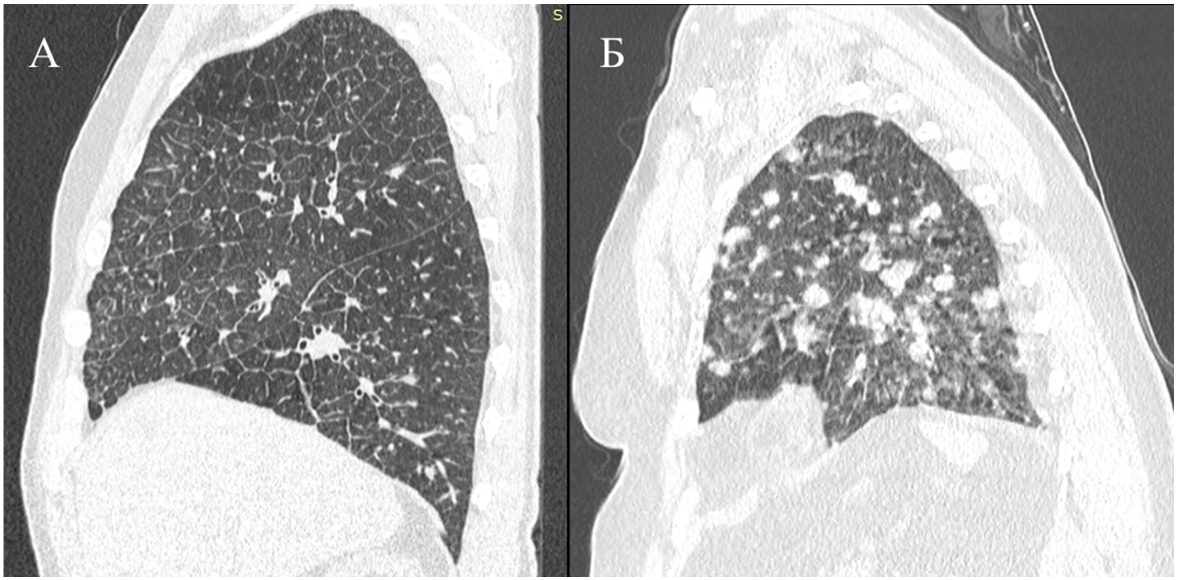
Несмотря на различное по своим характеристикам микроокружение в этих органах, в целом паттерны метастатического поражения сводятся к формированию узловых метастазов, тем или иным образом разрушающих ткань, или инфильтративному процессу, замещающему ткань [13]. Кроме того, даже сходные по стадии и иммуногистохимическим характеристикам опухоли способны распространяться с помощью различных паттернов, как это можно увидеть на рис. 1.
Рис. 1 – Разные паттерны распространения опухолевой ткани в легких в случае опухолей молочной железы, первоначально сходных по своим характеристикам:
А – лимфогенный карциноматоз (Т4N3M0, иммуногистохимические характеристики опухоли ER 8, PgR 3, Her2/neu 1, Ki67 50%); Б – солидные метастазы в легочной паренхиме, карциноматоз плевры (Т4N1M0, иммуногистохимические характеристики опухоли ER 8, PgR 3, Her2/neu 0, Ki67 60%)
Это позволяет предположить, что паттерн метастатической болезни определяется не только определенными характеристиками тканей в органе-реципиенте, но и характером инвазии опухолевых клеток.
Паттерны инвазии
Описаны несколько паттернов инвазии, которые в целом сводятся к инвазии в ткани отдельных опухолевых клеток или их групп. Вероятно, предпочтительный паттерн инвазии зависит от биомеханических и микроанатомических особенностей ткани (в частности развития межклеточного вещества и выраженности в нем интерстициальных пространств). Они могут быть визуализированы с помощью гистологических методов исследования и методов виртуальной гистологии (например, микрокомпьютерная томография) [14], [15].
Инвазия посредством отдельных опухолевых клеток может быть начальным этапом колонизации новой ниши, когда потерявшие связь с опухолью клетки попадают в интерстициальные пространства. При этом предполагается, что подобные клетки могут иметь один из двух возможных фенотипов: амебоидный или мезенхимальный, которые отличаются тропностью к отдельным тканевым структурам, способам передвижения [16]. На этом этапе у клетки может быть два пути развития: 1) адгезия с последующим образованием очага отсева и переходом в диффузную или колониальную форму инвазии; или 2) активное движение по волокнам межклеточного матрикса, поверхности мембран сосудов или движение с током тканевой жидкости в отдаленные районы интерстиция, в полость лимфатических и кровеносных сосудов, где также возможна адгезия и переход к колониальной форме инвазии (вероятно, этот механизм лежит в основе формирования отдаленных метастазов). Интересно отметить, что распространение в пределах клетчаточных пространств может приводить к развитию отдаленных метастазов без вероятного участия инвазии в полость лимфатических и кровеносных сосудов, за счет движения опухолевых клеток в пределах интерстициальных пространств, непрерывно переходящих друг в друга [17], [18].
Когда попавшая в некоторое отдаление от опухолевого узла клетка в интерстиции делится и образует очаг отсева из нескольких плотно связанных клеток (сателлиты), формируется паттерн по типу почкования [13], [19]. Также край опухоли может врастать в интерстициальные пространства похожими на данные сателлиты, но не теряющими связи с опухолью пальцевидными выпячиваниями. При прорастании из интерстиция в лимфатические сосуды вероятно именно эти паттерны создают картину лимфоваскулярной инвазии, по-видимому независимо связанной с неблагоприятным прогнозом [20]. Вероятно, это связано с тем, что группы клеток способны лучше выживать в новых условиях [21], а также непосредственной возможностью транспорта опухолевых клеток из просвета лимфатических сосудов в регионарные лимфатические узлы, а из кровеносных сосудов в микроциркуляторную сеть костного мозга, легких и печени. Таким образом, лимфогенный карциноматоз, карциноматоз плевры и некоторые типы узловых метастазов паренхиматозных органов могут быть клиническим проявлением данных типов инвазии.
Другой тип групповой инвазии запускается в результате формирования тонких тяжей, на верхушке которых располагаются драйверные клетки (обычно отростчатые, неправильной формы – подвергшиеся эпителиально-мезенхимальному переходу клетки опухоли или ассоциированные с опухолью фибробласты), которые по ходу движения, синтеза и разрушения межклеточного матрикса создают каналы, в которых растут адгезированные к ним опухолевые клетки [13], [19]. Также к такому пути инвазии могут перейти предыдущие типы (в первую очередь почкование) в случае появления соответствующих драйверных клеток [22]. Вероятно, подобный паттерн также может развиваться при росте по поверхности, например, после адгезии на поверхности серозных полостей.
В экспериментальных условиях рак молочной железы демонстрирует все основные типы инвазии [23], однако они относительно специфичны для отдельных клеточных линий с эпителиальным или мезенхимальным фенотипом. Это подтверждает связь гетерогенности опухоли с неблагоприятным прогнозом через развитие различных фенотипов, запускающих отдельные паттерны инвазии и в итоге приводящие к развитию форм метастатической болезни [24]. В клинических исследованиях описываются преимущественно групповые паттерны инвазии, такие как почкование [25]. Формы метастатической болезни (такие как узловые метастазы в паренхиматозные органы), которые по происхождению вероятнее всего связаны с этим типом инвазии, также встречаются чаще всего.
Заключение
Метастатическая болезнь представляет собой одну из самых важных клинических проблем, вызванных прогрессией опухоли. Химиотерапевтические методы направлены на предотвращение этого варианта развития событий, однако даже в случае успеха способны увеличить риск смерти от причин, не связанных с прогрессией опухоли, но провоцируемых побочными эффектами терапии (в первую очередь сюда относятся сердечно-сосудистые заболевания) Поэтому для увеличения качества и продолжительности жизни пациентов может быть принципиально важно определение группы высокого риска прогрессии, поскольку это может помочь более целенаправленно и тщательно мониторировать органы-мишени в ходе плановых обследований, а также снизить возможную химиотерапевтическую нагрузку и ее побочные эффекты в группе низкого риска, что может уменьшить частоту неблагоприятных исходов, не связанных с прогрессией опухоли. Одним из возможных перспективных подходов может быть определение паттернов инвазии в первичной опухоли. Будущие исследования, направленные на определение прогностического значения отдельных паттернов, их типичного иммуногистохимического пейзажа, а также определение предшествующих возникновению отдельных типов инвазии особенностей фенотипической гетерогенности опухоли могут стать методом для выделения групп высокого или низкого риска прогрессии.
| Финансирование Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-315-90054. | Funding The reported study was funded by RFBR, project number 19-315-90054. |
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Zaorsky N. G. Causes of death among cancer patients / N. G. Zaorsky, T. M. Churilla, B. L. Egleston, et al. // Annals of oncology. – 2017. – Vol. 28(2). – P. 400–407. DOI: 10.1093/annonc/mdw604
- Derks M. G. M. Impact of age on breast cancer mortality and competing causes of death at 10 years follow-up in the adjuvant TEAM trial / M. G. M. Derks, E. Bastiaannet, W. van de Water, et al. // European Journal of Cancer. – 2018. – Vol. 99. – P. 1–8. DOI: 10.1016/j.ejca.2018.04.009
- Riggio A. I. The lingering mysteries of metastatic recurrence in breast cancer / A. I. Riggio, K. E. Varley, A. L. Welm // British Journal of Cancer. – 2021. – Vol. 124(1). – P. 13–126. DOI: 10.1038/s41416-020-01161-4
- Cummings M. C. Metastatic progression of breast cancer: insights from 50 years of autopsies / M. C. Cummings, P. T. Simpson, L. E. Reid, et al. // The Journal of pathology. – 2014. – Vol. 232(1). – P. 23–31. DOI: 10.1002/path.4288
- Chen M. T. Comparison of patterns and prognosis among distant metastatic breast cancer patients by age groups: a SEER population-based analysis / M. T. Chen, H. F. Sun, Y. Zhao, et al. // Scientific reports. – 2017. – Vol. 7(1). – P. 1 – 8. DOI: 10.1038/s41598-017-10166-8
- Ferguson L. P. The Role of the Microenvironment and Immune System in Regulating Stem Cell Fate in Cancer / L. P. Ferguson, E. Diaz, T. Reya // Trends in Cancer. – 2021. – Vol. 7 (7). – P. 624–634. DOI: 10.1016/j.trecan.2020.12.014
- Pesapane F. Imaging diagnosis of metastatic breast cancer / F. Pesapane, K. Downey, A. Rotili et al. // Insights into imaging. – 2020. – Vol. 11 (1). – P. 1–14. DOI: 10.1186/s13244-020-00885-4
- Giménez A. Intrathoracic manifestations of breast cancer / A. Giménez, T. Franquet, A. Hidalgo // Radiología (English Edition). – 2011. – Vol. 53 (1). – P. 7–17. DOI: 10.1016/S2173-5107(11)70001-5
- Marazzi F. Diagnosis and treatment of bone metastases in breast cancer: radiotherapy, local approach and systemic therapy in a guide for clinicians / F. Marazzi, A. Orlandi, S. Manfrida, et al. // Cancers (Basel). – 2020. – Vol. 12 (9). – P. 1–20. DOI: 10.3390/cancers12092390
- Macedo F. Bone metastases: an overview / F. Macedo, K. Ladeira, F. Pinho, et al. // Oncology reviews. – 2017. – Vol. 11 (1). – P. 43–49. DOI: 10.4081/oncol.2017.321
- Isaac A. State-of-the-art imaging for diagnosis of metastatic bone disease / A. Isaac, D. Dalili, D. Dalili et al. // Der Radiologe. – 2020. – Vol. 60 (Suppl. 1). – P. 1–16. DOI: 10.1007/s00117-020-00666-6
- Van den Eynden G. G. The multifaceted role of the microenvironment in liver metastasis: biology and clinical implications / G. G. Van den Eynden, A. W. Majeed, M. Illemann, et al. // Cancer research. – 2013. – Vol. 73 (7). – P. 2031–2043. DOI: 10.1158/0008-5472.CAN-12-3931
- Blazquez R. The macro-metastasis/organ parenchyma interface (MMPI) – A hitherto unnoticed area / R. Blazquez, D. Sparrer, C. Wendl, et al. // Seminars in cancer biology. – 2020. – Vol. 60. – P. 324–333. DOI: 10.1016/j.semcancer.2019.10.012
- Tang R. Intraoperative micro-computed tomography (micro-CT): a novel method for determination of primary tumour dimensions in breast cancer specimens / R. Tang, M. Saksena, S. B. Coopey, et al. // The British journal of radiology. – 2016. – Vol. 89 (1058). – P. 1–7. DOI: 10.1259/bjr.20150581
- Massimi L. Detection of involved margins in breast specimens with X-ray phase-contrast computed tomography / L. Massimi, T. Suaris, C. K. Hagen, et al. // Scientific reports. – 2021. – Vol. 11. – P. 1–9. DOI: 10.1038/s41598-021-83330-w
- Wu J. Plasticity of cancer cell invasion: Patterns and mechanisms / J. S. Wu, J. Jiang, B. J. Chen et al. // Translational Oncology. – 2021. – Vol. 14 (1). – P. 1–9. DOI: 10.1016/j.tranon.2020.100899
- Benias P. C. Structure and distribution of an unrecognized interstitium in human tissues / P. C. Benias, R. G. Wells, B. Sackey-Aboagye, et al. // Scientific reports. – 2018. – Vol. 8 (1). – P. 1–8. DOI: 10.1038/s41598-018-23062-6
- Cenaj O. Evidence for continuity of interstitial spaces across tissue and organ boundaries in humans / O. Cenaj, D.H.R. Allison, R. Imam, et al. // Communications biology. – 2021. – Vol. 4 (1). – P. 1–9. DOI: 10.1038/s42003-021-01962-0
- Friedl P. Cancer invasion and the microenvironment: plasticity and reciprocity / P. Friedl, S. Alexander // Cell. – 2011. – Vol. 147 (5). – P. 992–1009. DOI: 10.1016/j.cell.2011.11.016
- Ryu Y. J. Lymphovascular invasion can be better than pathologic complete response to predict prognosis in breast cancer treated with neoadjuvant chemotherapy / Y. J. Ryu, S. J. Kang, J. S. Cho et al. // Medicine. (Baltimore) – 2018. – Vol. 97 (30). – P. 1–7. DOI: 10.1097/MD.0000000000011647
- Giuliano M. Perspective on circulating tumor cell clusters: why it takes a village to metastasize / M. Giuliano, A. Shaikh, H. C. Lo, et al. // Cancer research. – 2018. – Vol. 78 (4). – P. 845–852. DOI: 10.1158/0008-5472.CAN-17-2748
- Gerashchenko T. S. Markers of cancer cell invasion: are they good enough? / T. S. Gerashchenko, N. M. Novikov, N. V. Krakhmal, et al. // Journal of clinical medicine. – 2019. – Vol. 8 (8). – P. 1–18. DOI: 10.3390/jcm8081092
- Amirabadi H. E. Characterizing the invasion of different breast cancer cell lines with distinct E-cadherin status in 3D using a microfluidic system / Eslami H. Amirabadi, M. Tuerlings, A. Hollestelle, et al. // Biomedical microdevices. – 2019. – Vol. 21 (4). – P. 1–11. DOI: 10.1007/s10544-019-0450-5
- Liang Y. Metastatic heterogeneity of breast cancer: Molecular mechanism and potential therapeutic targets / Y. Liang, H. Zhang, X. Song et al. // Seminars in cancer biology. – 2020. – Vol. 60. – P. 14–27. DOI: 10.1016/j.semcancer.2019.08.012
- Khalil A. A. Collective invasion in ductal and lobular breast cancer associates with distant metastasis / A. A. Khalil, O. Ilina, P. G. Gritsenko et al. // Clinical & experimental metastasis. – 2017. – Vol. 34 (6-7). – P. 421–429. DOI: 10.1007/s10585-017-9858-6