RESEARCH ON THE IMPLEMENTATION OF THE COMPLEX OF TANNIN AND SODIUM SULFACYL IN THE DEVELOPMENT OF A SEMISOLID DOSAGE FORM
ИССЛЕДОВАНИЯ ПО РЕАЛИЗАЦИИ КОМПЛЕКСА ТАНИНА И СУЛЬФАЦИЛА – НАТРИЯ ПРИ РАЗРАБОТКЕ МЯГКОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ
Научная статья
Лежнева Л.П.1, Поздняков Д.И.2, Темирбулатова А.М.3, Позднякова А.Е.4, *
1, 2, 3, 4, 5 Пятигорский медико-фармацевтический институт - филиал Волгоградского государственного медицинского университета, Пятигорск, Россия
* Корреспондирующий автор (techno.nastya2015[at]yandex.ru)
АннотацияЦель. Разработка мягкой лекарственной формы – мази на основе комплекса танина и сульфацила-натрия для лечения инфицированных ран. Методика. При разработке состава мази использовали метод диффузии в желатиновый гель в опытах «in vitro» и микробиологический метод оценки высвобождения физиологически активных веществ из мазей при прямом их контакте со средой способом «колодца». С целью идентификации танина и сульфацила-натрия применяли метод УФ-спектрофотометрии. Качественное определение танина в мази проводили методом перманганатометрии с индигосульфокислотой, а сульфацила-натрия методом нитритометрии. Результаты. Проведены биофармацевтические исследования и установлена рациональная мазевая основа из 10 г эмульгатора Т-2, 60 г вазелина, 30 г воды, обеспечивающая максимальное высвобождение лекарственных средств. Определены оптимальные терапевтические концентрации танина (3 %) и сульфацила-натрия (10 %) в лекарственной форме. Для идентификации танина и сульфацила-натрия в мази были изучены их УФ - спектры поглощения при совместном присутствии. Танин имеет максимум поглощения при λ = 285 нм, а сульфацил-натрий при λ = 256 нм. Проведено количественное определение танина и сульфацила – натрия в мази. Заключение. Разработанная мазь на основе дубильного вещества танина и сульфаниламидного препарата сульфацила-натрия рекомендуется как эффективное средство для лечения инфицированных ран.
Ключевые слова: дубильные вещества, танин, сульфацил-натрий, мазь, раны.
RESEARCH ON THE IMPLEMENTATION OF THE COMPLEX OF TANNIN AND SODIUM SULFACYL IN THE DEVELOPMENT OF A SEMISOLID DOSAGE FORM
Research article
Lezhneva L.P.1, Pozdnyakov D.I.2, Temirbulatova A.M. 3, Pozdnyakova A.E.4, *
1, 2, 3, 4, 5 Pyatigorsk Medical and Pharmaceutical Institute, branch of the Volgograd State Medical University, Pyatigorsk, Russia
* Corresponding author (techno.nastya2015[at]yandex.ru)
AbstractThe aim of the study is to develop a semisolid dosage form, an ointment based on a complex of tannin and sodium sulfacyl for the treatment of infected wounds. Methodology. When developing the ointment, the authors used a method of diffusion into gelatin gel in "in vitro" experiments and a microbiological method for evaluating the release of physiologically active substances from ointments in direct contact with the medium by the "well" method. UV spectrophotometry was used to identify tannin and sodium sulfacyl. Qualitative determination of tannin in the ointment was carried out by permanganatometry with indigosulfonic acid, and sodium sulfacyl by nitritometry. Results. The article features biopharmaceutical research and an establishment of a rational ointment base from 10 g of T-2 emulsifier, 60 g of vaseline, 30 g of water, providing maximum release of medicine. Also, the study determines the optimal therapeutic concentrations of tannin (3 %) and sodium sulfacyl (10 %) in the dosage form. To identify tannin and sodium sulfacyl in the ointment, their UV absorption spectra were studied in the joint presence. Tannin has a maximum absorption at λ= 285 nm, sodium sulfacyl is observed to have it at λ= 256 nm. The quantitative determination of tannin and sodium sulfacyl in the ointment was also carried out. Conclusion. The developed ointment based on tannin and sulfonamide preparation sodium sulfacyl is recommended as an effective remedy for the treatment of infected wounds.
Keywords: tannins, tannin, sodium sulfacyl, ointment, wounds.
ВведениеПрименение растений с лечебной целью имеет свое начало в глубокой древности. В последние десятилетия, несмотря на большое количество синтетических лекарственных препаратов, растительное сырье остается важнейшей базой для создания эффективных лекарственных средств. Успешное применение препаратов растительного происхождения объясняется их высокой биологической активностью, редкими аллергическими реакциями и воздействием зачастую комплекса веществ, содержащихся в растениях.
Проблема лечения ран остается одной из актуальных в современной практической медицине. Итоги многолетних исследований подтверждают целесообразность применения препаратов из растений. Они ускоряют репаративные процессы в очаге поражения, оказывают антибактериальное действие даже на антибиотикоустойчивые штаммы микроорганизмов, находящихся в ранах [4].
Лечение лекарственными препаратами растительного происхождения нельзя противопоставлять другим средствам, применяемым с лечебной целью. Необходимо разумно и критически рассматривать возможность их сочетания с целью комплексного лечения [1], [5].
Теоретическая и практическая значимость проведенных исследований состоит в изучении возможности реализации комплекса танина и сульфацила-натрия при разработке мази для лечения ран.
Танин относится к гидролизуемым дубильным веществам и по химической структуре является эфиром галловой кислоты. Танин обладает выраженными вяжущими, кровоостанавливающими, репаративными, противовоспалительными и антибактериальными свойствами [10].
Сульфацил-натрий представляет собой сульфаниламидный препарат и находит применение для лечения инфицированных ран благодаря наличию высокой эффективности в отношение чувствительных штаммов. Широкое использование сульфацила-натрия в дерматологической практике связано с повышенной (по сравнению с другими сульфаниламидными препаратами) степенью проникновения в подкожные структуры, что делает возможным терапию хронических глубоко локализованных кожных инфекций. С целью достижения синергетического эффекта и увеличения спектра антибактериального действия сульфацил-натрия используется в комбинациях с противовоспалительными и вяжущими средствами [10].
Материалы и методы исследования
Объектами исследования служили танин и сульфацил-натрий. Композицию лекарственных средств использовали для введения в мягкую лекарственную форму – мазь для лечения инфицированных ран. Установление рациональной мазевой основы проводили методом диффузии в желатиновый гель в опытах «in vitro». Для определения оптимальной концентрации танина и сульфацила-натрия в мази использовали результаты изучения антимикробной активности указанных средств. При постановке эксперимента применяли микробиологический метод оценки высвобождения физиологически активных веществ из лекарственной формы в опытах «in vitro» при прямом контакте мазей со средой методом «колодца». [6].
Идентификацию сульфацила-натрия и танина проводили методом УФ-спектрофотометрии. Для определения исследуемых веществ использовали две основные оптические характеристики: положение максимумов светопоглощения и установление интенсивности в области максимумов поглощения [7].
Количественное определение сульфацила-натрия в мази проводили методом нитритометрии [8].
Методика анализа: 1,0 г мази (точная навеска) растворяли в воде, в колбе вместимостью 100 мл при нагревании на водяной бане до полного растворения основы, прибавляли 1,0 г калия бромида и при постоянном перемешивании титровали 0,1 М раствором нитрита натрия, добавляя его вначале со скоростью 2 мл в минуту, а в конце титрования (за 0,5 мл до эквивалентного количества) по 0,05 мл через минуту. В качестве индикатора использовали смесь тропеолина 00 с метиленовым синим. Титрование проводили при температуре не выше 18-20оС. Параллельно проводили контрольный опыт.
1 мл 0,1 М раствора нитрита натрия соответствует 0,02542 г сульфацила-натрия. Для определения танина в лекарственной форме использовали следующий алгоритм действий: 1,0 г мази (точная навеска) растворяли в воде, в колбе вместимостью 1000 мл при нагревании на водяной бане до полного растворения основы. Охлаждали, добавляли 10 мл индигосульфокислоты и 750 мл воды, перемешивали и титровали 0,1 М раствором перманганата калия до перехода синего цвета раствора в золотисто-желтый. Параллельно проводили контрольный опыт.
1 мл 0,1 М раствора перманганата калия соответствует 0,004157 г дубильных веществ в пересчете на танин.
Статистическую обработку полученных результатов производили с применением пакета статистического анализа StatPlus, 2009 (AnalystSoft, США). Данные выражали в виде M (среднее значение) ± SEM (стандартная ошибка среднего). Нормальность распределения проверяли с применением критерия Колмогорова-Смирнова. В случае подчинения данных закону нормального распределения сравнение групп средних осуществляли критерием Стьюдента, в обратном случае применяли критерий Манна-Уитни. В ходе статистической обработки результатов эксперимента осуществляли парное сравнение при уровне значимости p<0,05.
Результаты исследования и их обсуждениеТерапевтическая ценность мазей во многом зависит от правильного выбора мазевой основы, поскольку именно она оказывает решающее влияние на скорость и полноту высвобождения лекарственных средств из мазей. Нами были проведены исследования по изысканию рациональной мазевой основы, обеспечивающей максимальный лечебный эффект танина и сульфацила-натрия.
В процессе эксперимента были изучены 12 составов мазевых основ (табл. 1). Приготовленные образцы мазей использовали в дальнейшем для проведения биофармацевтических исследований. Лекарственные средства вводили в мазевые основы в модельных концентрациях: танин – 2 %, сульфацил-натрий – 5 %.
Таблица 1 – Составы изученных мазевых основ
| Компоненты мазевой основы | Номер мазевой основы | |||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Эмульгатор Т-2, г. | 10 | |||||||||||
| Вазелин, г. | 60 | 45 | 77 | 5 | 45 | 5 | ||||||
| ПЭО-400, г. | 40 | 55 | ||||||||||
| ПЭО-1500, г. | 50 | |||||||||||
| Моностеарат глицерина, г. | 3 | |||||||||||
| Натрий-КМЦ, г. | 5 | 3 | ||||||||||
| Глицерин, г. | 10 | 10 | ||||||||||
| Пентол, г. | 5 | 15 | ||||||||||
| Парафин, г. | 12 | 6 | 7 | |||||||||
| Эмульгатор № 1, г. | 6 | 15 | ||||||||||
| Бентонит, г. | 30 | |||||||||||
| Компоненты мазевой основы | Номер мазевой основы | |||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Спирты шерстяного воска, г. | 34 | |||||||||||
| Ланолин безводный, г. | 10 | 10 | ||||||||||
| Масло вазелиновое, г. | 30 | 13 | ||||||||||
| Воск, г. | 10 | |||||||||||
| Масло какао, г. | 20 | |||||||||||
| Масло подсолнечное, г. | 70 | |||||||||||
| Вода очищенная, г. | Для каждой композиции – до 100 | |||||||||||
Сравнительную оценку изучаемых основ проводили методом диффузии в желатиновый гель в опытах «in vitro». Готовили 2 % желатиновый гель на стандартном растворе (натрия хлорида 8,9 г; калия хлорида 0,33 г; воды очищенной до 1000 мл) и разливали в чашки Петри по 15-20 мл. Через 24 часа вырезали правильно отверстия диаметром 8 мм и вносили в них навески приготовленных на двенадцати мазевых основах мазей по 1 г. В состав солевого раствора геля вносили предварительно индикатор на дубильные вещества (танин) – железоаммониевые квасцы. С танином квасцы образуют комплекс, окрашенный в черно – синий цвет. Критерием оценки служила степень высвобождения танина из мазей, приготовленных на различных основах, которую определяли по радиусу окрашенных зон [9]. Результаты представлены в табл. 2.
Таблица 2 – Зависимость степени высвобождения танина из мазей от характера мазевой основы
| № основы | Радиус окрашенных зон, мм | ||
| 3 часа | 6 часов | 12 часов | |
| 1 | 6,2 ± 0,3 | 9,5 ± 0,5 | 11,2 ± 0,7 |
| 2 | 5,4 ± 0,2 | 8,3 ± 0,4 | 10,5 ± 0,7 |
| 3 | 6,9 ± 0,3 | 10,1 ± 0,5 | 11,6 ± 0,6 |
| 4 | 8,8 ± 0,4 | 12,8 ± 0,6 | 17,2 ± 0,7 |
| 5 | 4,7 ± 0,3 | 7,4 ± 0,4 | 9,8 ± 0,5 |
| 6 | 5,7 ± 0,2 | 8,4 ± 0,4 | 11,1 ± 0,5 |
| 7 | 4,1 ± 0,3 | 6,9 ± 0,4 | 9,2 ± 0,4 |
| 8 | 4,8 ± 0,3 | 7,2 ± 0,5 | 10,2 ± 0,6 |
| 9 | 6,5 ± 0,3 | 10,2 ± 0,5 | 12,1 ± 0,5 |
| 10 | 3,2 ± 0,2 | 6,7 ± 0,4 | 9,8 ± 0,4 |
| 11 | 7,2 ± 0,3 | 10,1 ± 0,4 | 13,2 ± 0,4 |
| 12 | 4,2 ± 0,1 | 6,8 ± 0,4 | 9,1 ± 0,5 |
Из полученных результатов следует, что максимальное высвобождение танина проявила мазь, приготовленная на эмульсионной основе № 4.
Для определения оптимальных концентраций танина и сульфацила-натрия в мази, обеспечивающих терапевтический эффект, использовали данные литературы и результаты изучения антимикробной активности указанных лекарственных средств. В эксперименте был реализован микробиологический метод оценки высвобождения физиологически активных веществ из мазей. Исследования проводили в опытах «in vitro» при прямом контакте мазей со средой методом «колодца» [2], [3].
40 чашек Петри с питательным агаром засевали стандартной культурой споровой микрофлоры - Bacillus anthracoides. В агаре вырезали отверстия диаметром 5 мм для одинаковых навесок мазей. Чашки Петри разделяли на две части. В первой серии использовали образцы мазей, приготовленных на эмульсионной основе № 4, которые отличались концентрацией танина: 1 %, 2 %, 3 %, 4 %, 5 %.
Во второй серии образцы мазей также были приготовлены на эмульсионной основе № 4, но отличались концентрацией сульфацила-натрия: 1 %, 5 %, 10 %, 15 %, 20 %.Все чашки Петри термостатировали в течение 24 часов при температуре 37оС. Об антимикробной активности судили по размерам зон ингибирования роста споровой микрофлоры (табл. 3 и табл. 4).
Таблица 3 – Влияние концентрации танина на антимикробную активность мазей
| Концентрация танина, % | Диаметр зон ингибирования роста тест-микроба, мм |
| 1 | 18,2 ± 0,7 |
| 2 | 22,4 ± 0,8 |
| 3 | 31,5 ± 0,8*# |
| 4 | 31,3 ± 0,8*# |
| 5 | 31,4 ± 0,8*# |
Примечание: * – статистически значимо относительно концентрации танина 1%; # – статистически значимо относительно концентрации танина 2%
Таблица 4 – Влияние концентрации сульфацила-натрия на антимикробную активность мазей
| Концентрация сульфацила – натрия, % | Диаметр зон ингибирования роста тест-микроба, мм |
| 1 | 41,2 ± 0,7 |
| 5 | 49,4 ± 0,8 |
| 10 | 62,3 ± 0,8*# |
| 15 | 62,4 ± 0,7*# |
| 20 | 62,6 ± 0,8*# |
Примечание: * – статистически значимо относительно концентрации сульфацила-натрия 1%; # – статистически значимо относительно концентрации сульфацила-натрия 2%
Из полученных результатов можно заключить, что максимальный размер зон ингибирования роста споровой микрофлоры соответствовал мазям, содержащим танин в концентрации 3 % и сульфацил-натрия в концентрации 10 %. Увеличение концентраций лекарственных средств в мази нецелесообразно, так как оно незначительно влияло на размер зон ингибирования роста Bacillus anthracoides.
На основании результатов биофармацевтических исследований предложен следующий состав мазевой композиции: танина – 3 г, сульфацила-натрия – 10 г, вазелина – 52,2 г, эмульгатора Т-2 - 8,7 г, воды – 26,1 г (на 100 г лекарственной формы).
Для идентификации сульфацила-натрия и танина в мази навеску лекарственной формы массой 1,0 г смешивали с горячей водой очищенной (5-10 мл), тщательно взбалтывали, фильтровали. После охлаждения полученный фильтрат использовали для проведения исследований.
Предварительно с целью идентификации сульфацила–натрия и танина по УФ - спектрам поглощения нами были изучены спектральные характеристики этих веществ. Для изучения УФ-спектра поглощения сульфацила-натрия в воде его точную навеску (0,100 г) количественно переносили в мерную колбу вместимостью 100 мл, растворяли в 20-25 мл воды очищенной и после растворения доводили объем раствора до метки. 1 мл полученного раствора помещали в мерную колбу вместимостью 100 мл, доводили водой до метки и тщательно перемешивали. В качестве раствора сравнения использовали воду очищенную. Измерение оптической плотности полученного раствора проводили с помощью спектрофотометра марки СФ- 46 в кварцевой кювете с толщиной рабочего слоя 1 см в диапазоне длин волн от 220-300 нм [8].
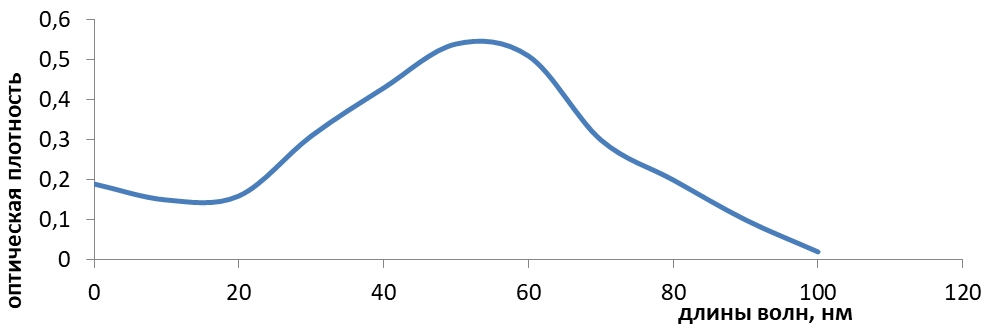
Спектр поглощения сульфацила–натрия в воде очищенной приведен на рис. 1.
Рис. 1 – Спектр поглощения водного раствора сульфацила-натрия
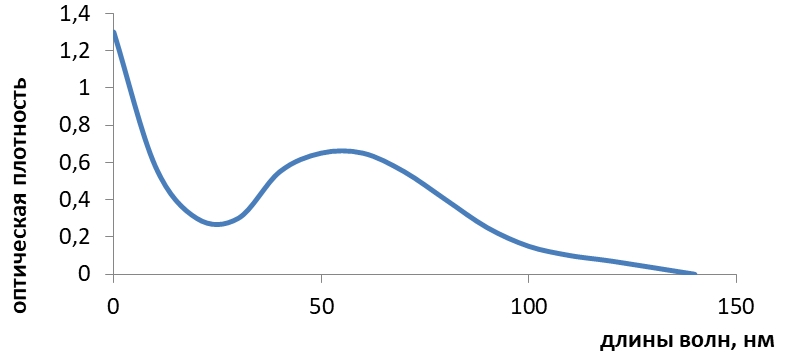
Сульфацил - натрия имеет выраженный спектр поглощения в воде при длине волны, равной 256 нм. Также были изучены спектральные характеристики танина. Для этого точную навеску (0,100 г) танина количественно переносили в мерную колбу вместимостью 100 мл, растворяли в 20-30 мл воды очищенной и после растворения доводили объем до метки тем же растворителем. 1 мл полученного раствора переносили в мерную колбу вместимостью 100 мл и доводили водой до метки. Затем проводили измерение оптической плотности полученного разведения с помощью спектрофотометра марки СФ - 46 в кварцевой кювете с толщиной рабочего слоя 1 см. В качестве раствора сравнения использовали воду очищенную. Спектр поглощения танина в воде представлен на рис. 2.
Рис. 2 – Спектр поглощения водного раствора танина
Танин имеет выраженный максимум поглощения при λ = 285 нм.
Количественное определение сульфацила-натрия в мази проводили методом нитритометрии, а танина методом перманганатометрии с индигосульфокислотой (табл. 5).
Таблица 5 – Количественное содержание сульфацила-натрия и танина в мази
| № образца | Навеска мази, г | Содержание сульфацила– натрия, % | Навеска мази, г | Содержание танина, % |
| 1 | 0,9559 | 10,0642 | 1,0054 | 3,0126 |
| 2 | 1,0014 | 10,4248 | 0,9325 | 3,1205 |
| 3 | 1,0727 | 9,9507 | 0,9905 | 2,8958 |
| 4 | 0,9852 | 9,9851 | 1,0159 | 3,1010 |
| 5 | 0,9901 | 10,1143 | 0,9659 | 3,0689 |
| 6 | 1,0235 | 9,7358 | 0,9833 | 2,9838 |
Разработанная мягкая лекарственная форма – мазь на основе сульфацила-натрия и танина рекомендована после проведения фармакологических исследований как эффективное средство для лечения инфицированных ран.
Заключение
Проведены биофармацевтические исследования по изысканию рациональной мазевой основы, обеспечивающей максимальный лечебный эффект танина и сульфацила-натрия.
Сравнительную оценку изученных 12 основ проводили методом диффузии в желатиновый гель в опытах «in vitro». Максимальное высвобождение танина проявила мазевая основа из 10 г эмульгатора Т-2, 60 г вазелина и 30 г воды. Для определения оптимальных терапевтических концентраций танина и сульфацила-натрия в составе мази был реализован микробиологический метод оценки высвобождения физиологически активных веществ из мазей в опытах «in vitro» при прямом контакте со средой. Концентрация танина составила 3 %, сульфацила – натрия 10 %.
Для идентификации танина и сульфацила-натрия в мази были изучены УФ - спектры поглощения лекарственных средств при совместном присутствии. Установлено, что танин имеет максимум поглощения при λ = 285 нм, а сульфацил - натрий при λ = 256 нм. Количественное определение танина в мази проводили методом перманганатометрии с индигосульфокислотой, а сульфацила - натрия методом нитритометрии.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Веселова Д.В. Технологические исследования по разработке лапчатки прямой экстракта сухого и лекарственной формы на его основе / Д.В. Веселова, Л.П.Лежнева, А.М.Темирбулатова и др. // Вопросы обеспечения качества лекарственных средств. - 2019.- №1.- С. 75-82.
- Камаева С.С. Биофармацевтические свойства основы вагинальной мази сульфацила - натрия / С. С. Камаева, Л. А. Поцелуева, Р. С. Сафиуллин и др. // Фармация. - 2005.- №5.- С. 22-25
- Камаева С.С. Изучение реологических свойств мазей с сульфацилом-натрия на основе натрий-карбоксиметилцеллюлозы / С. С. Камаева, Л. А. Поцелуева, Р. С. Сафиуллин и др. // Фундаментальные исследования.- 2005. -№7. -С.89-92.
- Лавренов В.К. Современная энциклопедия лекарственных растений / В.К.Лавренов, Г.В.Лавренова // М.-2009.-272с.
- Лежнева Л.П. Динамика ранозаживления при лечении мазью с сухим экстрактом лапчатки / Л.П.Лежнева, А.М.Темирбулатова, Э.Ф.Степанова и др. // Кубанский научный медицинский вестник. - 2018.- Т. 25, №6. - С. 105-109.
- Лежнева Л.П. Технологический поиск оптимальной композиции геля на основе фитокомплексов крапивы двудомной / Л.П.Лежнева, З.Д.Хаджиева, А.М. Темирбулатова // Научные ведомости Белгородского гос. университета. Медицина. Фармация. -2017. -№5 (37).- С. 129- 133.
- Орлова А.А. Обзор методов качественного и количественного анализа танинов в растительном сырье / А. А. Орлова, М. Н. Повыдыш // Химия растительного сырья.- 2019. -№4.- С.29-45.
- Тринеева О.В. Разработка методики определения танина и галловой кислоты при совместном присутствии в лекарственном растительном сырье / О.В. Тринеева, А.И. Сливкин // Химико-фармацевтический журнал.- 2019. -Т.53, №4.- С. 58-64.
- Шикова Ю.В. Биофармацевтическое обоснование составов и разработка технологии производства мягких лекарственных форм / Шикова,ЮлияВитальевна // Дисс… докт. фармац. наук. – М., 2005.- 280с.
- Wolf K. The use of sodium sulfacetamide in dermatology / K. Wolf // Silapunt Cutis. 2015.- Vol. 96, №.4. - P. 128-130.
Список литературы на английском языке / References in English
- Veselova D.V. Tehnologicheskie issledovanija po razrabotke lapchatki prjamoj jekstrakta suhogo i lekarstvennoj formy na ego osnove [Technological research on the development of a direct extract of dry and dosage forms of Potentilla on its basis] / D.V. Veselova, L.P. Lezhneva, A.M. Temirbulatova et al. // Voprosy obespecheniya kachestva lekarstvennyh sredstv [Issues of quality assurance of medicines]. - 2019. - № 1. - P. 75-82 [in Russian].
- Kamaeva S.S. Biofarmacevticheskie svojstva osnovy vaginal'noj mazi sul'facila - natriya [Biopharmaceutical properties of the base of the vaginal ointment sulfacil - sodium] / S. S. Kamaeva, L. A. Pocelueva, R. S. Safiullin et al. // Farmaciya [Pharmacy]. - 2005. - №5. - P. 22-25 [in Russian].
- Kamaeva S.S. Izuchenie reologicheskih svojstv mazej s sul'facilom-natriya na osnove natrij-karboksimetilcellyulozy [The study of the rheological properties of ointments with sodium sulfacyl based on sodium carboxymethylcellulose] / S. S. Kamaeva, L. A. Pocelueva, R. S. Safiullin et al. // Fundamental'nye issledovaniya [Fundamental research.]. - 2005. - №7.- P. 89-92 [in Russian].
- Lavrenov V.K. Sovremennaya enciklopediya lekarstvennyh rastenij [Modern encyclopedia of medicinal plants] / K. Lavrenov, G. V. Lavrenova // M.-2009.-272p. Moscow. - 2009.-272 p. [in Russian].]
- Lezhneva L.P. Dinamika ranozazhivleniya pri lechenii maz'yu s suhim ekstraktom lapchatki [Dynamics of wound healing in the treatment of ointment with dry extract of Potentilla] / L.P.Lezhneva, A.M.Temirbulatova, E.F.Stepanova et al. // Kubanskij nauchnyj medicinskij vestnik [Kuban Scientific Medical Bulletin.]. - 2018.- V.25, №6.- P. 105-109 [in Russian]
- Lezhneva L.P. Tekhnologicheskij poisk optimal'noj kompozicii gelya na osnove fitokompleksov krapivy dvudomnoj [Technological search for an optimal gel composition based on phytocomplexes of stinging nettle] / L.P. Lezhneva, D. Hadzhieva, A.M. Temirbulatova // Nauchnye vedomosti Belgorodskogo gos. universiteta. Medicina. Farmaciya [Scientific Bulletin of the Belgorod State. university. Medicine. Pharmacy]. - 2017.- №5(37). -P. 129 – 133 [in Russian].]
- Orlova A.A. Obzor metodov kachestvennogo i kolichestvennogo analiza taninov v rastitel'nom syr'e [Review of methods for the qualitative and quantitative analysis of tannins in vegetable raw materials] / A. A. Orlova, M. N. Povydysh // Himiya rastitel'nogo syr'ya [Chemistry of vegetable raw materials]. - 2019. -№4. - P. 29-45. [in Russian].
- Trineeva O.V. Razrabotka metodiki opredeleniya tanina i gallovoj kisloty pri sovmestnom prisutstvii v lekarstvennom rastitel'nom syr'e [Development of a method for the determination of tannin and gallic acid in the joint presence in medicinal plant raw materials] / O.V.Trineeva, A.I. Slivkin // Himiko-farmacevticheskij zhurnal [Chemical and Pharmaceutical Journal]. - 2019.- V.53, №4. - P. 58-64 [in Russian].]
- Shikova Y. V. Biofarmacevticheskoe obosnovanie sostavov i razrabotka tehnologii proizvodstva mjagkih lekarstvennyh form [Biopharmaceutical substantiation of formulations and development of technology for the production of soft dosage forms] / Y. V. Shikova. Doctoral Thesis. – M., 2005.-280p [in Russian]
- Wolf K. The use of sodium sulfacetamide in dermatology / K. Wolf // Silapunt Cutis. 2015.- Vol. 96, no.4. - P.128-130.