THE SYNERGETIC LAW DAMAGEABILITY OF METALS AND ALLOYS BY HYDROGEN
Шашкова Л.В.
Кандидат технических наук, доцент, Оренбургский государственный университет
СИНЕРГЕТИЧЕСКИЙ ЗАКОН ПОВРЕЖДАЕМОСТИ МЕТАЛЛОВ И СПЛАВОВ ВОДОРОДОМ
Аннотация
Рассмотрен феноменологический синергетический закон водородной повреждаемости и приведено его экспериментальное подтверждение. Закон позволил выяснить смысл критической концентрации водорода и его активности, а также предложить методы их определения. Закон сопоставлен с выводами известных теорий и моделей водородной хрупкости. Обработка литературных данных подтвердила уравнение закона.
Ключевые слова: водородная хрупкость, наводороживание, нестационарная диффузия водорода, параметр водородной повреждаемости.
Shashkova L.V.
PhD in technical sciences, assosiate professor, Orenburg State University
THE SYNERGETIC LAW DAMAGEABILITY OF METALS AND ALLOYS BY HYDROGEN
Abstract
The phenomenological synergetic law of hydrogen damageability is considered and given its experimental confirmation. The law permits explain the meaning of the critical concentration of hydrogen and its activity, as well as propose methods for their determination. The law is associated with the findings of the known theories and models of hydrogen embrittlement. Processing of data in the literature confirmed the equation of the law.
Keywords: hydrogen embrittlement, hydrogen charged, non-stationary diffusion of hydrogen, parameter of hydrogen damageability.
- Введение
Водородная хрупкость (ВХ) стали остается актуальной проблемой, как в научном плане, так и в производственном отношении, несмотря на очевидные достижения и постоянное пристальное внимание исследователей к данной теме. Значительный по объему экспериментальный и теоретический материал по водородной повреждаемости железа и стали позволил провести классификацию видов ВХ, развить модели и теории ВХ, решать практические задачи повышения водородостойкости стали. В то же время остаются нерешенными и актуальными задачи экспериментального изучения кинетики и динамики ВХ в связи с активностью (фугитивностью) водорода. По определению, активность 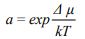 зависит от разности химических потенциалов
зависит от разности химических потенциалов 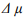 , при наличии которой водород диффузионно подвижен, так что приходится иметь дело с потоками и неоднородностью концентраций водорода. В абсолютном большинстве экспериментов по влиянию водорода на характеристики материалов активность не учитывается, хотя и установлено, что максимальное разрушающее влияние наблюдается, когда водород имеет предельную диффузионную подвижность и активность. Причина видится в том, что в исследованиях ВХ используются электрохимические процессы, при которых легко менять интенсивность наводороживания и наблюдать эффекты влияния водорода на металлы и сплавы. Однако эти процессы неравновесные, распределение водорода в металле неравномерное, и здесь неприменимы стандартные технологии оценки термодинамической активности или фугитивности (летучести) водорода, а, следовательно, и величины критической концентрации водорода.
, при наличии которой водород диффузионно подвижен, так что приходится иметь дело с потоками и неоднородностью концентраций водорода. В абсолютном большинстве экспериментов по влиянию водорода на характеристики материалов активность не учитывается, хотя и установлено, что максимальное разрушающее влияние наблюдается, когда водород имеет предельную диффузионную подвижность и активность. Причина видится в том, что в исследованиях ВХ используются электрохимические процессы, при которых легко менять интенсивность наводороживания и наблюдать эффекты влияния водорода на металлы и сплавы. Однако эти процессы неравновесные, распределение водорода в металле неравномерное, и здесь неприменимы стандартные технологии оценки термодинамической активности или фугитивности (летучести) водорода, а, следовательно, и величины критической концентрации водорода.
В большинстве теорий и моделей ВХ используется величина критической концентрации водорода, однако ни аналитических, ни экспериментальных методов определения этой величины не предложено. По существу критическая концентрация водорода остается гипотетическим или подгоночным параметром. Усилия по изучению ВХ сводятся к эмпирическому постулату: сочетание критических концентраций водорода 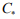 и интенсивности напряжений в устье трещины
и интенсивности напряжений в устье трещины 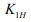 является константой данного материала [1]:
является константой данного материала [1]: 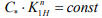 , где n – эмпирическая постоянная. Авторы [2] отмечают, что критическая концентрация
, где n – эмпирическая постоянная. Авторы [2] отмечают, что критическая концентрация 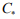 – неявная функция времени, свойств материала, среды, напряженного состояния. Если бы был прямой способ определения
– неявная функция времени, свойств материала, среды, напряженного состояния. Если бы был прямой способ определения 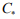 , теория была бы закончена.
, теория была бы закончена.
Имеющееся разнообразие гипотез и моделей ВХ возникло при объяснении результатов конкретных экспериментов и особенностей ВХ пластичных и высокопрочных сталей. Все теории согласуются с опытом при подборе эмпирических коэффициентов. В последние годы предложены различные механизмы действия водорода на структуру и свойства сталей: связная модель диффузии – упругопластичности [3] , механохимическая модель [4], модели для описания кинетики замедленного разрушения высокопрочных сталей в инактивных и водородсодержащих средах [5] и др., например [6-8]. Однако перечисленные модели описывают необратимую ВХ, хотя и отмечается, что разрушение под влиянием диффузионно-подвижного водорода (обратимая ВХ) мало предсказуемо и наиболее опасно.
В последние годы исследователями все больше осознается необходимость учета синергизма систем металл-водород для нового подхода к пониманию и описанию практических всех эффектов и явлений, наблюдаемых в металлах и сплавах при их взаимодействии с водородом. Системы металл-водород являются открытыми, что приводит к диссипации энергии и порождает нелинейное поведение таких систем. Особенно ярко нелинейные синергетические эффекты проявляются на стадии нестационарной диффузии (при нарастании потока) протонного (летучего) водорода при комнатных температурах. Достаточно полный обзор таких кооперативных эффектов металл-водородного взаимодействия приведен в монографии [9].
Представленный в данной обзорной статье экспериментальный и аналитический материал является оригинальным. Впервые гиперподвижность водорода при нестационарной диффузии в металлах и сплавах использована для выявления склонности материала к хрупкому разрушению, что является новым подходом к изучению свойств систем металл-водород, и позволило выяснить физическую природу ВХ стали. Термодинамический анализ неравновесной системы металл-водород позволил сформулировать феноменологический синергетический закон водородной повреждаемости. Получено экспериментальное обоснование синергетического закона и параметра повреждаемости. Впервые использовались методики, позволяющие, независимо от исходной прочности и пластичности материала, определять сопротивление разрыву и сопоставлять его с концентрацией водорода в зоне разрыва; при этом разграничить состояние водорода: летучий (диффузионно-подвижный) или молизованный (связанный). Показано, что снижение сопротивлению отрыву ∆S/S (уровень повреждаемости) стали возрастает пропорционально увеличению концентрации летучего водорода. Это позволило определить ω – параметр водородной повреждаемости, который характеризует склонность стали к ВХ и зависит от свойств материала. Показано, что при ВХ нарушается принцип аддитивности и проявляется синергизм влияния локальных свойств матрицы и фугитивности водорода. Синергетический закон ВХ позволил выяснить смысл критической концентрации водорода и его активности, а также предложить методы их определения. Показано, что критическая концентрация С* и критическая активность а* водорода являются термодинамическим эквивалентом структурного параметра водородостойкости W = ω -1 и могут быть рассчитаны через концентрацию С летучего решеточного, или связанного молекулярного водорода. Закон водородной повреждаемости сопоставлен с выводами известных теорий и моделей ВХ. Обработка литературных данных подтвердила уравнение закона.
2 Феноменологический закон водородной повреждаемости и его экспериментальное обоснование
Поскольку диффузионная подвижность водорода в железе при комнатной температуре на 12-13 порядков выше подвижностей других примесей внедрения, таких как углерод, азот, кислород и др. [10-13], диффузионный водород можно представить как неидеальный решеточный газ. Используя модель решетчатого газа (РГ) [14] и термодинамический подход к системе металл-водород [15] получено уравнение:
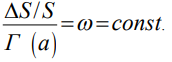 (1),
(1),
которое выражает термодинамический закон ВХ: изменение когезионной прочности (прочности на отрыв) DS/S металла, отнесенное к величине большого потенциала внедренного водорода Г (а), определяет вероятность водородного охрупчивания и является структурным параметром ω металлической системы, отражающим ее повреждаемость водородом.
Поскольку потенциал Г (а) в общем виде представляется степенным рядом активности а водорода (первый член ряда – единица), величина w численно равна изменению когезионной прочности (DS0/S) предельно разбавленного (назовем стандартного) раствора водорода в металле, когда потенциал Г (a) 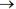 1, т. е. активность а за счет концентрации водорода стремится к нулю [15].
1, т. е. активность а за счет концентрации водорода стремится к нулю [15].
Критериальное уравнение (1) водородостойкости металлов и сплавов получило в дальнейшем экспериментальное подтверждение в работах [16-20] при исследовании кинетики развития повреждаемости стали в процессе наводороживания. Кинетический подход позволил обнаружить при комнатной температуре (25 °С) при различных видах испытаний (от растяжения до сжатия) наводороженных образцов трехстадийное изменение сопротивления отрыву (сдвигу) по схеме (рис. 1): разупрочнение (обратимая потеря прочности в начальный момент) – последующее упрочнение – разупрочнение (необратимое снижение прочности). Три стадии действия водорода на сталь могут свидетельствовать о прохождении водородом трёх состояний в железной матрице по мере её насыщения.
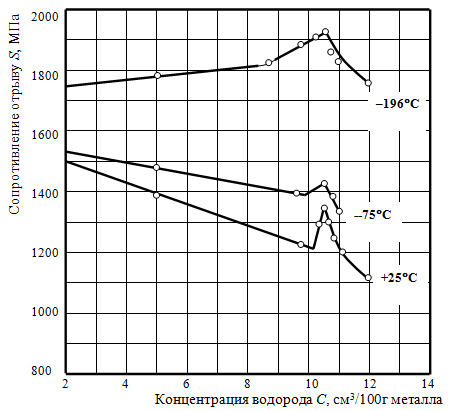
Рис. 1 – Характерная концентрационная зависимость сопротивления хрупкому разрушению наводороженной стали 18Х1Г1МФ при различных температурах испытания [18]
Было сделано предположение, что стадийность кинетики ВХ обусловлена кинетическими превращениями абсорбированного водорода. С целью проверки данного предположения изучали кинетику превращений абсорбированного водорода из состояния диффузионно-подвижного в молизованное в процессе наводороживания. Кинетику развития ВХ сопоставляли с кинетикой наводороживания. При этом впервые были использованы методики [20], позволяющие, независимо от исходной прочности и пластичности материала, определять сопротивление разрыву и сопоставлять его с концентрацией водорода в зоне разрыва; при этом разграничить состояние водорода: диффузионно-подвижный или молизованный. Общую концентрацию абсорбированного и концентрацию связанного ловушками (остаточного после эффузии) водорода в металле определяли методами вакуум-плавления и газовой хроматографии. Концентрацию диффузионно-подвижного (летучего) водорода оценивали как разницу между абсорбированным и связанным водородом и качественно сопоставляли с результатами эвдиометрического анализа. Концентрацию водорода в зоне разрушения оценили благодаря установленному нами ранее размерному эффекту электрохимического проникновения водорода в цилиндрические образцы [21].
В результате проведенных кинетических исследований впервые были получены зависимости сопротивления микросколу от концентрации диффузионно-подвижного и молизованного водорода в зоне микроскола. Зависимости подтвердили, что стадийность кинетики развития повреждаемости металла в процессе наводороживания обусловлена кинетическими превращениями абсорбированного водорода. Стойкость стали против ВХ резко снижается с увеличением концентрации диффузионно-подвижного (протонного) водорода на стадии нестационарной диффузии. Эта стадия является обратимой в том смысле, что выдержка образцов при комнатной температуре приводит к эффузии водорода и восстановлению свойств. На второй стадии прочность заметно восстанавливается, что связано с уменьшением концентрации протонного водорода в связи с переходом его из высокоподвижного в связанное дефектами структуры состояние. Последняя стадия необратима и обусловлена развитием коллекторов молекулярного водорода. По мере увеличения концентрации молизованного водорода происходит снова понижение прочности. Стадийность изменения сопротивления отрыву с учетом состояний водорода подтверждает и объясняет известное разделение ВХ на обратимую и необратимую влиянием диффузионно-подвижного и связанного водорода соответственно.
В дальнейшем в качестве уровня повреждаемости использовали соотношение: 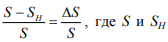 – сопротивление отрыву исходного и наводороженного материала соответственно.
– сопротивление отрыву исходного и наводороженного материала соответственно.
На рис. 2 в качестве примера представлены зависимости уровня повреждаемости ∆S/S стали 18ХГМФ от концентрации всего абсорбированного водорода при различных режимах наводороживания [20]. Видно, что ∆S/S зависит не только от концентрации всего абсорбированного водорода, его состояния в металле, но и от режима наводороживания.
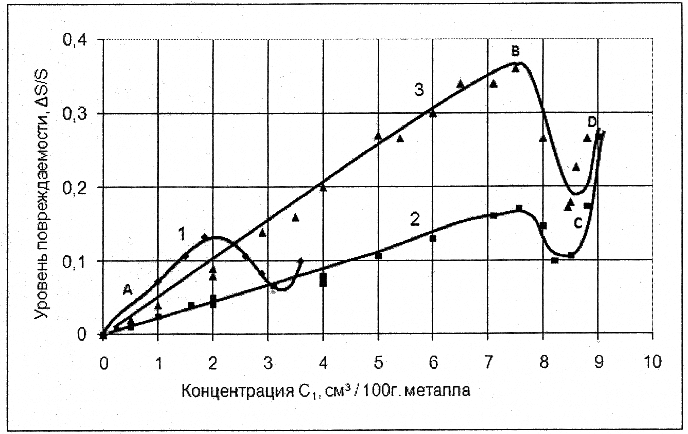
Рис. 2 – Зависимость уровня повреждаемости стали 18ХГМФ от общей концентрации абсорбированного водорода: цифрами 1-3 отмечены режимы наводороживания; АВ – участок обратимой ВХ, СД – участок необратимой ВХ [20]
На рис. 3 представлены результаты влияния на уровень повреждаемости ∆S/S стали концентрации диффузионно-подвижного (летучего) водорода [20]. Результаты оформлены в виде эмпирических линий регрессионных зависимостей. Там же указаны значения коэффициентов корреляции r и дисперсия σ функций ∆S/S вокруг эмпирических линий регрессии.
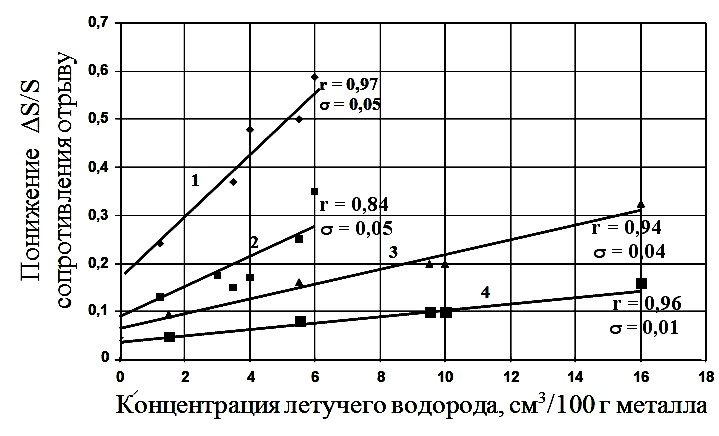
Рис. 3 – Влияние концентрации летучего (диффузионно-подвижного) водорода на понижение ΔS/S сопротивления отрыву: 1,2 – сталь18ХГМФ; 3,4 – сталь 20; 1,3 – испытания в наводороживающей среде; 2,4 – испытания на воздухе [20].
Из рис. 3 видно, что независимо от режима наводороживания снижение сопротивления отрыву стали ∆S/S возрастает пропорционально увеличению концентрации диффузионно- подвижного (летучего) водорода. Величина ω находится экстраполяцией графиков ∆S/S на нулевую концентрацию летучего водорода (рис. 3), названа параметром водородной повреждаемости, и является откликом стали на «посещение» летучего водорода. При сравнении рис. 2 и рис. 3 видно, что концентрация всего абсорбированного водорода на рис. 2 по-разному влияет на повреждаемость ∆S/S стали при обратимой ВХ (участки АВ на графиках 1-3), в то время как зависимость ∆S/S от концентрации летучего водорода на рис. 3 линейна и выражается следующим уравнением повреждаемости:
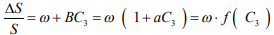 (2)
(2)
Параметр ω в уравнении (2) зависит от свойств материала и условий испытания на отрыв (в электролите или на воздухе) и не зависит от режимов наводороживания. Из выражения (2) следует, что ВХ стали – эффект не аддитивный, а синергетический, зависит от произведения свойств матрицы (параметр ω) и фазы внедрения (функция f (С3)).
Сравнивая феноменологическое уравнение синергетического закона повреждаемости (1) с эмпирическим уравнением (2), видим, что они идентичны. В уравнении (1) величина w численно равна изменению когезионной прочности (DS0/S) предельно разбавленного раствора водорода в металле, когда потенциал Г (a) 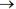 1, т. е. активность а за счет концентрации С водорода стремится к нулю.
1, т. е. активность а за счет концентрации С водорода стремится к нулю.
Таким образом, эмпирические зависимости понижения сопротивления отрыву ∆S/S от концентрации диффузионно-подвижного водорода (рис. 3), которые описываются уравнением (2) являются экспериментальным обоснованием феноменологического синергетического закона повреждаемости (1).
- Определение критической концентрации и активности водорода через параметр водородной повреждаемости
Введенное Трояно понятие о критической концентрации водорода служит основой практически любой современной теории ВХ [22]. Недостатком исследований ВХ является то, что количественно величина критической концентрации 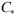 водорода не определена и остается гипотетическим или подгоночным параметром. Предельная концентрация водорода, выше которой в металле возникают трещины, зависит от эффективной летучести (активности или фугитивности) водорода и чистоты железа [23,24]. Известно, что максимально ВХ проявляется при внедрении первых порций активного диффузионно-подвижного водорода [25]. Энергия активации
водорода не определена и остается гипотетическим или подгоночным параметром. Предельная концентрация водорода, выше которой в металле возникают трещины, зависит от эффективной летучести (активности или фугитивности) водорода и чистоты железа [23,24]. Известно, что максимально ВХ проявляется при внедрении первых порций активного диффузионно-подвижного водорода [25]. Энергия активации 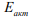 диффузии такого водорода близка к
диффузии такого водорода близка к 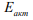 высокотемпературной диффузии и составляет
высокотемпературной диффузии и составляет 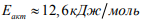 , которая почти в 3 раза ниже энергии активации диффузии водорода, связанного ловушками
, которая почти в 3 раза ниже энергии активации диффузии водорода, связанного ловушками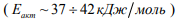 [26,27].
[26,27].
Ниже проанализированы основные результаты, вытекающие из зависимостей хрупкой прочности S стали от концентрации летучего С1 и связанного С2 абсорбированного водорода.
Как уже отмечалось, уравнение (1) определяется прочность наводороженного металла и может быть представлено в виде:
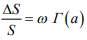 (3)
(3)
Условие предельного равновесия наводороженного металла достигается при 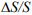
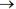 1, что означает разрыв (декогезию) металла водородом. При этом из уравнения (3) следует определение критического потенциала (активности а* или концентрации С*) водорода в металле
1, что означает разрыв (декогезию) металла водородом. При этом из уравнения (3) следует определение критического потенциала (активности а* или концентрации С*) водорода в металле 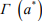 как термодинамического эквивалента структурного параметра водородостойкости W:
как термодинамического эквивалента структурного параметра водородостойкости W:
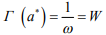 (4)
(4)
Согласно [28], коэффициент водородной декогезии (потери хрупкой прочности) 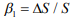 при обратимой ВХ описывается уравнением:
при обратимой ВХ описывается уравнением:
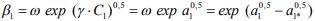 (5)
(5)
В случае необратимой ВХ
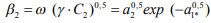 (6)
(6)
где 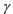 – коэффициент активности летучего водорода в металле;
– коэффициент активности летучего водорода в металле;
а1* и а2* – критическая активность летучего (решеточного) водорода и остаточного (молекулярного) водорода в металле соответственно;
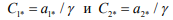 – критическая концентрация летучего и остаточного водорода в металле соответственно.
– критическая концентрация летучего и остаточного водорода в металле соответственно.
Из уравнения (5) при 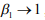 , что означает разрыв поликристалла водородом, следует параметрическое уравнение – условие декогезии наводороженного металла при обратимой ВХ:
, что означает разрыв поликристалла водородом, следует параметрическое уравнение – условие декогезии наводороженного металла при обратимой ВХ:
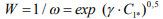 (7)
(7)
По уравнению (7), можно рассчитать критическую концентрацию летучего водорода в данном сплаве. Как видно из уравнений (5) и (6), критическая активность (концентрация) летучего водорода является пределом насыщения стали при обратимой ВХ и определяет интенсивность растрескивания (чувствительность к трещине) при необратимой ВХ. Из выражения (7) следует, что параметр имеет смысл вероятности декогезии стали при ВХ.
Из уравнения (6) при 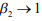 можно получить условие декогезии при необратимой ВХ:
можно получить условие декогезии при необратимой ВХ:
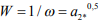 (8)
(8)
где 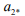 – критическое давление (активность) молекулярного водорода, необходимое для продвижения микротрещины. Из формулы (8) видно, что показатель водородостойкости стали W равен критическому давлению (активности) молекулярного водорода в трещинах.
– критическое давление (активность) молекулярного водорода, необходимое для продвижения микротрещины. Из формулы (8) видно, что показатель водородостойкости стали W равен критическому давлению (активности) молекулярного водорода в трещинах.
Соотношение между критической активностью летучего и молекулярного водорода в металле следует из выражений (7) и (8)
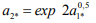 (9)
(9)
Аналитическое выражение потенциала Г (а) известно для идеального решеточного газа (РГ) [14]:
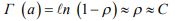
где 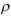 – плотность распределения РГ по узлам решетки (концентрация С).
– плотность распределения РГ по узлам решетки (концентрация С).
Критерий водородочувствительности (1) в модели идеального РГ примет вид:
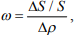
т. е. будет определяться отношением изменения когезионной прочности к соответствующей концентрации водорода.
Модель РГ позволяет оценить коэффициент относительной активности 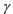 водорода в металле. Для этого нужно сопоставить парциальное давление РH решеточного и континуального PH 2 водорода
водорода в металле. Для этого нужно сопоставить парциальное давление РH решеточного и континуального PH 2 водорода
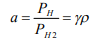 (10)
(10)
Если использовать уравнение Клапейрона-Менделеева для континуального водорода и уравнение состояния идеального РГ [14,29]:
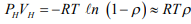
то из выражения (10) получается, что коэффициент относительной активности водорода равен:
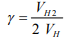 (11)
(11)
Здесь знаменатель увеличен вдвое, чтобы учесть диссоциацию молекулы при переходе водорода из континуального в решеточный газ. При подстановке значений VH2 = 22400 см3/моль и для водорода в железе VH = 2 см3/г-ат [30] в формулу (11) получаем значение коэффициента относительной активности водорода γ = 5600 для системы сталь-водород. Выражение (11) в размерности [см3/100 г] -1 имеет вид:
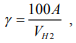
где – А атомный вес металла.
Экспериментальная проверка уравнений (1), (5-6) и (11) выполнялась в работах [31,32]. Величина S (прочность на отрыв) оценивалась по разрывной прочности образцов с надрезом [33]. Изменение 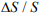 при обратимом и необратимом водородном охрупчивании (ВО) было coпоставлено соответственно с концентрациями летучего С1, и молекулярного С2 водорода. По экспериментальным зависимостям определили значение
при обратимом и необратимом водородном охрупчивании (ВО) было coпоставлено соответственно с концентрациями летучего С1, и молекулярного С2 водорода. По экспериментальным зависимостям определили значение 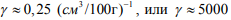 при пересчете на атомную (мольную) концентрацию.
при пересчете на атомную (мольную) концентрацию.
Явный вид термодинамического потенциала подвижного водорода в стали, согласно [32], представляется экспонентой
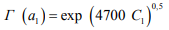 (12)
(12)
где γ1 = 4700 с дисперсией 300.
Потенциал малоподвижного водорода в стали равен
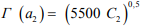 (13)
(13)
где γ 2 = 5500 с дисперсией 800.
Как видно, расчетное значение γ = 5600 по формуле (11) находится в доверительном интервале экспериментально наблюдаемых значений.
Критическая концентрация (активность) водорода в стали может быть рассчитана для подвижного и малоподвижного водорода из уравнений (12), (4) и (13), (4) соответственно.
Для диффузионно-подвижного водорода:
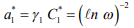 (14)
(14)
Для малоподвижного водорода:
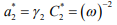 (15)
(15)
Корреляционно-регрессионный анализ экспериментальных результатов подтвердил закон ВО (1) и критерий водородочувствительности w стали. В табл. 1 приведены экспериментальные характеристики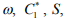 , полученные по методике [31,32] и уравнениям (3), (12-15) для некоторых марок стали. Видно, что значения критической концентрации для диффузионно-подвижного водорода в стали
, полученные по методике [31,32] и уравнениям (3), (12-15) для некоторых марок стали. Видно, что значения критической концентрации для диффузионно-подвижного водорода в стали 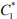 по порядку величины совпадают с известными оценками [27].
по порядку величины совпадают с известными оценками [27].
Таким образом, стойкость стали против обратимой или необратимой ВХ определяется одним структурным параметром – водородостойкостью: W = 1/ω. Критическая концентрация С* и критическая активность а* водорода являются термодинамическим эквивалентом структурного параметра водородостойкости W и могут быть выражены или через концентрацию С летучего решеточного, или связанного молекулярного водорода. Отметим, что водородостойкость W или обратная ей величина – вероятность декогезии , как это следует из уравнений (3) и (5-6), равны отношению "текущих" значений потери хрупкой прочности DS/S и соответствующих активностей а водорода. Эти отношения обладают свойством постоянства для каждой структуры стали, т. е. при оценке стали необходимо сопоставить действие и его результат. Выбор деформационных показателей взамен силовых, видимо, не играет роли. К такому пониманию критерия склонности стали к ВХ близко подошел автор работы [34]. Им предложено критической считать концентрацию водорода, при которой свойства стали становятся квазипостоянными. Все имеющиеся способы оценки стали на склонность к ВХ учитывают или концентрации водорода, или изменения свойств материалов.
Табл. 1 – Режимы термообработки, характеристики прочности, водородоповреждаемости и критической концентрации стали
|
Марка стали, обработка |
σВ, МПа |
σ0,2, МПа |
S, МПа |
w
|
С1*,см3/100г. мет. |
|
Сталь 20, нормализация 910 °С |
430 |
300 |
960 |
0,05 |
36 |
|
Х46, контролируемая прокатка |
540 |
380 |
1150 |
0,028 |
51 |
|
30ХМА, закалка 880 °С, отпуск 580 °С |
800 |
670 |
1630 |
0,026 |
53 |
|
18Х1Г1МФ, нормализация 1040 °С, отпуск 740 °С |
850 |
650 |
1500 |
0,18 |
12 |
|
30ХМА, закалка 880 °С, отпуск 400 °С |
1100 |
870 |
2200 |
0,3 |
6 |
4 Синергетический закон в связи с результатами известных теорий водородной хрупкости.
В работе [35] закон водородной повреждаемости сопоставлен с выводами известных теорий и моделей ВХ. На рис. 4 показаны известные из литературы [31,36-40] экспериментальные данные по ВХ конструкционной стали.
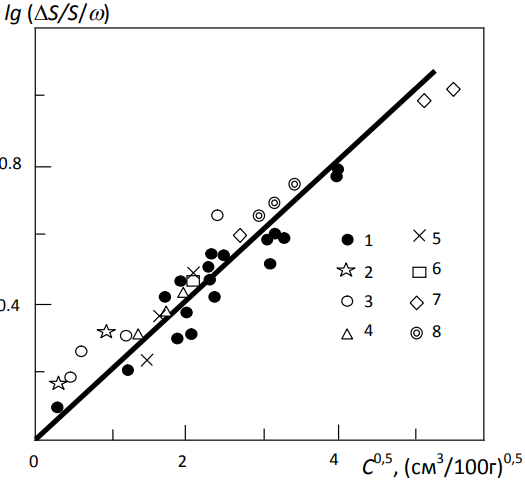
Рис. 4 – Закон водородной повреждаемости стали диффузионно-подвижным водородом (сплошная линия) и экспериментальные данные по ВХ различных марок стали (температура комнатная) [35]:
1 – сталь 20 и 18Х1Г1МФ [31]; 2 – низкоуглеродистая сталь Si-Mn-Cr [38]; 3 – сталь СМ3 [38]; 4 – высокопрочная сталь AISI4340 [40]; 5 – НТ80, закалка [36]; 6 – железо техническое [36]; 7 – сталь низкоуглеродистая [37]; 8 – феррит с 10 % никеля [39]
Эти результаты, полученные как при газовом, так и при электрохимическом наводороживании, были обработаны с использованием синергетического закона для диффузионно-подвижного водорода [31]:
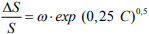 (16)
(16)
В табл. 2 приведены рассчитанные значения параметра водородной повреждаемости ω и критической концентрации по экспериментальным результатам различных исследований [31,36-40]. Как видно, обработка литературных данных подтвердила уравнение (16). Стали, сходные по структуре и прочности, имеют практически одинаковые значения. Оценки
близки к экспериментальным значениям [41]. Характерно, что расчет Ориани [40] для высокопрочной стали предсказывал значение
= 200-400 см3/100 г, что противоречило эксперименту [41]. Обработка результатов Ориани по уравнению (16) дает значения концентрации С = 2-4 см3/100 г, критической концентрации
= 6 см3/100 г, которые согласуются с опытными данными работы [41].
Обратимся к моделям ВХ [42-44]. Большинство расчетов ВХ стали основываются на признании ведущей роли или химического потенциала водорода в металле (теория декогезии), или адсорбционного понижения поверхностной энергии. С термодинамической точки зрения концепции декогезии и адсорбции эквивалентны.
Р. Томсон использовал адсорбционную модель ВХ, учел неоднородность деформации и упрочнение металла в устье трещины [43]. Из условия термодинамического равновесия системы трещина – водород им получено уравнение, хорошо описавшее опыты Ориани и др. Уравнение Томсона [43] можно представить в следующем виде:
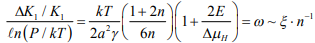 (17)
(17)
где n – показатель деформационного упрочнения;
К1 – коэффициент интенсивности напряжений;
а = 2,48 Ǻ – период решетки железа;
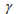 = 1,975 Дж·м - 2 – поверхностная энергия;
= 1,975 Дж·м - 2 – поверхностная энергия;
Т = 294 К;
Е – энергия связи адсорбированных атомов на поверхности;
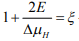 – характеристика адсорбционного взаимодействия.
– характеристика адсорбционного взаимодействия.
Табл. 2 – Рассчитанные значения параметра водородной повреждаемости ω и критической концентрации по экспериментальным результатам различных исследований [35]
|
Марка стали, термообработка |
Условия наводороживания |
σ0,2 МПа |
S, МПа |
ω |
см³/ 100г. |
Источник |
|
Сталь 20, нормализация |
Н2S, электролит, рН 0,6-4,3 |
300 |
960 |
0,05 |
36 |
[31] |
|
Низкоуглеродистая сталь |
То же, рН 1-6 |
- |
600 |
0.025 |
54 |
[37] |
|
Х46, контролируемая прокатка |
То же, рН 0,6-3,5 |
380 |
1150 |
0.028 |
51 |
[31] |
|
30ХМА, улучшение |
То же, рН 0,6 |
670 |
1630 |
0,026 |
53 |
[31] |
|
18Х1Г1МФ, отпуск 740°С |
То же, рН 0,6-4,3 |
650 |
1500 |
0,18 |
12 |
[31] |
|
Низкоуглеродистая сталь Si-Mn-Cr |
Электрохимическое |
- |
- |
0,20 |
10 |
[38] |
|
НТ80, закалка в воде |
Газовое при 900°С, 1атм |
- |
2100 |
0,14 |
15 |
[36] |
|
Сталь СМ3 |
Растворы: Н2S (насыщ.), HCl 0,1N, 3% NaCl, Н2 SO4 (рН 5) |
- |
- |
0,15 |
14 |
[38] |
|
Железо техническое, охлаждение с 900°С в воде |
Газовое при 900°С, 1атм |
- |
- |
0,16 |
13 |
[36] |
|
Феррит с 10% Ni, отжиг |
Катодное в 4%-ной Н2SO4 со стимуляторами |
- |
- |
0,15 |
14 |
[39] |
|
AISI 4340, закалка, низкий отпуск |
Водород при ≤1 атм, 25°С |
1720 |
66* |
0,30 |
6 |
[40] |
|
30ХМА, закалка, низкий отпуск |
Н2S-HCl, электролит рН 0,6 |
870 |
2200 |
0,30 |
6 |
[31] |
|
Сталь 20, субструктурное упрочнение |
То же |
350 |
1050 |
0,015 |
70 |
[31] |
*K1С, МПа∙м ½
Соотношение (17) выражает синергетический закон водородной повреждаемости (1), поскольку выражение
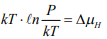
представляет собой приращение химического потенциала внешнего водорода. Согласно уравнению (17) повреждаемость ω возрастает с увеличением энергии адсорбции 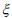 водорода и уменьшается с ростом способности металла к упрочнению n. Поскольку типичные значения n = 0,1 – 0,3, то для пластичных сталей, если пренебречь адсорбцией, уравнение (17) предсказывает значения параметра водородной повреждаемости ω = 0,01 – 0,03. Для высокопрочных сталей основной вклад в повреждаемость будет вносить коэффициент адсорбционного взаимодействия
водорода и уменьшается с ростом способности металла к упрочнению n. Поскольку типичные значения n = 0,1 – 0,3, то для пластичных сталей, если пренебречь адсорбцией, уравнение (17) предсказывает значения параметра водородной повреждаемости ω = 0,01 – 0,03. Для высокопрочных сталей основной вклад в повреждаемость будет вносить коэффициент адсорбционного взаимодействия 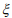 . При физической адсорбции водорода на железе энергия связи Е = 12 – 20 кДж/моль [42], если принять давление внешнего водорода ~ 10-2 атм. (опыты Ориани [40]), то из выражения (17) имеем значение параметра водородной повреждаемости ω = 0,03 – 0,07. В случае же хемосорбции энергия связи Е = 50 – 95 кДж/моль [42] значения ω будут 0,2 – 0,4.
. При физической адсорбции водорода на железе энергия связи Е = 12 – 20 кДж/моль [42], если принять давление внешнего водорода ~ 10-2 атм. (опыты Ориани [40]), то из выражения (17) имеем значение параметра водородной повреждаемости ω = 0,03 – 0,07. В случае же хемосорбции энергия связи Е = 50 – 95 кДж/моль [42] значения ω будут 0,2 – 0,4.
Из табл. 2 литературных данных видно, что оценки параметра водородоповреждаемости ω, полученные на основе адсорбционно-деформационной модели Томсона по уравнению (17) по порядку величины совпадают с экспериментальными данными табл. 1 и пригодны для качественного описания ВХ и пластичных и высокопрочных сталей.
Модели декогезии и адсорбции предназначаются в основном для объяснения растрескивания высокопрочной стали. Для пластичной стали развиваются модели внутреннего давления и деформационной неустойчивости [42].
Модель декогезии и закон Сивертса выводили соотношение:
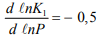
В теории адсорбции это отношение изменяется от 0,05 до 0,4; по эксперименту Ориани – 0,42 [40, 43].
В работе [42] сделан анализ различных моделей ВХ, и автор приходит к выводу об отсутствии простого механизма влияния водорода на ухудшение свойств стали и необходимости наблюдений и расчетов событий, происходящих на кончике трещины, на атомном уровне. По мнению автора [35] адсорбционно-декогезионные теории ВХ для определения параметра водородной повреждаемости ω носят оценочный характер, хотя предлагают уравнения, которые выражают синергетический закон водородной повреждаемости.
Литература
1. Маричев, В.А. Связь критической концентрации водорода и критического коэффициента интенсивности напряжений при водородном охрупчивании / В.А. Маричев // Физ-хим. механика материалов. – 1984. –№ 3. – С. 6-14.
2. Панасюк, В.В. Расчетная модель роста трещины в металлах при воздействии водорода / В.В. Панасюк, А.Е. Андрейкив, О.И. Обухивский // Физ-хим. механика материалов. – 1984. – Т. 20. – № 3. – С. 3-6.
3. Архангельская, Е.А. Связная модель замедленного разрушения повреждаемой среды / Е.А. Архангельская, В.В. Лепов, В.П. Ларионов // Физическая мезомеханика. – 2001. – Т. 4. – № 5. – С. 81-87.
4. Присевок, А.Ф. Механизм водородного изнашивания металлов и сплавов / А.Ф. Присевок // Вестник БГПА. – 2002. – № 3. – С. 23-25.
5. Баранов, В.П. Кинетика замедленного разрушения высокопрочных сталей в инактивных и водородсодержащих средах / В.П. Баранов, Н.Н. Сергеев // Известия Тульск. гос. ун-та. – 2004. – № 4. – С. 3-19.
6. Швачко, В.И. Модель водородного охрупчивания конструкционных сталей / В.И. Швачко // Металлофизика и новые технологии. – 2001. – Т. 23. – № 11. – С. 1501-1512.
7. Гаврилюк, В.Г. Физические механизмы водородного охрупчивания сталей: тезисы докладов 14-х Петербургских чтений по проблемам прочности, посвященные 300-летию Санкт-Петербурга / В.Г. Гаврилюк, В.Н. Шиванюк. – СПб, 2003. – С. 110.
8. Нечаев, Ю.С. Роль гидридоподобных сегрегаций на дислокациях и границах зерен в замедленном разрушении сталей: сб. трудов 3 Междунар. конф. «Водородная обработка материалов-2001» / Ю.С. Нечаев, Г.А. Филлипов. – Донецк: типогр. «Норд Компьютер», 2001. – С. 284-286.
9. Шашкова, Л.В. Синергетические эффекты в неравновесных системах металл-водород / Л.В. Шашкова. – Deutschland: LAP LAMBERT Academic Publishing, 2013. – 105 с.
10. Гельд, П.В. Водород в металлах и сплавах / П.В. Гельд, Р.А. Рябов. – М.: Металлургия, 1974. – 272 с.
11. Фелькль, И. Диффузия водорода в металлах: сб. трудов «Водород в металлах» / И. Фелькль, Г. Алефельд. – М.: Мир, 1981. – Т. 1. – С. 379-408.
12. Лариков, Л.Н. Диффузия в металлах и сплавах: справочник / Л.Н. Лариков, В.И. Исаичев. – Киев: Наукова думка, 1987. – 512 с.
13. Диффузионно-кооперативные явления в системах металл-изотопы водорода: матер. 1-го междунар. семинара «Металлводород – 92». – Донецк, 1992. – Ч. 1. – 124 с. – Ч 2. – 50 с.
14. Шулепов, Ю.В. Решеточный газ / Ю.В. Шулепов, Е.В. Аксененко. – Киев: Наукова думка, 1981. – 168 с.
15. Савченков, Э.А. О водородостойкости конструкционной стали / Э.А. Савченков // Известия АН СССР. Металлы. – 1987. – № 1. – С. 93-99.
16. Шашкова, Л.В. Микродеформация и повреждаемость железа и стали, активируемые диффузией водорода: авт. дисс. канд. техн. наук: 05. 16. 01 / Л.В. Шашкова. – М.: МАСИ, 1992. – 18 с.
17. Разработка количественной теории водородной хрупкости, создание способов диагностики разрушения и повышения долговечности стали в коррозионно-активных средах / Отчёт по НИР; № гос. регистрации 01860056219; инв. № 02860104903; научный руководитель канд. техн. наук Савченков Э.А.; ответственный исполнитель канд. техн. наук Шашкова Л.В. – Оренбург: ОГУ, 2001. – 35 с.
18. Савченков, Э.А. Повреждаемость и оптимизация субструктурного состояния стали при нестационарной диффузии водорода / Э.А. Савченков, Л.В. Шашкова, В.К. Шашкова [и др.]; деп. в ВИНИТИ. – 2000. – № 2319-ВОО. – 16 с.
19. Шашкова, Л.В. О состояниях водорода в металле и процессах упрочнения и разупрочнения: сб. трудов IV Междунар. школы «Физическое материаловедение» / Л.В. Шашкова. – Тольятти: ТГУ, 2009. – С. 41-44.
20. Айткулов, Р.Р. Кинетика водородного охрупчивания и эффективность субструктурного взрывного упрочнения стали: авт. дисс. канд. техн. наук: 05. 16. 01 / Р.Р. Айткулов. – Оренбург: ОГУ, 2010. – 19 с.
21. Савченков, Э.А. Размерный эффект электрохимического проникновения водорода в стальные цилиндрические образцы / Э.А. Савченков, Л.В. Шашкова // Изв. РАН РФ. Металлы. – 1997. – № 3. – С. 169-174.
22. Маричев, В.А. Современные представления о водородном охрупчивании при замедленном разрушении / В.А. Маричев // Защита металлов. – 1980. – Т. 26. – № 5. – С. 531-543.
23. Oriani, R.A. Hydrogen embrittlement of steel / R.A. Oriani // Mat. Sci. – 1978. – V. 8. – P. 327-357.
24. Смяловски, М. Водородное охрупчивание железа и стали. Новые результаты и выводы: сб. трудов «Коррозия под напряжением и водородное охрупчивание» / М. Смяловски. – Дрезден: Ин-т физ. химии АН ГДР, 1975. – C. 18-47.
25. Колачев, Б.А. Водородная хрупкость металлов / Б.А. Колачев. – М.: Металлургия, 1985. – 216 с.
26. Гельд, П.В. Водород и несовершенства структуры металла / П.В. Гельд, Р.А. Рябов, Е.С. Кодес. – М.: Металлургия, 1979. – 221 с.
27. Мороз, Л.С. Водородная хрупкость металлов / Л.С. Мороз, Б.Б. Чечулин. – М.: Металлургия, 1967. – 256 с.
28. Савченков, Э.А. Критерии динамической и статической водородной хрупкости стали при электрохимических процессах / Э.А. Савченков // Деп. ВИНИТИ, 1984. – № 6778 – 24 с.
29. Китель, Ч. Статистическая термодинамика / Ч. Киттель. – М.: Наука, 1977. – 336 с.
30. Рачиньски, В. Расширение решетки железа, вызываемое катодным наводороживанием, и парциальный объем водорода в металле: сб. трудов «Коррозия под напряжением и водородное охрупчивание» / В. Рачиньски. – Дрезден: Ин-т физ. химии АН ГДР, 1975. – С. 85-91.
31. Савченков, Э.А. Водородостойкость и критические концентрации гидрирования конструкционной стали / Э.А. Савченков // Изв. АН СССР. Металлы. – 1986. – № 5. – С. 153-158.
32. Савченков, Э.А. Сопротивление конструкционной стали разрушению при наводороживании и сероводородном растрескивании / Э.А. Савченков // МиТОМ. – 1985. – № 8. – С. 7-11.
33. Шашкова, Л.В. О методическом подходе к изучению кинетики водородного охрупчивания сталей / Л.В. Шашкова // Международный научно-исследовательский журнал. – 2012. – Ч. 1. – № 5 (5) . – С. 30-36.
34. Суворин, В. Я. Методы оценки и исследования влияния водорода на пластичность, прочность и хрупкое разрушение сварных соединений низкоуглеродистых и низколегированных сталей (применительно к условиям эксплуатации): авт. дисс. докт. техн. наук: 05. 16. 01 / В. Я. Суворин. – М.: МВТУ им. Н. Э. Баумана, 1981. – 31 с.
35. Савченков, Э.А. О водородной повреждаемости конструкционной стали / Э.А. Савченков // Изв. АН СССР. Металлы. – 1989. – № 6. – С. 141- 145.
36. Kikuta, V. Hydrogen – dislocation interaction and its parallelism with hydrogen embrittlement / V. Kikuta, K. Sugimoto, S. Ochiai // Trans. Iron Steel Inst. Jpn. – 1975. – V. 15. – P. 87-94.
37. Кавашима, А. Адсорбция водорода и водородное охрупчивание низкоуглеродистой стали в кислых растворах сероводорода / А. Кавашима // Нихон киндзоку гаккайси. – 1974. – № 11. – С. 1046-1050.
38. Ямакава, К. Примеры разрушения аппаратуры вследствие водородной хрупкости: пер. № А-31152 / К. Ямакава. – М.: ВЦП, 1977. – 23 с.
39. Shultz, А. Robertson W. Нуdrogen аbsorbtion, еmbrittlement аnd stress соггоsion cracking of steel / А. Shultz, W. Robertson // Соггоsion. – 1957. – V. 13. – № 7. – Р. 437-456.
40. Oriani, R.A. Equilibrium and kinetic studies of the hydrogen-assisted cracking of steel / R.A. Oriani, P.H. Josephic // Acta Мet. – 1977. – V. 25. – № 9 – Р. 979-988.
41. Van Leeuwen, H.P. Embrittlement by internal and by external hydrogen / H.P. Van Leeuwen // Corrosion. – 1975. – V. 31. – № 5 – Р. 154-159.
42. Hirth, J.P. Effects of hydrogen on the properties of iron and steel / Hirth J.P. // Met. Trans. – 1980. – V. 11. – № 6. – Р. 861-890.
43. Thomson, R.J. Вгittlе fracture in а ductile material with аррliсаtiоn tо hydrogen embrittlement / R.J. Thomson // Маtег. Sсi. – 1978. – V. 13. – № 1. – Р. 128-142.
44. Louthan, М.R. Stгаin 1оса1izаtiоn and hуdrоgеn embrittlement / М.R. Louthan // Scr. Met. – 1983. – V. 17. – Р. 451-456.
References
Маричев, В.А. Связь критической концентрации водорода и критического коэффициента интенсивности напряжений при водородном охрупчивании / В.А. Маричев // Физ-хим. механика материалов. – 1984. –№ 3. – С. 6-14.
Панасюк, В.В. Расчетная модель роста трещины в металлах при воздействии водорода / В.В. Панасюк, А.Е. Андрейкив, О.И. Обухивский // Физ-хим. механика материалов. – 1984. – Т. 20. – № 3. – С. 3-6.
Архангельская, Е.А. Связная модель замедленного разрушения повреждаемой среды / Е.А. Архангельская, В.В. Лепов, В.П. Ларионов // Физическая мезомеханика. – 2001. – Т. 4. – № 5. – С. 81-87.
Присевок, А.Ф. Механизм водородного изнашивания металлов и сплавов / А.Ф. Присевок // Вестник БГПА. – 2002. – № 3. – С. 23-25.
Баранов, В.П. Кинетика замедленного разрушения высокопрочных сталей в инактивных и водородсодержащих средах / В.П. Баранов, Н.Н. Сергеев // Известия Тульск. гос. ун-та. – 2004. – № 4. – С. 3-19.
Швачко, В.И. Модель водородного охрупчивания конструкционных сталей / В.И. Швачко // Металлофизика и новые технологии. – 2001. – Т. 23. – № 11. – С. 1501-1512.
Гаврилюк, В.Г. Физические механизмы водородного охрупчивания сталей: тезисы докладов 14-х Петербургских чтений по проблемам прочности, посвященные 300-летию Санкт-Петербурга / В.Г. Гаврилюк, В.Н. Шиванюк. – СПб, 2003. – С. 110.
Нечаев, Ю.С. Роль гидридоподобных сегрегаций на дислокациях и границах зерен в замедленном разрушении сталей: сб. трудов 3 Междунар. конф. «Водородная обработка материалов-2001» / Ю.С. Нечаев, Г.А. Филлипов. – Донецк: типогр. «Норд Компьютер», 2001. – С. 284-286.
Шашкова, Л.В. Синергетические эффекты в неравновесных системах металл-водород / Л.В. Шашкова. – Deutschland: LAP LAMBERT Academic Publishing, 2013. – 105 с.
Гельд, П.В. Водород в металлах и сплавах / П.В. Гельд, Р.А. Рябов. – М.: Металлургия, 1974. – 272 с.
Фелькль, И. Диффузия водорода в металлах: сб. трудов «Водород в металлах» / И. Фелькль, Г. Алефельд. – М.: Мир, 1981. – Т. 1. – С. 379-408.
Лариков, Л.Н. Диффузия в металлах и сплавах: справочник / Л.Н. Лариков, В.И. Исаичев. – Киев: Наукова думка, 1987. – 512 с.
Диффузионно-кооперативные явления в системах металл-изотопы водорода: матер. 1-го междунар. семинара «Металлводород – 92». – Донецк, 1992. – Ч. 1. – 124 с. – Ч 2. – 50 с.
Шулепов, Ю.В. Решеточный газ / Ю.В. Шулепов, Е.В. Аксененко. – Киев: Наукова думка, 1981. – 168 с.
Савченков, Э.А. О водородостойкости конструкционной стали / Э.А. Савченков // Известия АН СССР. Металлы. – 1987. – № 1. – С. 93-99.
Шашкова, Л.В. Микродеформация и повреждаемость железа и стали, активируемые диффузией водорода: авт. дисс. канд. техн. наук: 05. 16. 01 / Л.В. Шашкова. – М.: МАСИ, 1992. – 18 с.
Разработка количественной теории водородной хрупкости, создание способов диагностики разрушения и повышения долговечности стали в коррозионно-активных средах / Отчёт по НИР; № гос. регистрации 01860056219; инв. № 02860104903; научный руководитель канд. техн. наук Савченков Э.А.; ответственный исполнитель канд. техн. наук Шашкова Л.В. – Оренбург: ОГУ, 2001. – 35 с.
Савченков, Э.А. Повреждаемость и оптимизация субструктурного состояния стали при нестационарной диффузии водорода / Э.А. Савченков, Л.В. Шашкова, В.К. Шашкова [и др.]; деп. в ВИНИТИ. – 2000. – № 2319-ВОО. – 16 с.
Шашкова, Л.В. О состояниях водорода в металле и процессах упрочнения и разупрочнения: сб. трудов IV Междунар. школы «Физическое материаловедение» / Л.В. Шашкова. – Тольятти: ТГУ, 2009. – С. 41-44.
Айткулов, Р.Р. Кинетика водородного охрупчивания и эффективность субструктурного взрывного упрочнения стали: авт. дисс. канд. техн. наук: 05. 16. 01 / Р.Р. Айткулов. – Оренбург: ОГУ, 2010. – 19 с.
Савченков, Э.А. Размерный эффект электрохимического проникновения водорода в стальные цилиндрические образцы / Э.А. Савченков, Л.В. Шашкова // Изв. РАН РФ. Металлы. – 1997. – № 3. – С. 169-174.
Маричев, В.А. Современные представления о водородном охрупчивании при замедленном разрушении / В.А. Маричев // Защита металлов. – 1980. – Т. 26. – № 5. – С. 531-543.
Oriani, R.A. Hydrogen embrittlement of steel / R.A. Oriani // Mat. Sci. – 1978. – V. 8. – P. 327-357.
Смяловски, М. Водородное охрупчивание железа и стали. Новые результаты и выводы: сб. трудов «Коррозия под напряжением и водородное охрупчивание» / М. Смяловски. – Дрезден: Ин-т физ. химии АН ГДР, 1975. – C. 18-47.
Колачев, Б.А. Водородная хрупкость металлов / Б.А. Колачев. – М.: Металлургия, 1985. – 216 с.
Гельд, П.В. Водород и несовершенства структуры металла / П.В. Гельд, Р.А. Рябов, Е.С. Кодес. – М.: Металлургия, 1979. – 221 с.
Мороз, Л.С. Водородная хрупкость металлов / Л.С. Мороз, Б.Б. Чечулин. – М.: Металлургия, 1967. – 256 с.
Савченков, Э.А. Критерии динамической и статической водородной хрупкости стали при электрохимических процессах / Э.А. Савченков // Деп. ВИНИТИ, 1984. – № 6778 – 24 с.
Китель, Ч. Статистическая термодинамика / Ч. Киттель. – М.: Наука, 1977. – 336 с.
Рачиньски, В. Расширение решетки железа, вызываемое катодным наводороживанием, и парциальный объем водорода в металле: сб. трудов «Коррозия под напряжением и водородное охрупчивание» / В. Рачиньски. – Дрезден: Ин-т физ. химии АН ГДР, 1975. – С. 85-91.
Савченков, Э.А. Водородостойкость и критические концентрации гидрирования конструкционной стали / Э.А. Савченков // Изв. АН СССР. Металлы. – 1986. – № 5. – С. 153-158.
Савченков, Э.А. Сопротивление конструкционной стали разрушению при наводороживании и сероводородном растрескивании / Э.А. Савченков // МиТОМ. – 1985. – № 8. – С. 7-11.
Шашкова, Л.В. О методическом подходе к изучению кинетики водородного охрупчивания сталей / Л.В. Шашкова // Международный научно-исследовательский журнал. – 2012. – Ч. 1. – № 5 (5) . – С. 30-36.
Суворин, В. Я. Методы оценки и исследования влияния водорода на пластичность, прочность и хрупкое разрушение сварных соединений низкоуглеродистых и низколегированных сталей (применительно к условиям эксплуатации): авт. дисс. докт. техн. наук: 05. 16. 01 / В. Я. Суворин. – М.: МВТУ им. Н. Э. Баумана, 1981. – 31 с.
Савченков, Э.А. О водородной повреждаемости конструкционной стали / Э.А. Савченков // Изв. АН СССР. Металлы. – 1989. – № 6. – С. 141- 145.
Kikuta, V. Hydrogen – dislocation interaction and its parallelism with hydrogen embrittlement / V. Kikuta, K. Sugimoto, S. Ochiai // Trans. Iron Steel Inst. Jpn. – 1975. – V. 15. – P. 87-94.
Кавашима, А. Адсорбция водорода и водородное охрупчивание низкоуглеродистой стали в кислых растворах сероводорода / А. Кавашима // Нихон киндзоку гаккайси. – 1974. – № 11. – С. 1046-1050.
Ямакава, К. Примеры разрушения аппаратуры вследствие водородной хрупкости: пер. № А-31152 / К. Ямакава. – М.: ВЦП, 1977. – 23 с.
Shultz, А. Robertson W. Нуdrogen аbsorbtion, еmbrittlement аnd stress соггоsion cracking of steel / А. Shultz, W. Robertson // Соггоsion. – 1957. – V. 13. – № 7. – Р. 437-456.
Oriani, R.A. Equilibrium and kinetic studies of the hydrogen-assisted cracking of steel / R.A. Oriani, P.H. Josephic // Acta Мet. – 1977. – V. 25. – № 9 – Р. 979-988.
Van Leeuwen, H.P. Embrittlement by internal and by external hydrogen / H.P. Van Leeuwen // Corrosion. – 1975. – V. 31. – № 5 – Р. 154-159.
Hirth, J.P. Effects of hydrogen on the properties of iron and steel / Hirth J.P. // Met. Trans. – 1980. – V. 11. – № 6. – Р. 861-890.
Thomson, R.J. Вгittlе fracture in а ductile material with аррliсаtiоn tо hydrogen embrittlement / R.J. Thomson // Маtег. Sсi. – 1978. – V. 13. – № 1. – Р. 128-142.
Louthan, М.R. Stгаin 1оса1izаtiоn and hуdrоgеn embrittlement / М.R. Louthan // Scr. Met. – 1983. – V. 17. – Р. 451-456.