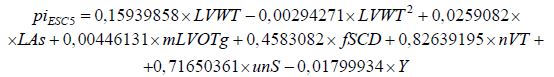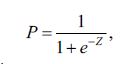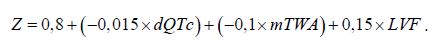STRATIFICATION MODELS FOR PREDICTING SUDDEN CARDIAC DEATH: THE SEARCH FOR IMPROVING THE EFFECTIVENESS OF THE PROGNOSIS CONTINUES
СТРАТИФИЦИРУЮЩИЕ МОДЕЛИ ПРЕДСКАЗАНИЯ ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ: ПОИСК ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ПРОГНОЗА ПРОДОЛЖАЕТСЯ
Обзорная статья
Авдеева Д.К.1 , Еньшин С.И.2 , Иванов М.Л.3 , Корниенко А.И.4 , Турушев Н.В.5, *, Южаков М.М.6 , Максимов И.В.7
1 ORCID: 0000-0002-4696-3756;
2 ORCID: 0000-0001-5645-3322;
3 ORCID: 0000-0002-3039-2805;
5 ORCID: 0000-0003-3804-5979;
6 ORCID: 0000-0001-9642-602X;
7 ORCID: 0000-0003-0367-1654;
1–6 Томский Политехнический Университет, Томск, Россия;
7 Научно-исследовательский институт кардиологии. Томск, Россия
* Корреспондирующий автор (nvtur90[at]mail.ru)
Аннотация
Стратификация пациентов по шансу возникновения эпизода внезапной сердечной смерти (ВСС) является важной проблемой, решение которой позволит сократить смертность от сердечно-сосудистых заболеваний (ССЗ) и уменьшить количество ошибочно предписанных имплантаций электрокардиостимуляторов, подвергающих пациентов лишним послеоперационным рискам. Для решения данной задачи научные группы всего мира применяют комплексные модели оценки состояния человека. Степень универсальности и избирательности работы данных моделей влияет на эффективность и охват населения при разделении его на группы подверженности случаям ВСС. К сожалению, анализ обнаруженных исследовательских и действующих медицинских моделей стратификации не охватывает полностью все категории населения, оставляя людей с бессимптомно проявляющимися случаями ВСС без защиты.
Ключевые слова: внезапная сердечная смерть, стратифицирующие модели, стратификация населения, сердечнососудистые заболевания.
STRATIFICATION MODELS FOR PREDICTING SUDDEN CARDIAC DEATH: THE SEARCH FOR IMPROVING THE EFFECTIVENESS OF THE PROGNOSIS CONTINUES
Review article
Avdeeva D.K.1 , Yenshin S.I.2 , Ivanov M.L.3 , Kornienko A.I.4 , Turushev N.V.5, *, Yuzhakov M.M.6 , Maksimov I.V.7
1 ORCID: 0000-0002-4696-3756;
2 ORCID: 0000-0001-5645-3322;
3 ORCID: 0000-0002-3039-2805;
5 ORCID: 0000-0003-3804-5979;
6 ORCID: 0000-0001-9642-602X;
7 ORCID: 0000-0003-0367-1654;
1–6 Tomsk Polytechnic University, Tomsk, Russia;
7 Tomsk Cardiology Research Institute, Tomsk, Russia
* Corresponding author (nvtur90[at]mail.ru)
Abstract
Stratification of patients by the chance of an episode of sudden cardiac death (SCD) is an important problem, the solution of which will reduce mortality from cardiovascular diseases (CVD) as well as the number of mistakenly prescribed implantations of electrocardiostimulator, exposing patients to unnecessary postoperative risks. To solve this issue, scientific groups around the world use complex models for assessing the patient's condition. The degree of universality and selectivity of these models affects the effectiveness and coverage of the population when dividing it into groups of susceptibility to cases of SCD. Unfortunately, the analysis of the obtained research and current medical stratification models does not fully cover all categories of the population, leaving out people with asymptomatic cases of SCD.
Keywords: sudden cardiac death, stratifying models, population stratification, cardiovascular diseases.
Введение
Проблема внезапной сердечной смерти (ВСС) является значительной для мирового сообщества. Это связано с тем, что эпизод ВСС в большинстве случаев происходит без проявления тревожных знаков, а летальный исход достигается в первые часы начала явных патологических процессов в работе сердечно-сосудистой системы. Именно это свойство ВСС является самым опасным – из-за внезапности происходящего события человек может быть не в состоянии позвать на помощь, из чего следует, что медицинская помощь будет оказана слишком поздно. Усугубляет опасность ВСС тот факт, что человек не подозревает о существующей проблеме и может быть застигнут эпизодом ВСС во время осуществления работы, связанной с безопасностью других людей. Например, в США согласно [1], ежегодно регистрируется больше 350000 случаев остановки сердца вне больницы, из них более половины не получает необходимую медицинскую помощь. Около 50% случаев ВСС происходит при первых эпизодах инфаркта миокарда [2], (7-20)%, (24-38)%, (40-56)% в течение года, 5 и 10 лет соответственно [3]. От 2 до 4 процентов случаев ВСС происходят у людей с кардиомиопатиями [4]. Таким образом, проблема ВСС касается значительной группы населения, а общая смертность от случаев ВСС в год может достигать до 5 миллионов человек [5].
Проблема стратификации ВСС
Применяемые на данный момент методы разделения людей на группы риска возникновения случаев ВСС обладают низкой надежностью, о чем свидетельствует исследование DANISH, в котором утверждается, что назначаемое вживление водителей ритма пациентам для предотвращения ВСС было избыточным и подвергало пациентов лишним послеоперационным рискам, при этом 80% случаев остановки сердца происходило вне клиники у людей без кардиостимулятора [6]. Из этого следует, что самой уязвимой группой продолжают оставаться люди без явно выраженных признаков сердечно-сосудистых заболеваний, которые не успевают получить необходимых реанимационных процедур.
Согласно проведенному анализу, на данный момент для определения случаев ВСС в научной и медицинской практике упомянуты следующие методы: сбор анамнеза пациента, неинвазивные техники визуализации сердца, генетическое исследование, серологическое исследование, электрокардиографические исследования, исследования автономного тонуса, электрофизиологические исследования.
Для надежной стратификации людей по группам риска возникновения ВСС использование одного из перечисленных выше методов недостаточно. По этой причине различные ученые группы разрабатывают специальные модели, включающие в себя комплекс диагностических методов для повышения точности предсказания случаев ВСС и уменьшения количества неверно назначенных лечебных процедур. Одной из самых старых и принимаемых медицинскими сообществами системой стратификации считаются критерии Биггера [7]. В национальных рекомендациях Российской Федерации данная стратификация считается основной [8]. В данной системе основными методами диагностики выступали: сбор анамнеза, эхокардиография и ЭКГ. Основными рассматриваемыми параметрами были: наличие случаев синкопе, эпизодов острого инфаркта миокарда (ОИМ), объем ФВЛЖ и наличие желудочковых экстрасистолий (ЖЭ) и тахикардии (ЖТ) (таблица 1). Деление производилось на две группы: умеренного и высокого риска.
Таблица 1 – Параметры стратифицирующей модели Биггера
|
Факторы риска |
Риск случая ВСС в год стратификации, % |
|
Группа высокого риска |
|
|
Наличие эпизодов ВСС в прошлом |
30-50 |
|
Наличие ЖТ и эпизодов обморока |
30-50 |
|
Наличие ЖТ и минимальных клинических проявлений |
20-30 |
|
Группа умеренного риска |
|
|
Наличие ОИМ в анамнезе или ФВЛЖ ниже 40% |
5 |
|
Наличие ОИМ и ФВЛЖ ниже 40% |
10 |
|
Наличие ОИМ и частые случаи ЖЭ |
10 |
|
ФВЛЖ ниже 40% и наличие ЖЭ |
10 |
|
Наличие ОИМ, ФВЛЖ ниже 40% и присутствие ЖЭ на ЭКГ |
15 |
В случаях отсутствия у людей признаков структурной патологии сердца, но при присутствии нарушения ритма и патологии путей проведения сердца может применяться система стратификации, разработанная Фогоросом [8]. В данном подходе людей разделяют на 3 группы: высокий, средний, низкий риск смертности. При этом основным методом диагностики выступает электрокардиография. К группе с низким риском возникновения ВСС относятся пациенты с признаками предсердной экстрасистолии (ПрЭ), желудочковой эктопии без патологий структуры сердца, наджелудочковой тахикардии и атриовентрикулярной (АВ) блокадой первой степени. К средней группе риска относятся люди с одним или несколькими из следующих признаков: АВ-блокада второй степени с присутствием адекватной частоты замещающего ритма или без нее, фибрилляция предсердий, желудочковая экстрасистолия при наличии патологий структуры сердца. В группе с высоким фактором риска должны находиться пациенты с наличием в анамнезе эпизода фибрилляции желудочков, желудочковой тахикардии, синдромом Вольфа-Паркинсона-Уайта с антероградным проведением по дополнительному атриовентрикулярному соединению в присутствии фибрилляции предсердий, АВ-блокадой третьей степени при наличии низкой частоты замещающего ритма.
Другой известной моделью стратификации пациентов является предсказательная модель Европейского сообщества кардиологов 2014 года (ESC-модель). Данная модель направлена на стратификацию пациентов с возможной гипертрофической кардиомиопатией (ГКМП) сердца. В качестве диагностирующих методик использовались: сбор анамнеза, эхокардиография, электрокардиография. Данная модель не может быть использована для людей моложе 16 лет, профессиональных атлетов, для людей с ГКМП, обусловленной метаболическими заболеваниями или синдромами. Оценка риска ВСС производится на 5 ближайших лет. При оценке риска ВСС оценивают такие параметры, как: возраст (Y,годы), максимальная толщина стенки левого желудочка (LVWT,мм), размер левого предсердия (LAs, мм) (измеряется в M-режиме или при 2D-эхокардиографии по длинной окологрудинной оси), максимальный градиент давления в выводном тракте левого желудочка (mLVOTg, мм.рт.ст), наличие случаев ВСС в семейной истории (fSCD), наличие неустойчивой желудочковой тахикардии (nVT), наличие случаев необъяснимых обмороков (unS). Индекс шанса ВСС вычисляется по формуле:
|
|
(1) |
В зависимости от индекса, обследуемые делятся на 3 группы: менее 4% – группа низкого риска, от 4% до 6% – группа среднего риска, более 6% – группа высокого риска.
Даная модель стратификации обладает высокой чувствительностью (около 71%), однако исследования показывают переоценивание шанса возникновения случаев ВСС по сравнению с реальной картиной в тестовой когорте пациентов [9].
В другой стратифицирующей модели, называемой SHIFT, в качестве маркеров предикторов выступают случаи необъяснимых синкопе (unS), признаков сердечной недостаточности (HFi), превышение толщины межжелудочковой перегородки 19 мм (IVS), наличие фрагментированного QRS-комплекса на ЭКГ (fQRS). В качестве оценки вероятности ВСС используется значение PSCD, которое выражает шанс появления ВСС у человека в последующие 5 лет. Данная переменная вычисляется по формуле:
Согласно статистическому анализу результатов исследователей-разработчиков данной модели, при PSCD более 1,49 рекомендована имплантация ИКС [10]. Данная модель ориентирована на людей с гипертрофической кардиомиопатией сердца и обладает чувствительностью 68,8% и специфичностью 83,1% при предсказании случаев ВСС.
Другая модель стратификации ВСС описана в [11]. Данная модель ориентирована на людей с дилатационной кардиомиопатией. Вероятность возникновения случаев ВСС рассчитывалась при помощи бинарного логистического анализа по формуле:
|
|
(4) |
гдеZ – уравнение бинарной логистической регрессии, e – основание натуральонго логарифма.
В качестве качественных предикторов выступает наличие микроальтернаций Т-зубца (mTWA), дисперсии интервала QT (dQTc), объем ФВЛЖ менее 35% (LVF). Принимая эти параметры, как предикторы, значение Z находится по формуле:
|
|
(5) |
Для данной стратификационной модели пациенты делятся на две категории: с положительным прогнозом возникновения ВСС и с отрицательным. При значениях P меньше 0,5 – прогноз отрицательный, приP больше 0,5 – положительный. При этом при положительном прогностическом результате рекомендуется имплантации кардиостимулятора. Чувствительность данной модели для пациентов с дилатационной кардиомиопатией составила 79%, а специфичность – 90%.
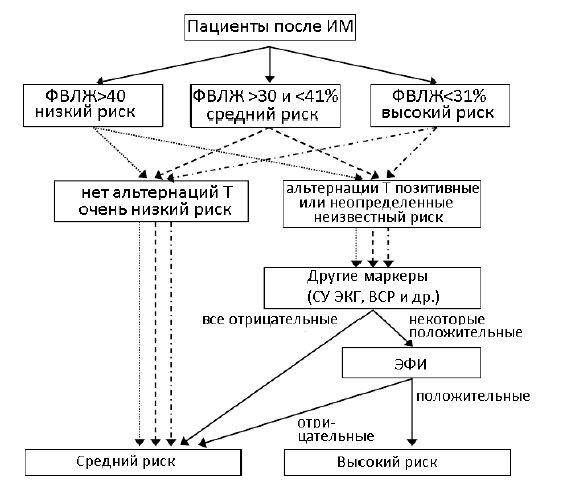
В исследовании [12] группа клиницистов так же выдвигает несколько стратифицирующих алгоритмов для людей со специализированными заболеваниями. Первый алгоритм включает в себя отбор пациентов с приступами инфаркта миокарда в анамнезе, проведением эхокардиографии с оценкой уровня ФВЛЖ, электрокардиографическими методами диагностики, включая СУ ЭКГ, и электрофизиологическим исследованием. Пациенты делятся на две группы: низкий риск и высокий. Группе высокого риска рекомендуется имплантация кардиостимулятора (Рисунок 1). Данная стратификация применяется для пациентов, переживших ИМ.
Рис. 1 – Алгоритм стратификации пациентов, переживших ИМ по [12]
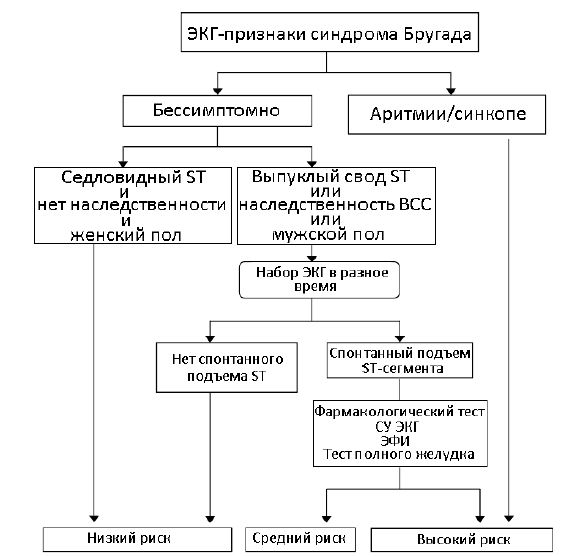
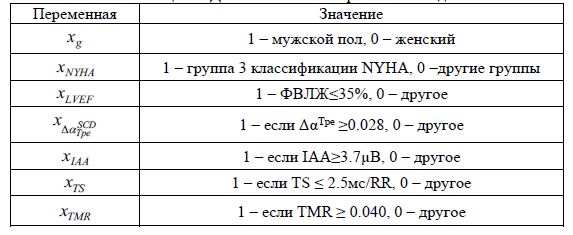
Второй алгоритм стратификации предназначен для анализа пациентов с синдромом Бругада. Данный алгоритм включает анализ ЭКГ, сбор анамнеза, клинические физиологические исследования, фармакологические тесты и делит пациентов на 3 группы риска: низкого, среднего, высокого риска. Для группы высокого риска рекомендуется имплантация кардиостимулятора (рисунок 2).
Рис. 2 – Алгоритм стратификации пациентов с синдромом Бругада по [12]
Модели, представленные ученой группой в [13] предназначены для стратификации в группе людей с хронической сердечной недостаточностью. При разработке моделей было выделено три вида: по клиническим предикторам, по электрокардиографическим предикторам и комбинированная модель. В модель с клиническими предикторами входят такие параметры, как: пол, группа в функциональной классификации Нью-Йоркской ассоциации сердца (NYHA), объем фракции выброса левого желудочка (LVEF). В модель с электрокардиографическими предикторами входят параметры: переход от пика к концу на Т-зубце (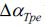
Таблица 2 – Дихотомические переменные моделей
Баллы для клинической модели рассчитываются по формуле:
Исследуемые распределяются по группам риска согласно квинтилям: 1 и 2 квинтили – группа низкого риска, 3 и 4 квинтили – группа среднего риска, 5 квинтиль – группа высокого риска. Наибольшую точность из трех моделей представляет модель на основе комбинированных параметров.
Во всех рассмотренных выше моделях стратификация групп людей начинается, исходя из существующих диагнозов или присутствующих ощутимых симптомов. Это делает полезными модели стратификации для групп с очевидными категориями риска, но игнорирует население без ярко выраженных симптомов, подверженное эпизодам ВСС.
Исследовательская группа научной производственной лаборатории «Медицинская инженерия» национального исследовательского Томского политехнического университета и сотрудники Томского НИМЦ «НИИ Кардиология» предлагают использовать в качестве критерия отбора или предиктора изменение энергии микропотенциалов сердца при динамическом исследовании человека на протяжении длительного периода жизни с систематическим ежегодным посещением врача-кардиолога.
Согласно исследованию, опубликованному в [14], изменение энергии микропотенциалов, записанных при помощи электрокардиографа высокого разрешения с частотой дискретизации 64 кГц и частотной полосой измерения от 0 до 10 кГц, выше порога 150% или ниже порога 50% от первоначального значения энергии соответствовало временному периоду перед возникновением случая ВСС. Таким образом, исследование данного параметра, например, при диспансеризации позволит проводить оценку предрасположенности к ВСС у людей в общей группе при анализе изменения данного параметра. На данный момент научная группа занимается оценкой точности данного метода и оптимизации набора других предикторов для стратификации людей по группам риска.
Заключение
При обзоре существующих стратифицирующих моделей была обнаружена тенденция применения, в основном, анамнеза пациента неинвазивных техник визуализации сердечно-сосудистой системы, генетического тестирования, и анализа фрагментов электрокардиограммы и ритма сердца. В работах исследователей отмечена необходимость аккумуляции базы данных для формирования более достоверной модели отбора населения, так как текущие данные являются недостаточными ввиду специфики эпизодов ВСС.
В результате исследования научных публикаций не было обнаружено универсальных, подходящих для всех групп населения моделей. Например, большинство из существующих моделей охватывает категорию взрослых людей и концентрируется на пациентах с существующими патологиями в работе сердца [15], а применение стратифицирующих категорий взрослых, например модели из [9], для детского населения несет высокие риски постановки неправильного диагноза впоследствии [16]. Так же, существующие модели не затрагивают пациентов, занимающихся активными видами спорта, среди которых присутствует риск возникновения ВСС [17]. Таким образом, проблема покрытия всех групп населения моделями стратификации по риску возникновения случаев ВСС остается актуальной.
|
Финансирование Исследование выполнено в рамках Программы повышения конкурентоспособности ТПУ. |
Funding The research is carried out at Tomsk Polytechnic University within the framework of Tomsk Polytechnic University Competitiveness Enhancement Program. |
|
Благодарности Выражаем благодарность сотрудникам Томского НИМЦ «НИИ Кардиология», принимавшим участие в исследовании и консультации. |
Acknowledgement We express our gratitude to the staff of the Tomsk Research Institute for Cardiology, who participated in the study and consultation. |
|
Конфликт интересов Не указан. |
Conflict of Interest None declared |
References
McCormack M. Creation of a Sudden Cardiac Arrest Safety Net / M. McCormack, C. Zarcone, K. Hoepper et al. // Building Healthy Academic Communities Journal. – 2021. – № 1(5). – P. 58–64. – DOI: 10.18061/bhac.v5i1.7972
Kurdgelija T.M. Vnezapnaja serdechnaja smert': jepidemiologija, faktory riska i profilaktika [Sudden Cardiac Death: epidemiology, risk factors and prevention] / T.M. Kurdgelija, O.N. Kislicina, T.S. Bazarsadaeva // Bjulleten' medicinskih Internet‐konferencij [Bulletin of Medical Internet Conferences]. – 2014. – №3. – P. 221-227 [in Russian]
Waks, J.W. Risk Stratification for Sudden Cardiac Death After Myocardial Infarction / J.W. Waks, A. Buxton, E. Risk // Annual Review of Medicine. – 2018. – № 69. – P. 147–64.
Blagova O.V. Stratifikacija riska vnezapnoj smerti i kriterii otbora na implantaciju defibrilljatorov u bol'nyh s kardiomiopatijami (dilatacionnoj, aritmogennoj pravozheludochkovoj, nekompaktnym miokardom) [Risk stratification of sudden death and selection criteria for the implantation of defibrillators in patients with cardiomyopathies (dilated, arrhythmogenic right ventricular, noncompact myocardium)] / O.V. Blagova, Ju.A. Lutohina, N.V. Varionchik et al. // Klin. i jeksperiment. hir. Zhurn. im. akad. B.V. Petrovskogo [Clin Experiment Surg. Petrovsky J.]. – 2018. – №3. – P. 34–49. – DOI: 10.24411/2308-1198-2018-13004 [in Russian]
Osman, J. Sudden Cardiac Death (SCD) – risk stratification and prediction with molecular biomarkers / J. Osman, C.T. Shing, Y.L. Pey et al. // Journal of Biomedical Science. – 2019. – № 26. – P. 1-12. – DOI: 10.1186/s12929-019-0535-8
Markman Т.М. Risk Stratification for Sudden Cardiac Death: Is It Too Late to Establish a Role for Cardiac MRI? / T.M. Markman, S. Nazarian // Circulation. – 2017. – № 135. – P. 2116–2118. – DOI: 10.1161/CIRCULATIONAHA. 117.027958
Bigger T.J. Identification of patients at high risk for sudden cardiac death / T.J. Bigger // The American Journal of Cardiology. – 1984. – Vol. 54. – № 9. – P. 3D-8D.
Shljahto E.V. Nacional'nye rekomendacii po opredeleniju riska i profilaktike vnezapnoj serdechnoj smerti [National recommendation for risk determination and prevention of sudden cardiac death] / E.V. Shljahto, G.P. Arutjunov, Ju.N. Belenkov et al. – Moscow : Medpraktika-M, 2018. – 247 p. [in Russian]
Vriesendorp A.P. Validation of the 2014 European Society of Cardiology Guidelines Risk Prediction Model for the Primary Prevention of Sudden Cardiac Death in Hypertrophic Cardiomyopathy / P.A. Vriesendorp, A.F.L. Schinkel, M. Liebregts et al. // Circulation: Arrhythmia and Electrophysiology. – 2015. – Vol. 8. – № 4. – P. 829–835.
Ruivo C. The SHIFT model combines clinical, electrocardiographic and echocardiographic parameters to predict sudden cardiac death in hypertrophic cardiomyopathy / C. Ruivo, F. Montenegro Sá, J. Correia et al. // Rev. Port. Cardiol. – 2019. – Vol. 38. – № 12. – P. 847–853.
Vajhanskaja T.G. Stratifikacija riska vnezapnoj smerti pacientov s dilatacionnoj kardiomiopatiej [Risk stratification of sudden cardiac death of patients with dilated cardiomyopathy] / T.G. Vajhanskaja, A.V. Frolov, O.P. Mel'nikova et al. // Vestnik aritmologii [Journal of Arrhythmology]. – 2014. – № 77. – P. 24–31 [in Russian]
Ikeda T. Risk Stratification for Sudden Cardiac Death / T. Ikeda, S. Yusu, K. Nakamura et al. // Circulation Journal. – 2007. – Vol. 71. – № SupplementA. – P. A106–A114.
Ramírez J. Sudden cardiac death and pump failure death prediction in chronic heart failure by combining ECG and clinical markers in an integrated risk model / J. Ramírez // PLOS ONE. – 2017. – № 10(12). – P. e0186152.
Guo W. New approaches to stratification of patients by the level of sudden cardiac death risk using the data on energies of cardiac micropotentials obtained by nanosensor-based hardware and software complex / W. Guo, D.K. Avdeeva, I.V. Maksimov et al. // Progress in Material Science and Engineering. – 2021. – Vol. 351. – P. 217-236.
Liew R. Sudden Cardiac Death Risk Stratification — An Update / R. Liew // European Cardiology Review. – 2015. – Vol. 10. – № 2. – P. 118–122.
Miron A. A Validated Model for Sudden Cardiac Death Risk Prediction in Pediatric Hypertrophic Cardiomyopathy / A. Miron // Circulation. – 2020. – № 3(142). – P. 217–229. DOI: 10.1161/circulationaha.120.047235
Wasfy M.M. Sudden Cardiac Death in Athletes / M.M. Wasfy, A.M. Hutter, R.B. Weiner // Methodist DeBakey cardiovascular journal. – 2016. – №12. – P. 76–80.