Blue-emissing fluorophore from the basidiomycete Neonothopanus nambi
Blue-emissing fluorophore from the basidiomycete Neonothopanus nambi
Abstract
Some photophysical and adsorption properties of a low-molecular-weight thermostable component extracted from the basidiomycete fungus Neonothopanus nambi and possessed blue fluorescence were studied. According to preliminary data, the relative quantum yield of light emission of the component in an aqueous medium was 0.04. The fluorophore has been found to strongly adsorb on various objects of biological (BSA molecules, Saccharomyces cerevisiae yeast cells) and non-biological (DEAE cellulose particles, QAE Sephadex granules, boehmite (γ-AlO(OH)) nature exhibit fluorescent properties after binding to the carriers. Statistical analysis of the data showed that after incubation with the fluorophore, BSA, DEAE cellulose particles and QAE Sephadex granules had the highest level of blue fluorescence — the increase in their fluorescence intensity was more than 50, 35 and 10 times, respectively. At the same time, the adsorption of the fluorophore on yeast cells and boehmite particles was accompanied by a significantly smaller increase in their fluorescence intensity — approximately 2–2.5 and 2.5–3 times, respectively. The results obtained open up prospects for further exploration of the applicability of the fluorophore from the fungus N. nambi as a new fluorescent marker for analytical applications.
1. Введение
Несмотря на внушительный список имеющихся в настоящее время синтетических флуоресцентных красителей, поиск новых природных низкомолекулярных флуорофоров, по-прежнему, является актуальным . Низкомолекулярные флуорофоры давно используются в молекулярной и клеточной биологии для визуализации внутриклеточных структур и биологических макромолекул и, в ряде случаев, имеют существенные преимущества перед высокомолекулярными маркерами (например, светящимися белками), поскольку легко проникают внутрь клетки , . С практической точки зрения интерес для исследователей могут представлять флуорофоры, излучающие свет в синей области спектра и не столь широко представленные в аналитике, по сравнению с маркерами, флуоресцирующими в длинноволновой области спектра. В связи с этим следует сказать, что представители высших грибов являются перспективными природными источниками большого числа ценных целевых продуктов, востребованных в разных сферах деятельности человека — в биологии, медицине, фармакологии, пищевой и текстильной промышленности, сельском хозяйстве. В частности, базидиомицеты обладают большим потенциалом для получения новых маркерных соединений, в том числе обладающих флуоресцентными свойствами. Например, хорошо известно, что базидиальные грибы продуцируют значительный спектр соединений группы индола, производные которого занимают одно из ведущих мест среди природных биологически активных веществ наряду с другими гетероциклическими соединениями — производными кумарина . Эти соединения широко используются в качестве хемосенсоров и флуоресцентных маркеров биомолекул благодаря своим оптическим свойствам — прежде всего, высокому квантовому выходу, значительному сдвигу Стокса и фотостабильности , , . Многие исследователи отмечают также принципиально важное с практической точки зрения свойство природных флуорофоров — отсутствие токсичности для живых клеток. Следует сказать, что для повышения качества визуализации внутриклеточных процессов и специфичности флуорофоров в живых клетках их модифицируют различными способами с целью получения индикаторов с усиленными флуоресцентными свойствами , , , .
В недавних исследованиях мы выделяли экстраклеточные ферменты из светящегося базидиомицета N. nambi оригинальным способом обработки его мицелия β-глюкозидазой . В полученных таким способом водных экстрактах нами был обнаружен компонент, который многократно увеличивал интенсивность биолюминесценции гриба in vivo . В ходе дальнейших экспериментов мы установили, что обнаруженный нами активатор грибного свечения является низкомолекулярным соединением с величиной кажущейся молекулярной массы 0,46 кДа . В этой работе было показано, что в спектре поглощения водного образца изучаемого компонента наблюдаются два основных пика при 205 нм и 260 нм и плечо при 350–370 нм. При этом было установлено, что активатор грибного свечения обладает синей флуоресценцией с максимумом световой эмиссии при 440 нм после возбуждения длинами волн 350–370 нм, является термостабильным соединением и сохраняет флуоресцентные характеристики после обработки при 100°С в течение 5 мин. Исходя из полученных данных, представляло научно-практический интерес и значимость исследование потенциальной применимости обнаруженного флуорофора с эмиссией света в синей области спектра в качестве новой флуоресцентной метки для молекулярной и клеточной биологии.
Целью данной работы было: оценить квантовый выход флуоресценции обнаруженного флуорофора из N. nambi в водной среде; изучить возможность связывания данного флуорофора с некоторыми объектами биологической и небиологической природы; оценить интенсивность световой эмиссии этих объектов с адсорбированным флуорофором.
2. Материалы и методы исследований
В исследованиях использовали водные экстракты из светящегося базидиомицета N. nambi IBSO 2391 (Коллекция микроорганизмов CCIBSO 836 Института биофизики ФИЦ КНЦ СО РАН, Красноярск), содержащие флуоресцирующий в синей области спектра внеклеточный грибной компонент. Для экспериментов в качестве модельных адсорбентов биологической природы с разным уровнем структурно-морфологической организации использовали бычий сывороточный альбумин — БСА (Serva, Германия) и клетки пекарских дрожжей Saccharomyces cerevisiae марки Саф-Момент (САФ-Нева, Россия). В качестве модельных адсорбентов небиологической природы были использованы диэтиламиноэтил-(DEAE)-целлюлоза (Serva, Германия), диэтил-(2-гидрокси-пропил)-аминоэтил-(QAE)-сефадекс (Pharmacia, Швеция) и оксигидроксид алюминия (бёмит — γ-AlO(OH)) (производитель — Korea Atomic Energy Research Institute, Республика Корея). Выбор DEAE-целлюлозы и QAE-сефадекса был вызван их широким применением в качестве эффективных сорбентов для ионообменной хроматографии . Оксигидроксид алюминия (бёмит) был выбран для исследований, благодаря его высоким адсорбционным свойствам , .
Изучение спектральных и флуоресцентных свойств водных образцов, содержащих изучаемый флуорофор, проводили на спектрофотометре UV-1800 (Shimadzu, Япония) и спектрофлуориметре Varian Cary Eclipse (Agilent Technologies, США).
Во всех экспериментах использовали водный раствор флуорофора с одинаковой оптической плотностью. Все измерения проводили в трех повторностях.
Квантовый выход (QY) изучаемого флуоресцирующего компонента из базидиомицета N. nambi оценивали с помощью относительного сравнительного метода с использованием эталонного вещества с известной величиной квантового выхода и оптическими характеристиками, близко соответствующими изучаемому соединению. В качестве эталонного вещества в работе использовали НАДН (Serva, Германия) (QY = 0,02 в воде при λex = 340 нм ). Квантовый выход флуоресценции изучаемого компонента из гриба N. nambi рассчитывали по формуле 1:
где n — показатель преломления растворителя, S — наклон графика зависимости интегральной интенсивности флуоресценции против поглощения, индексы s и r обозначают исследуемый образец (sample) и эталон (reference) соответственно.
Адсорбцию флуорофора на молекулы модельного белка (БСА) проводили следующим образом. К 1 мл водного раствора флуорофора добавляли 200 мкл водного раствора БСА с концентрацией 10 мг/мл, приготовленного в деионизированной (ДИ) воде (Milli-Q system, Millipore, США), после чего образец перемешивали и инкубировали 20 мин при температуре 22°С. Затем белковые молекулы с адсорбированным флуорофором осаждали добавлением в образец сульфата аммония до 60-80% насыщения и собирали образующийся белковый преципитат центрифугированием при 16000 g (Centrifuge 5415R, Eppendorf, Германия) в течение 5 мин при 4°С. Супернатант отбирали для оценки количества не связавшегося с белком флуорофора. При этом белок с адсорбированным флуорофором переводили в растворенное состояние, ресуспендируя полученный белковый осадок в свежей порции ДИ воды. В образцах супернатанта и растворенного комплекса БСА-флуорофор определяли количество флуоресцирующего компонента (Varian Cary Eclipse) по интенсивности световой эмиссии при 440 нм после возбуждения длиной волны 360 нм. После этого образец растворенного в воде комплекса БСА-флуорофор подвергали термической обработке при 100°С в течение 5 мин и затем удаляли денатурировавший белок центрифугированием при указанных выше условиях. В полученном супернатанте вновь определяли количество флуорофора по интенсивности флуоресценции.
Для визуализации световой эмиссии флуорофора на живых клетках использовали пекарские дрожжи S. cerevisiae. К порошку дрожжей S. cerevisiae добавляли 50 мМ фосфатный буфер (pH 6,0), образец перемешивали и инкубировали при температуре 25°С в течение 30 мин для перевода клеток в жизнеспособное состояние. После этого клетки собирали центрифугированием при 5000 g (Centrifuge 5415R) в течение 5 мин при 22°С. Полученный супернатант удаляли, а осадок клеток ресуспендировали в ДИ воде. Полученную клеточную суспензию доводили ДИ водой до оптической плотности 0,6 опт. ед. при λ = 600 нм. Аликвоту дрожжевой суспензии смешивали с водным раствором флуорофора в объемном соотношении 5:1. Полученную смесь инкубировали при 25°С в течение 20 мин, после чего клетки вновь собирали центрифугированием как указано выше. Супернатант удаляли, а образовавшийся осадок клеток дважды промывали ДИ водой для более полного удаления флуорофора, не адсорбированного дрожжевыми клетками. Для этого клеточный осадок каждый раз ресуспендировали в новой порции ДИ воды и собирали центрифугированием при указанных выше условиях. Отмытые клетки ресуспендировали в небольшом (50 мкл) объеме ДИ воды и 10 мкл полученной суспензии наносили на предметное стекло для микроскопирования.
Адсорбцию флуорофора на сорбенты небиологической природы проводили следующим способом. К порошкам DEAE-целлюлозы и QAE-сефадекса добавляли ДИ воду, после чего перемешивали и инкубировали полученные смеси при температуре 22°С в течение 24 ч для набухания гранул. Поскольку частицы бёмита (γ-AlO(OH)) не требуют аналогичной подготовки, для экспериментов гидрозоль этого сорбента готовили добавлением ДИ воды к сухому порошку и перемешиванием смеси до однородной суспензии. Аликвоты водных суспензий частиц DEAE-целлюлозы, гранул QAE-сефадекса (концентрации сорбентов 1 мг/мл) и гидрозоля частиц бёмита (концентрация сорбента 10 мг/мл) смешивали с аликвотами водного раствора флуорофора в объемном соотношении 5:1 (суспензия сорбента: раствор флуорофора) и инкубировали 20 мин при 25°С. Затем гранулы и частицы сорбентов собирали центрифугированием образцов при 3000 g (Centrifuge 5415R) в течение 5 мин при 4°С. В образцах супернатантов определяли количество флуоресцирующего компонента (Varian Cary Eclipse) по интенсивности световой эмиссии при 440 нм после возбуждения длиной волны 360 нм. Полученные осадки дважды промывали ДИ водой для удаления не связавшихся с адсорбентами молекул флуорофора. Для этого осадки гранул и частиц с адсорбированным флуоресцирующим компонентом каждый раз ресуспендировали в новой порции ДИ воды и собирали центрифугированием при указанных выше условиях. Осадки отмытых сорбентов ресуспендировали в небольших (по 50 мкл) объемах ДИ воды и по 10 мкл полученных суспензий наносили на предметные стекла для микроскопирования.
Все препараты, полученные в ходе изложенных выше экспериментов, просматривали на световом микроскопе Axio Imager M2 (Carl Zeiss, Германия) в светлом поле и в режиме флуоресценции с набором фильтров 49 (365 nm excitation filter, 445–450 nm emission filter), объективами N-Achroplan 10x/0,25 M27 и Plan-Neofluar 100/1,30 Oil M27.
Статистическая обработка данных по интенсивности свечения флуорофора при микроскопировании препаратов была выполнена с помощью программы ZEN 2012 (blueedition) (CarlZeiss, Германия). Интенсивность флуоресценции рассчитывали на единицу площади носителя (мкм2) за 1 сек. Измерения проводили в пяти повторностях.
3. Результаты и обсуждение
Известно, что квантовый выход флуоресценции является одной из важнейших фотофизических характеристик вещества, обладающего флуоресцентными свойствами , . В наших исследованиях квантовый выход световой эмиссии флуоресцирующего в синей области спектра компонента из базидиомицета N. nambi мы определяли в сравнении с НАДН. Этот восстановленный пиридиновый нуклеотид был выбран нами в качестве эталона сравнения, поскольку он так же, как и изучаемый грибной флуорофор, излучает свет в синей области спектра и для него известна величина абсолютного квантового выхода . При этом нужно заметить следующее. Хотя у НАДН и грибного флуорофора длины волн возбуждения (335 нм и 350-370 нм соответственно) и максимумы световой эмиссии (465 нм и 440 нм соответственно) имеют различия, тем не менее, спектры флуоресценции обоих соединений в значительной степени перекрываются (рис. 1). Как показали расчеты, проведенные на основании полученных нами калибровочных зависимостей интегральной флуоресценции от величины поглощения для водных растворов обоих соединений (рис. 1), относительный квантовый выход световой эмиссии флуорофора из базидиального гриба N. nambi составил 0,04.
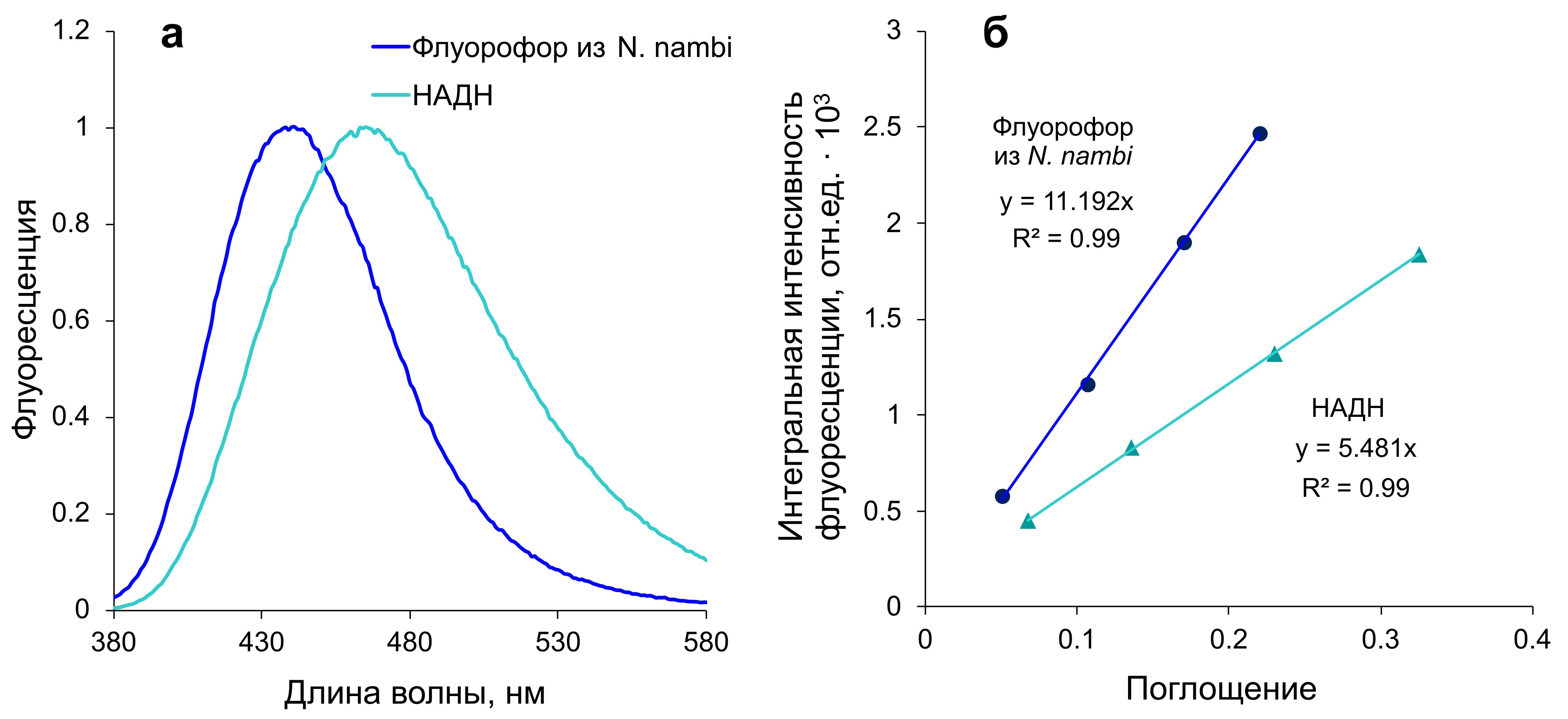
Рисунок 1 - Спектры флуоресценции (а) и зависимости интегральной интенсивности флуоресценции от величины поглощения (б) водных растворов НАДН и флуоресцирующего компонента из базидиомицета N. nambi
Примечание: в спектрах флуоресценции значения нормированы на соответствующие максимальные уровни световой эмиссии

Рисунок 2 - Внешний вид (столбец 1) и флуоресценция (столбец 2) разных типов носителей с адсорбированным синим флуорофором из базидиомицета N. nambi:
а, б – DEAE-целлюлоза; в, г – QAE-сефадекс; д, е – бёмит (γ-AlO(OH)); ж, з – клетки дрожжей S. cerevisiae
Примечание: масштабная риска на изображениях «а - е» - 100 мкм, «ж,з» - 10 мкм
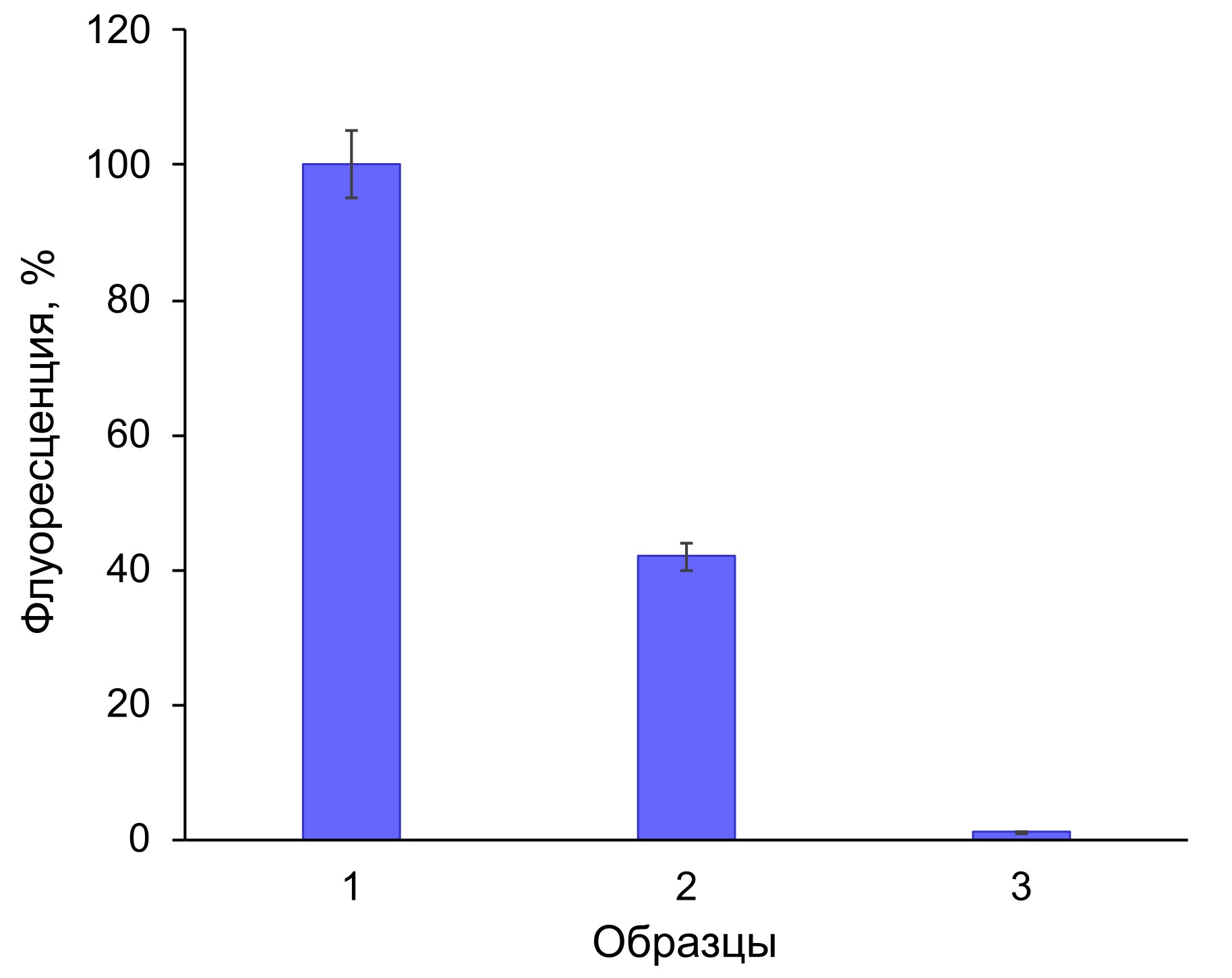
Рисунок 3 - Интенсивность флуоресценции, отражающая эффективность и прочность связывания флуоресцирующего компонента из гриба N. nambi на частицах DEAE-целлюлозы:
1 – исходный раствор флуорофора; 2 – супернатант после инкубации флуорофора с частицами сорбента и последующего их осаждения центрифугированием; 3 – супернатант после промывки частиц носителя ДИ водой и последующего их осаждения центрифугированием
Примечание: за 100% принят уровень световой эмиссии исходного раствора флуорофора
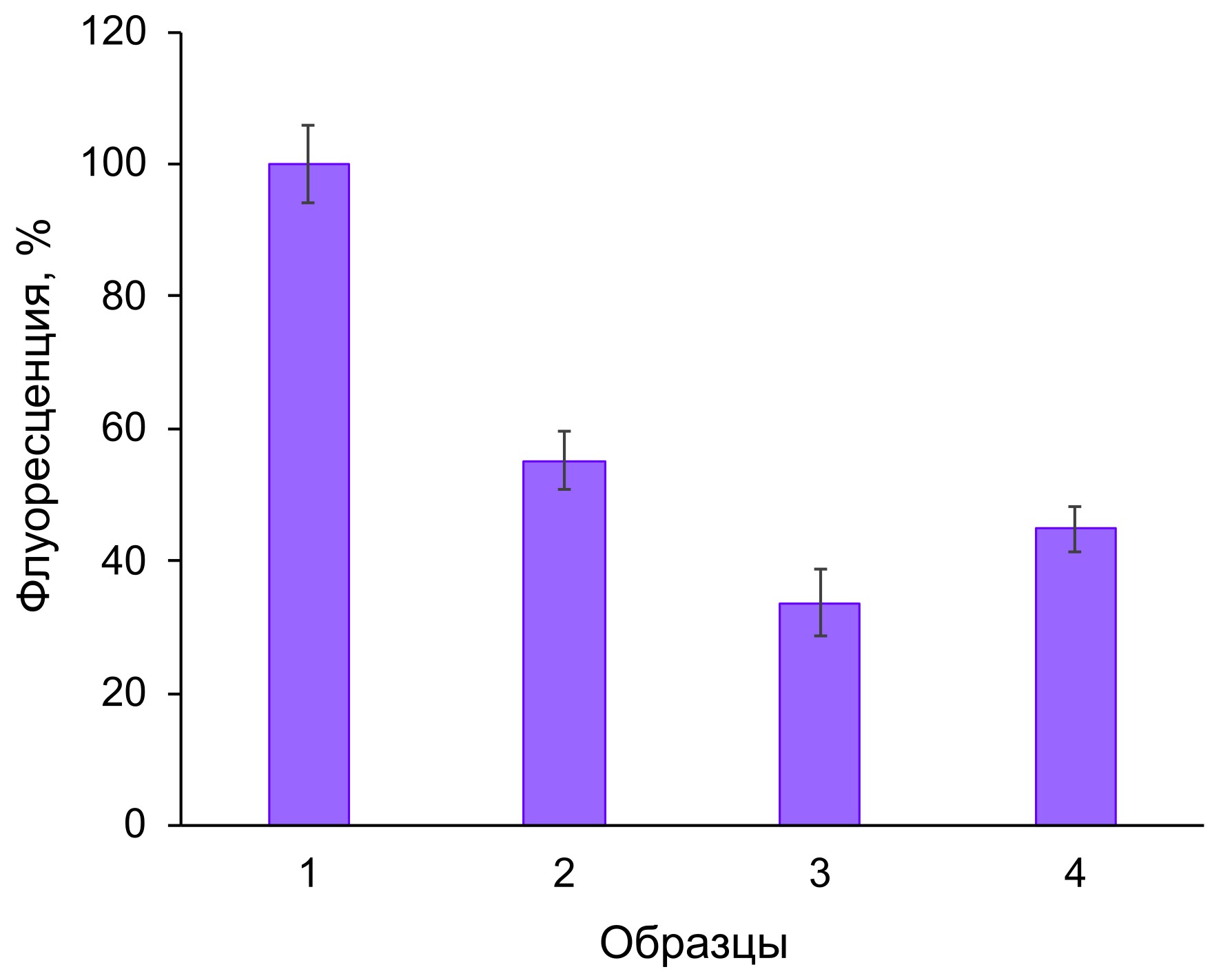
Рисунок 4 - Интенсивность флуоресценции, отражающая эффективность адсорбции флуорофора из базидиомицета N. nambi на модельном белке БСА:
1 – исходный раствор флуорофора; 2 – супернатант после смешивания растворов флуорофора и модельного белка с последующим его осаждением сульфатом аммония и удалением центрифугированием; 3 – раствор комплекса БСА-флуорофор; 4 – супернатант после обработки комплекса БСА-флуорофор при 100°С в течение 5 мин и последующего удаления денатурировавшего белка центрифугированием
Примечание: за 100% принят уровень световой эмиссии исходного раствора флуорофора
В целом, результаты статистического анализа данных, полученных при изучении адсорбции изучаемого грибного флуорофора на разных объектах (сорбентах) биологической и не биологической природы, суммированы в таблице. Как следует из представленных результатов, во всех исследованных в работе случаях были выявлены различия в уровнях флуоресценции между контрольными и опытными образцами сорбентов, которые отражают эффективность связывания ими флуоресцирующего компонента из базидиомицета N. nambi. При этом видно, что после инкубации с флуорофором наибольшим уровнем флуоресценции в синей области спектра обладали: БСА, частицы DEAE-целлюлозы и гранулы QAE-сефадекса — по сравнению с контролем, прирост интенсивности их флуоресценции составил более чем в 50, 35 и 10 раз соответственно. В то же время, адсорбция флуорофора на клетки дрожжей S. cerevisiae и частицы бёмита сопровождалась существенно меньшим увеличением интенсивности их флуоресценции — примерно в 2–2,5 и 2,5–3 раза соответственно.
Таблица 1 - Интенсивность световой эмиссии носителей разных типов в синей области спектра до (Контроль) и после (Опыт) инкубации с флуорофором из базидиомицета N. nambi
Носитель (сорбент) | Контроль (отн. ед.) | Опыт (отн. ед.) |
DEAE-целлюлоза | 28,2 ± 0,56 | 999,2 ± 70,7 |
QAE-сефадекс | 8,17 ± 1,56 | 83,8 ± 5,7 |
Бёмит (γ-AlO(OH)) | 2,45 ± 0,27 | 6,55 ± 0,24 |
Белок БСА | 6,0 ± 0,80 | 340,0 ± 20,8 |
Дрожжи S. cerevisiae | 6,17 ± 0,38 | 13,70 ± 1,05 |
4. Заключение
Совокупность полученных данных свидетельствует о том, что низкомолекулярный термостабильный флуорофор, выделенный из базидиомицета N. nambi и излучающий свет в синей области спектра, адсорбируется на разных объектах биологической и небиологической природы (белковые молекулы, живые клетки, разные типы сорбентов) и проявляет свои флуоресцентные свойства после связывания с носителями. После адсорбции флуорофора наибольшим уровнем флуоресценции в синей области спектра обладали: БСА, частицы DEAE-целлюлозы и гранулы QAE-сефадекса — по сравнению с контролем, прирост интенсивности их флуоресценции составил более чем в 50, 35 и 10 раз соответственно. Изучаемый флуорофор имеет квантовый выход 0,04, уровень которого достаточен для визуализации объектов и образцов в режиме флуоресценции при микроскопировании. При этом следует сказать, что природные флуорофоры, характеризуясь отсутствием токсичности для живых клеток, зачастую имеют невысокий квантовый выход , , . Однако это не является препятствием для создания на их основе новых флуоресцентных маркеров с улучшенными свойствами с помощью химических модификаций , , .
В целом, результаты проведенных исследований открывают перспективы дальнейшего изучения применимости флуорофора из базидиального гриба N. nambi с эмиссией в синей области спектра в качестве нового флуоресцентного маркера для аналитических приложений.
