A PREDICTION OF THE ADSORPTION OF LECITHIN ON THE SURFACE OF SOLID PARTICLES OF PIROXICAM IN AN AQUEOUS MEDIUM
ПРОГНОЗИРОВАНИЕ АДСОРБЦИИ ЛЕЦИТИНА НА ПОВЕРХНОСТИ ТВЕРДЫХ ЧАСТИЦ ПИРОКСИКАМА В ВОДНОЙ СРЕДЕ
Научная статья
Илькевич Е.В.1, *, Степанова Э.Ф.2, Глушко А.А.3, Верниковский В.В.4
1-4 Пятигорский медико-фармацевтический институт –филиал ВолгГМУ Минздрава России, Пятигорск, Россия
* Корреспондирующий автор (5865[at]bk.ru)
АннотацияПри помощи компьютерного прогнозирования была изучена адсорбция лецитина на поверхности твёрдых частиц пироксикама в водной среде. В исследовании был использован метод молекулярной динамики в силовом поле Charmm36 [17, С. 7830-7843] с использованием программы Gromacs 2019 [7, С. 19-25] [5, С. 1190-1208]. При осуществлении сборки моделируемых систем в качестве анализируемого фосфолипида использовали 1,2-дилинолеоил-sn-глицеро-3-фосфохолин (ФХ). ФХ адсорбируется на поверхности пироксикама. Поверхностный избыток ФХ близкий к предельному достигается при равновесной концентрации больше 1,0184±0,57 моль/м3. При концентрации ФХ больше 1,0184±0,57 моль/м3 наблюдается значительная агрегация молекул фосфолипида. Предельный поверхностный избыток ФХ на поверхности пироксикама по результатам моделирования молекулярной динамики составляет 7,1117·10-8 ± 0,4724·10-8 моль/м2. Для наглядного подтверждения результатов проведенного компьютерного моделирования адсорбции фосфатидилхолина на поверхности частиц пироксикама, был проведен анализ образцов систем «лецитин-вода» и «пироксикам-лецитин-вода» методом оптической микроскопии. Микроскопия исследуемых образцов подтверждает адсорбцию лецитина на частицах пироксикама.
Ключевые слова: пироксикам, лецитин, суспензия, фосфатидилхолин, адсорбция.
A PREDICTION OF THE ADSORPTION OF LECITHIN ON THE SURFACE OF SOLID PARTICLES OF PIROXICAM IN AN AQUEOUS MEDIUM
Research article
Ilkevich E.V.1, *, Stepanova E.F.2, Glushko A.A.3, Vernikovsky V.V.4
1-4 Pyatigorsk Medical and Pharmaceutical Institute, branch of the Volgograd State Medical University, Pyatigorsk, Russia
* Corresponding author (5865[at]bk.ru)
AbstractThe current article contains a study of the adsorption of lecithin on the surface of solid particles of piroxicam in an aqueous medium using computer prediction. The study used the method of molecular dynamics in the Charmm36 force field [17, p. 7830-7843] using Gromacs 2019 [7, P. 19-25] [5, P. 1190-1208]. When assembling the simulated systems, the research used 1,2-dilinoleoyl-sn-glycero-3-phosphocholine (PC) as the analyzed phospholipid, which is adsorbed on the surface of piroxicam. The surface excess of PC close to the limit is achieved at an equilibrium concentration greater than 1.0184±0.57 mol / m3. At a concentration of PC greater than 1.0184±0.57 mol/m3, a significant aggregation of phospholipid molecules is observed. The limiting surface excess of PC on the surface of piroxicam according to the results of molecular dynamics modeling is 7.1117 * 10-8 ± 0.4724·10-8 mol / m2. To visually confirm the results of computer simulation of phosphatidylcholine adsorption on the surface of piroxicam particles, samples of the "lecithin-water" and "piroxicam-lecithin-water" systems were analyzed via optical microscopy. Microscopy of the samples under study confirms the adsorption of lecithin on the piroxicam particles.
Keywords: piroxicam, lecithin, suspension, phosphatidylcholine, adsorption.
ВведениеВсе больше внимания уделяется лекарственным формам, способным обеспечивать улучшенную безопасность применения при сохранении эффективности лечения [15, С. 2415–2437]. Разработка жидкой лекарственной формы с улучшенным профилем безопасности актуальна и для пироксикама – лекарственного средства с доказанной эффективностью, имеющего достаточный опыт применения и характеризующегося рядом класс-специфичных побочных эффектов, в том числе и негативным местным, помимо системного, влиянием на слизистую желудочно-кишечного тракта [2], [14, C. 199-474]. Пироксикам относится к гидрофобным веществам. Одним из способов солюбилизации гидрофобных лекарственных средств является добавление ПАВ, среди которых все большее внимание уделяется веществам природного происхождения. К ним можно отнести лецитин – достаточно известный и широко используемый, как в фармацевтической, так и в пищевой промышленности компонент [13, С. 84]. Лецитин характеризуется хорошей биосовместимостью, а также безопасностью применения, что отмечается в публикациях различных авторов по всему миру [9, С. 1041-1051], [13, С. 84] На сегодняшний день доказана протективная роль лецитина в предупреждении повреждения верхних и нижних отделов ЖКТ у людей принимающих гастротоксичные препараты, включая нестероидные противовоспалительные препараты (НПВП) [8, С. 171-177], [16, С. 11460-11464]. В связи с этим имело смысл рассмотреть лецитин в качестве вспомогательного компонента при разработке суспензии пироксикама. При проведении исследований использовался лецитин подсолнечника, содержащий больше полиненасыщенных жирных кислот чем соевый лецитин и выделение которого требует меньшей температурной обработки [3, С. 123-133].
В зарубежных источниках литературы содержатся сведения, что в суспензионных препаратах для человека лецитин обычно используется при уровне включения в диапазоне 0,25–10% [13, C. 84].
Для выбора оптимальной концентрации лецитина при разработке суспензии пироксикама была изучена его адсорбция на поверхности твёрдых частиц пироксикама в водной среде методом молекулярной динамики.
Методы и принципы исследования
В исследовании был использован метод молекулярной динамики в силовом поле Charmm36 [17, С. 7830-7843] с использованием программы Gromacs 2019 [7, С. 19-25], [5, С. 1190-1208].
Для моделирования молекулярной динамики были использованы периодические граничные условия по трём осям координат и собраны двухфазные системы «пироксикам-вода». Параметризация молекул, входящих в состав моделируемой системы, производилась с использованием сервиса Swiss Param [6, С. 2359-2368]. Оптимизация геометрии производилась для собранной системы градиентным методом [7, С. 19-25], [5, С. 1190-1208]. Далее проводилось термодинамическое уравновешивание систем и моделирование молекулярной динамики с исползованием термостатирования (термостат Нозе-Гувера [4, С. 134], 298 К) и баростатирования (изотропный баростат Парринелло-Рамана [12, C. 7180-7182], 1 бар) с шагом моделирования 2 фс в течение 50 нс.
При осуществлении сборки моделируемых систем в качестве анализируемого фосфолипида использовали 1,2-дилинолеоил-sn- глицеро-3-фосфохолин (ФХ), поскольку он преобладает (64,3%) среди основных компонентов лецитина подсолнечника – фосфолипидов группы фосфатидилхолина [10, C. 714-720].
Таким образом, в состав моделируемой системы были включены молекулы пироксикама в форме цвиттер-иона и катиона, молекулы 1,2-дилинолеоил-sn- глицеро-3-фосфохолин, ионы Cl- и молекулы воды. Молекулярные составы моделируемых систем приведены в таблице 1.
Таблица 1 – Количества молекул компонентов моделируемых систем
| Вещество | Состав 1 (Массовая доля ФХ в воде 0,25%) | Состав 2 (Массовая доля ФХ 0,5%) | Состав 3 (Массовая доля ФХ 0,75%) | Состав 4 (Массовая доля ФХ 1,0%) |
| Пироксикам в форме цвиттер-иона | 1178 | 1178 | 1178 | 1178 |
| Пироксикам – катион | 31 | 31 | 31 | 31 |
| ФХ | 7 | 13 | 20 | 28 |
| Ион Cl- | 31 | 31 | 31 | 31 |
| Вода | 113026 | 112656 | 112380 | 112124 |
По результатам моделирования молекулярной динамики рассчитывались количества молекул ФХ, адсорбировавшихся на поверхности пироксикама. В качестве критерия связывания молекулы ФХ с поверхностью был использован порог расстояния 1 нм от центра масс молекулы ФХ до центра масс любой из молекул поверхности пироксикама. Далее рассчитывались средние значения полученных параметров и их стандартные отклонения. Количества не адсорбировавшихся молекул ФХ, находящихся в воде были рассчитаны по разнице между общим числом молекул фосфолипида в моделируемой системе и числом адсорбировавшихся молекул. Полученные данные далее были использованы для расчета равновесной молярной концентрации ФХ в воде (моль/м3) и поверхностного избытка ФХ на поверхности пироксикама (моль/м2). Для аппроксимации зависимости поверхностного избытка от равновесной концентрации для фосфолипида было использовано уравнение Ленгмюра. Константы уравнения Ленгмюра [1] определяли с использованием полученных значений поверхностного избытка и равновесной концентрации:
где: Г – поверхностный избыток, моль/м2,
С – равновесная молярная концентрация адсорбтива, моль/м3,
Г∞ - предельный поверхностный избыток, моль/ м2,
b – концентрация адсорбтива, при которой достигается половина предельного поверхностного избытка, моль/м3.
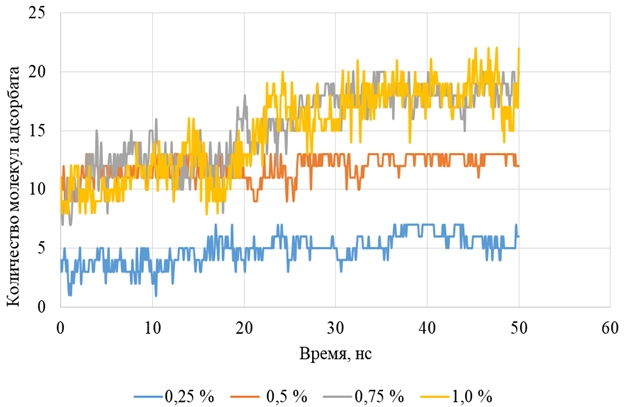
Основные результатыВ процессе моделирования молекулярной динамики при всех четырех начальных концентрациях, и в особенности при концентрациях 0,75 – 1,0 % наблюдается связывание молекул ФХ с молекулами пироксикама как в форме цвиттер-иона, так и в форме катиона. Графики зависимости количества адсорбированных молекул ФХ от времени приведены на рисунке 1.
Рис. 1 – Динамика изменения количества адсорбированных молекул ФХ
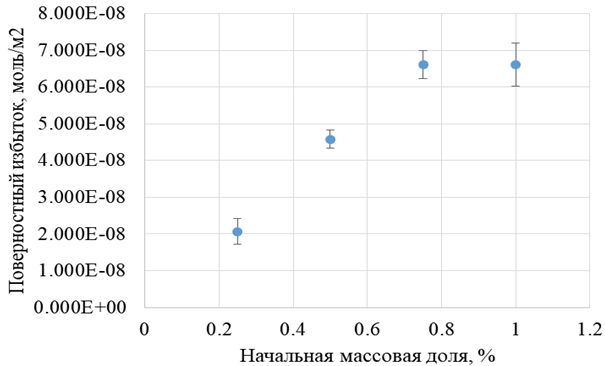
Как видно из рисунка, по изменению числа адсорбировавшихся молекул ФХ можно сделать вывод о том, что для всех четырех исследуемых концентраций фосфолипида адсорбционное равновесие наступает после 30 нс времени эволюции системы. Исходя из этого, расчет средних значений и стандартных отклонений числа молекул ФХ, связанных с поверхностью, числа молекул фосфолипида в растворителе, поверхностного избытка и равновесной концентрации производился для периода времени 30 – 50 нс. По результатам расчета поверхностного избытка видно, что насыщение адсорбции фосфатидилхолина на поверхности пироксикама в моделируемой системе происходит при начальных концентрациях от 0,75 % (рисунок 2).
Рис. 2 – Зависимость равновесного поверхностного избытка фосфатидилхолина от его начальной массовой доли
С целью определения эффективности адсорбции ФХ на поверхности пироксикама, методом наименьших квадратов были рассчитаны константы уравнения Ленгмюра Г∞ и b, представленые в таблице 2.
Таблица 2 – Константы уравнения Ленгмюра для расчета поверхностного избытка фосфатидилхолина на поверхности пироксикама по результатам моделирования молекулярной динамики
| Г∞, моль/м2 | b, моль/м3 |
| 7,1117·10-8± 0,4724·10-8 | 0,1434 ± 0,1140 |
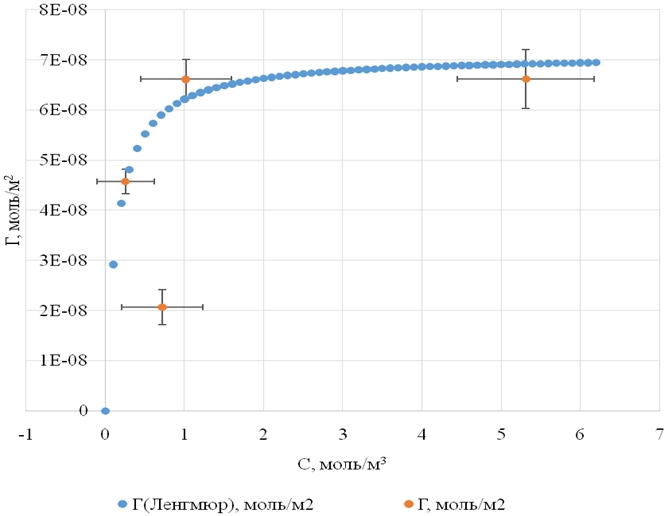
Полученные константы позволяют использовать уравнение Ленгмюра для расчета поверхностного избытка ФХ на поверхности пироксикама. Результаты аппроксимации зависимости поверхностного избытка от равновесной концентрации для ФХ с использованием уравнения Ленгмюра представлены на рисунке 3.
Рис. 3 – Зависимость поверхностного избытка фосфатидилхолина от его равновесной концентрации по данным молекулярной динамики (Г, уравнение Ленгмюра)
По результатам моделирования адсорбции ФХ на поверхности твёрдых частиц пироксикама в водной среде, можно сделать вывод, что ФХ адсорбируется на поверхности пироксикама. Поверхностный избыток ФХ близкий к предельному достигается при равновесной концентрации больше 1,0184±0,57 моль/м3. При концентрации ФХ больше 1,0184±0,57 моль/м3 наблюдается значительная агрегация молекул фосфолипида. Предельный поверхностный избыток ФХ на поверхности пироксикама по результатам моделирования молекулярной динамики составляет 7,1117·10-8 ± 0,4724·10-8 моль/м2.
ЗаключениеВысокое сродство фосфолипипидов к НПВП, отмеченное в литературных источниках [11, C. 994-1002], характерно и для пироксикама, что рассмотрено на примере 1,2-дилинолеоил-sn-глицеро-3-фосфохолина – одного из основных компонентов фосфотидилхолина лецитина подсолнечника. Полученные сведения были использованы для дальнейшего выбора оптимальной концентрации лецитина в каччестве вспомогательного компонента.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Введение в физику поверхности / под ред. В. И. Сергиенко – М.: Наука, 2006. — 490 с.
- Государственный реестр лекарственных средств. – М., 2020. – [Электронный ресурс]. URL: http://grls.rosminzdrav.ru. (дата обращения: 01.09.2020)
- Дзяк Г.В. Современные представления о биологических свойствах лецитина (лекция для врачей) / Г.В. Дзяк и др. // Медичні перспективи. – 2010. – Т. 15, № 2. – С. 123 – 133.
- Braga, C. A configurational temperature Nosé-Hoover thermostat / C. Braga, K.P. Travis // The J. of Chemical Physics. – 2005. – Vol. 123, № 13 – 134.
- Byrd, R.H. A limited memory algorithm for bound constrained optimization / R.H. Byrd, P. Lu, J. Nocedal // SIAM J. Scientif. Statistic. Comput. –1995 – Vol. 16 – 1190–1208.
- Fast Force Field Generation Tool For Small Organic Molecules / V. Zoete et al. // SwissParam. – 2011. – 32(11). – P. 2359–2368.
- Gromacs: High performance molecular simulations through multi-level parallelism from laptops to supercomputers / M.J. Abraham et al. // Software X. – 2015. – Vol. 1-2. – P. 19-25.
- In vitro and in vivo protection against indomethacin-induced small intestinal injury by proton pump inhibitors, acid pump antagonists, or indomethacin-phosphatidylcholine / Y.J. Lim et al. // Digestion. –2012. – Vol. 86(2) – P. 171–177.
- Karner, M. First multicenter study of modified release phosphatidylcholine «LT-02» in ulcerative colitis: a randomized, placebo-controlled trial in mesalazine-refractory courses / M. Karner, A. Kocjan, J. Stein // Am J Gastroenterol. – – Vil. 109, № 7. – P. 1041–1051.
- Lecithin in mixed micelles attenuates the cytotoxicity of bile salts in Caco-2 cells / Y. Tan et al. // Toxicol In Vitro. – 2013 – Vol. 27(2). – 714 – 720.
- Lichtenberger, L.M. Insight into NSAID-induced membrane alterations, pathogenesis and therapeutics: characterization of interaction of NSAIDs with phosphatidylcholine / L.M. Lichtenberger, Y. Zhou, V. Jayaraman // Biochim. Biophys. Acta. – 2012. – Vol. 1821 (7) – P. 994-1002.
- Parrinello M. Polymorphic transitions in single crystals: A new molecular dynamics method / M. Parrinello, A. Rahman // J. Appl. Phys. – – Vol. 52 – P. 7180–7182.
- Pharmaceutical suspensions: From formulation development to manufacturing / Ed. by A.K. Kulshreshtha, O.N. Singh, G.M. Wall. – Heidelberg, 2010. – 328 p.
- Piroxicam / A.E.M. Gamal, A.S. Al-Dosseri, A.A. Al-Badr // Profiles Drug Subst Excip Relat Methodol. – 2020. – Vol. 45. – P. 199-474.
- Scarpignato, C. Piroxicam-β-cyclodextrin: a GI safer piroxicam / C. Scarpignato // Current medicinal chemistry. – – Vol. 20,19 – P. 2415–2437.
- Sterically stabilized liposomes: improvements in pharmacokinetics and antitumor therapeutic efficacy / D. Papahadjopoulos et al. // Proc Natl Acad Sci U S A. – 1991. – Vol. 88. – 11460–11464.
- Update of the CHARMM All-Atom Additive Force Field for Lipids: Validation on Six Lipid Types/ J.B. Klauda et al. // J. of Physical Chemistry B. – – Vol. 114. – P. 7830–7843.
Список литературы на английском языке / References in English
- Vvedenie v fiziku poverhnosti [Introduction to Surface Physics] / edited by V. I. Sergienko – M.: Nauka, 2006. — 490 p. [in Russian]
- Gosudarstvennyj reestr lekarstvennyh sredstv [State Register of Medicines] [Electronic resource]. – M., 2020. – URL: http://grls.rosminzdrav.ru. (accessed:01.09.2020). [in Russian]
- Dzjak G.V. Sovremennye predstavlenija o biologicheskih svojstvah lecitina (lekcija dlja vrachej) [Modern ideas about the biological properties of lecithin (lecture for doctors)] / G.V. Dzjak, A.L. Drozdov, S.M. Shul'ga et al. // Medichnі perspektivi [Medical prospects]. – 2010. – Vol. 15, № 2. – P. 123 – 133. [in Russian]
- Braga, C. A configurational temperature Nosé-Hoover thermostat / C. Braga, K.P. Travis // The J. of Chemical Physics. – 2005. – Vol. 123, № 13 – 134.
- Byrd, R.H. A limited memory algorithm for bound constrained optimization / R.H. Byrd, P. Lu, J. Nocedal // SIAM J. Scientif. Statistic. Comput. –1995 – Vol. 16 – 1190–1208.
- Fast Force Field Generation Tool For Small Organic Molecules / V. Zoete et al. // SwissParam. – 2011. – 32(11). – P. 2359–2368.
- Gromacs: High performance molecular simulations through multi-level parallelism from laptops to supercomputers / M.J. Abraham et al. // Software X. – 2015. – Vol. 1-2. – P. 19-25.
- In vitro and in vivo protection against indomethacin-induced small intestinal injury by proton pump inhibitors, acid pump antagonists, or indomethacin-phosphatidylcholine / Y.J. Lim et al. // Digestion. –2012. – Vol. 86(2) – P. 171–177.
- Karner, M. First multicenter study of modified release phosphatidylcholine «LT-02» in ulcerative colitis: a randomized, placebo-controlled trial in mesalazine-refractory courses / M. Karner, A. Kocjan, J. Stein // Am J Gastroenterol. – – Vil. 109, № 7. – P. 1041–1051.
- Lecithin in mixed micelles attenuates the cytotoxicity of bile salts in Caco-2 cells / Y. Tan et al. // Toxicol In Vitro. – 2013 – Vol. 27(2). – 714 – 720.
- Lichtenberger, L.M. Insight into NSAID-induced membrane alterations, pathogenesis and therapeutics: characterization of interaction of NSAIDs with phosphatidylcholine / L.M. Lichtenberger, Y. Zhou, V. Jayaraman // Biochim. Biophys. Acta. – 2012. – Vol. 1821 (7) – P. 994-1002.
- Parrinello M. Polymorphic transitions in single crystals: A new molecular dynamics method / M. Parrinello, Rahman // J. Appl. Phys. –1981. – Vol. 52 – P. 7180–7182.
- Pharmaceutical suspensions: From formulation development to manufacturing / Ed. by A.K. Kulshreshtha, O.N. Singh, G.M. Wall. – Heidelberg, 2010. – 328 p.
- Piroxicam / A.E.M. Gamal, A.S. Al-Dosseri, A.A. Al-Badr // Profiles Drug Subst Excip Relat Methodol. – 2020. – Vol. 45. – P. 199-474.
- Scarpignato, C. Piroxicam-β-cyclodextrin: a GI safer piroxicam / C. Scarpignato // Current medicinal chemistry. – – Vol. 20,19 – P. 2415–2437.
- Sterically stabilized liposomes: improvements in pharmacokinetics and antitumor therapeutic efficacy / Papahadjopoulos et al. // Proc Natl Acad Sci U S A. – 1991. – Vol. 88. – P. 11460–11464.
- Update of the CHARMM All-Atom Additive Force Field for Lipids: Validation on Six Lipid Types/ J.B. Klauda et al. // J. of Physical Chemistry B. – – Vol. 114. – P. 7830–7843.