ADVANTAGES OF SALIVA DIAGNOSTICS IN WOMEN OF REPRODUCTIVE AGE WITH HYPERANDROGENISM USING DEHYDROEPIANDROSTERONE
ПРЕИМУЩЕСТВА САЛИВАДИАГНОСТИКИ У ЖЕНЩИН РЕПРОДУКТИВНОГО ВОЗРАСТА С ГИПЕРАНДРОГЕНИЕЙ НА ПРИМЕРЕ ДЕГИДРОЭПИАНДРОСТЕРОНА
Научная статья
Коваль М.В.1, Царегородцева А.А.2, *
1 ORCID: 0000-0003-13218-6583;
2 ORCID: 0000-0003-1696-0543;
1, 2 Уральский государственный медицинский университет, Екатеринбург, Россия
* Корреспондирующий автор (anya.tsaregorodtseva[at]mail.ru)
АннотацияВ данной статье представлено исследование чувствительности и специфичности диагностики дегидроэпиандростерона (ДЭГА) в слюне в сравнении с сывороткой крови у женщин репродуктивного возраста с гиперандрогенией. Саливадиагностика стероидных гормонов методом жидкостной хроматографии-тандемной масс-спектрометрии (ВЭЖХ-МС) представляет собой новый перспективный метод исследования в лабораторной гинекологии и эндокринологии. ВЭЖК-МС позволяет преодолеть недостатки биохимического исследования венозной крови и повысить точность диагностики гиперандрогении. Проведено одномоментное сравнительное исследование с участием женщин репродуктивного возраста с гиперандрогенией. Для подтверждения генеза гиперандрогении проведен анализ ДЭГА сыворотки крови и утренней пробы слюны методом ВЭЖК-МС. В исследовании доказано сохранение специфичности определения ДЭГА в утренней пробе слюны в сравнении с показателем ДЭГА в венозной крови, а также показана более высокая чувствительность данного метода саливадиагностики в отношении ДЭГА.
Ключевые слова: саливадиагностика, дегидроэпиандростерон, ДЭГА, гиперандрогения, жидкостная хроматография, тандемная масс-спектрометрия.
ADVANTAGES OF SALIVA DIAGNOSTICS IN WOMEN OF REPRODUCTIVE AGE WITH HYPERANDROGENISM USING DEHYDROEPIANDROSTERONE
Research article
Koval M.V.1, Tsaregorodtseva A.A.2, *
1 ORCID: 0000-0003-13218-6583;
2 ORCID: 0000-0003-1696-0543;
Ural State Medical University; Yekaterinburg, Russia
* Corresponding author (anya.tsaregorodtseva[at]mail.ru)
AbstractThe current article presents a study of the sensitivity and specificity of the diagnosis of dehydroepiandrosterone (DHEA) in saliva in comparison with blood serum in women of reproductive age with hyperandrogenism. Saliva diagnostics of steroid hormones by liquid chromatography and tandem mass spectrometry Liquid chromatography-mass spectrometry (LC-MS) is a new promising research method in laboratory gynecology and endocrinology. LC-MS allows for overcoming the shortcomings of the biochemical study of venous blood and improving the accuracy of diagnosing hyperandrogenism. The article features a single-stage comparative study involving women of reproductive age with hyperandrogenism. To confirm the genesis of hyperandrogenism, blood serum and a morning saliva sample were analyzed via LC-MS. The study proves the preservation of the specificity of identifying DHEA in the morning saliva sample in comparison with the indicator of DHEA in venous blood, and also demonstrates a higher sensitivity of this method of saliva diagnostics in relation to DHEA.
Keywords: saliva diagnostics, dehydroepiandrosterone, DEGA, hyperandrogeny, liquid chromatography, tandem mass spectrometry.
ВведениеОдним из основных маркеров диагностики гиперандрогении у женщин репродуктивного возраста является оценка уровня гормонов стероидного профиля. [6] Саливадиагностика стероидных гормонов представляет собой новый перспективный метод исследования в лабораторной гинекологии и эндокринологии [16]. Жидкостная хроматография-тандемная масс-спектрометрия (ВЭЖХ-МС) позволяет преодолеть недостатки биохимического исследования венозной крови, [1], [12], [15], [17] сохранив и даже повысив чувствительность определения гормонов. Доказана высокая прямая корреляция концентрации стероидных в слюне и в плазме крови [11], [16].
Слюна представляет собой сложный фильтрат плазмы крови, который отражает состояние динамического постоянства внутренней среды организма и является индикатором реактивности организма [1], [2], [7].
Тестирование гормонов в слюне могло бы значительно повысить устойчивость Программ здравоохранения за счет снижения затрат, преодоления практических и этических ограничений, связанных с забором крови, и, что более важно, повышения эффективности лабораторной диагностики в эндокринологии и гинекологии. Забор слюны безболезнен, может быть выполнен самостоятельно в домашних условиях без медицинского персонала и средств. Благодаря стероидной стабильности, образцы могут быть легко транспортированы из отдаленных районов в специализированные лаборатории [4], [12], [17].
Дегидроэпиандростерон (ДЭГА) является одним из вспомогательных маркеров биохимической диагностики гиперандрогенемии, который можно успешно определить в слюнном материале [8]. В исследованиях [11], [16] описана высокая корреляция ДЭГА в сыворотке крови и слюне, что можно объяснить механизмом проникновения гормона в слюну. ДЭГА попадает в слюнную жидкость путем ультрафильтрации через плотные соединения между ацинарными клетками, не претерпевая биохимических превращений [2], [14].
Кроме того, в некоторых исследованиях несульфатированный ДЭГА слюнной железы обсуждается как биомаркер, связанный со стрессом [14]. Высокая концентрация кортизола рефлекторно влияет на уровень тестостерона в крови. [9]. Гормонами-предшественниками тестостерона являются дегидроэпиандростерон и его сульфатированная форма ДЭГА-S. Предполагается, что повышение кортизола в острую стадию стресса приводит к повышению ДЭГА, что может привести к ложным результатам при проведении венепункции женщинам для забора венозной крови, в то время как забор слюны не является стрессовой ситуацией. [14]
Прямая положительная связь уровня кортизола и ДЭГА объясняет циркадные колебания концентрации ДЭГА в сыворотке крови. По данным исследований [16], [17], суточные колебания андрогенов и проандрогенов, в том числе ДЭГА, наблюдаемые в сыворотке крови, были параллельны уровням слюны, что подтверждает полезность слюнного тестирования как всего стероидного профиля, так и ДЭГА в отдельности.
Однако на сегодняшний день опубликованы единичные исследования, оценивающие чувствительность и специфичность определения ДЭГА в слюне в сравнении с сывороткой крови.
Цель исследования – определение чувствительности и специфичности диагностики ДЭГА в слюне в сравнении с определением ДЭГА в сыворотке крови у женщин репродуктивного возраста.
Методы и принципы исследования
Проведено одномоментное сравнительное исследование с участием 50 пациенток, обратившихся на амбулаторный прием к гинекологу-эндокринологу в ООО «Гранд Клиник, Екатеринбург» в 2020 году.
Критерии включения:
1) Возраст пациенток 25-35 лет;
2) Наличие жалоб на акне и/или гирсутизм;
3) Отсутствие приема гормональных препаратов;
4) Подписанная форма информированного согласия на участие в исследовании и проведение диагностического обследования.
У всех пациенток была проведена оценка жалоб, анамнеза, наличие гинекологической и соматической патологии. Проявления гирсутизма оценивали по шкале Ферримана-Голлвея, обращали внимание на наличие акне, алопеции, признаков инсулинорезистентности (нигроидный акантоз и папилломатоз), оценивали ИМТ. Для подтверждения генеза гиперандрогении проведен анализ ДЭГА сыворотки крови и утренней пробы слюны методом жидкостной хромотографии с масс-спектрометрией на 5-7 день менструального цикла.
Каждая пациентка была ознакомлена с условиями исследования (о необходимости сдачи анализа слюны и анализа крови для определения уровня ДЭГА), подписала информированное согласие на участие в исследовании и публикацию его результатов в открытой печати. Данное исследование не проходило предварительной экспертизы в этическом комитете, так как используемые диагностические методики (взятие анализа крови и слюны) входят в рутинную клиническую практику и являются безопасными.
Для анализа статистических данных использовали компьютерную программу SPSS версия 26. Качественные признаки описаны как абсолютная и относительная частота встречаемости. Для качественных признаков доверительный интервал рассчитывался для доли. Качественные признаки сравнивались между собой с помощью критерия «Хи-квадрат» с поправкой Йетса и точного критерия Фишера. Количественные данные показаны в виде среднего и стандартного отклонения. Для сравнительного анализа количественных независимых признаков использовали критерий Манна-Уитни. Диагностическую эффективность методов оценивали при помощи ROC-анализа. ROC-кривые (Receiver Operator Characteristic) показывают прямую зависимость чувствительности от доли неверно классифицированных отрицательных исходов.
Основные результаты
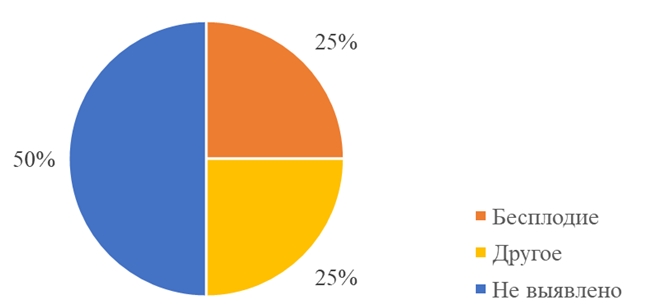
Средний возраст пациенток составил 30,4±3,8 лет. В структуре гинекологической патологии у 60% (30) женщин в течение жизни регистрировались какие-либо нарушения менструального цикла. Преобладающий тип нарушений – олиго- и аменорея. Сопутствующее бесплодие отмечено у 25% (12) пациенток. У 50% (25) пациенток не было выявлено сопутствующей гинекологической патологии (см. рисунок 1). Наши результаты согласуются с общеизвестными данными о том, что высокий уровень андрогенов у женщин ассоциирован с нарушениями менструального цикла и ановуляцией. [6]
Рис. 1 – Структура сопутствующей гинекологической патологии женщин в выборке
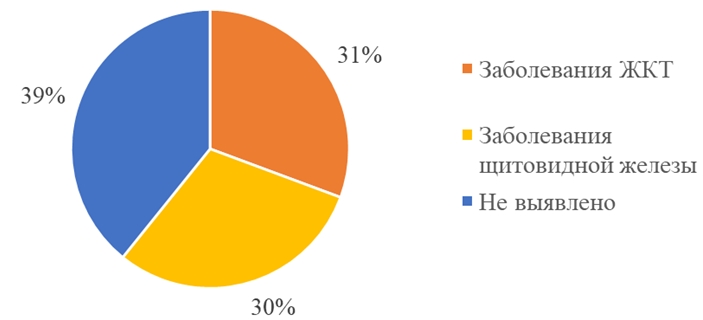
Экстрагенитальная патология была представлена заболеваниями желудочно-кишечного тракта у 30,5% (16) женщин, заболеваниями щитовидной железы у 30 % (15) пациенток (см. рисунок 2). Наши данные можно объяснить связью функции щитовидной железы и нормальной работой надпочечников [3], и участия ЖКТ в процессах метаболизма половых стероидов [5].
Рис. 2 – Структура экстрагенитальной патологии женщин в выборке
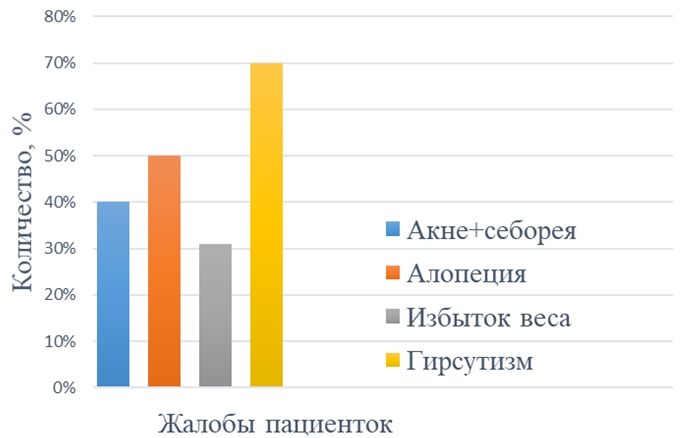
Средний бал оценки гирсутизма по шкале Ферримана-Голлвея составил 9±2,5, что характерно для слабой степени гирсутизма. Данный показатель в нашем исследовании не является объективным, поскольку большинство пациенток использовали различные методы эпиляции. Однако жалобы на избыточный рост волос на лице, передней брюшной стенке, груди и спине беспокоили 70% (35) пациенток (см. рисунок 3). Акне, сальность кожи лица, туловища и головы выявлены у 40% (20) пациенток. Жалобы на усиленное выпадение волос на голове предъявляли 50% (25) пациенток, но алопеция была диагностирована лишь у одной женщины. По данным исследований, основная роль в формировании алопеции традиционно отводится избыточному влиянию андрогенов на волосяные фолликулы, обусловленному эндокринной патологией, ассоциированной с гиперандрогенией. Андрогенная алопеция входит в симптомокомплекс гиперандрогенных дермопатий SAHA (Seborrhea — себорея, Acne — вульгарные угри, Hirsutism — гирсутизм и Alopecia — алопеция). Однако в научной литературе имеются указания на то, что гиперандрогения диагностируется менее, чем у половины женщин с алопецией. Разноречивость данных литературы может быть связана с оценкой различных фракций андрогенов и использованием для этой цели разных методов исследования роль андрогенов в ее формировании остаются до конца не выясненными [10].
Ожирение выявлено у 15% (7) пациенток, избыток массы тела у 16% (8), что является косвенным признаком инсулинорезистентности. Нигроидный акантоз выявили у 6% (3) женщин. Повышенный уровень инсулина сопряжен со снижением глобулина, связывающего половые гормоны (ГСПГ) и увеличением активности 5 альфа редуктазы, в результате чего повышается биологическая активность андрогенов [13].
Рис. 3 – Характеристика жалоб участниц исследования
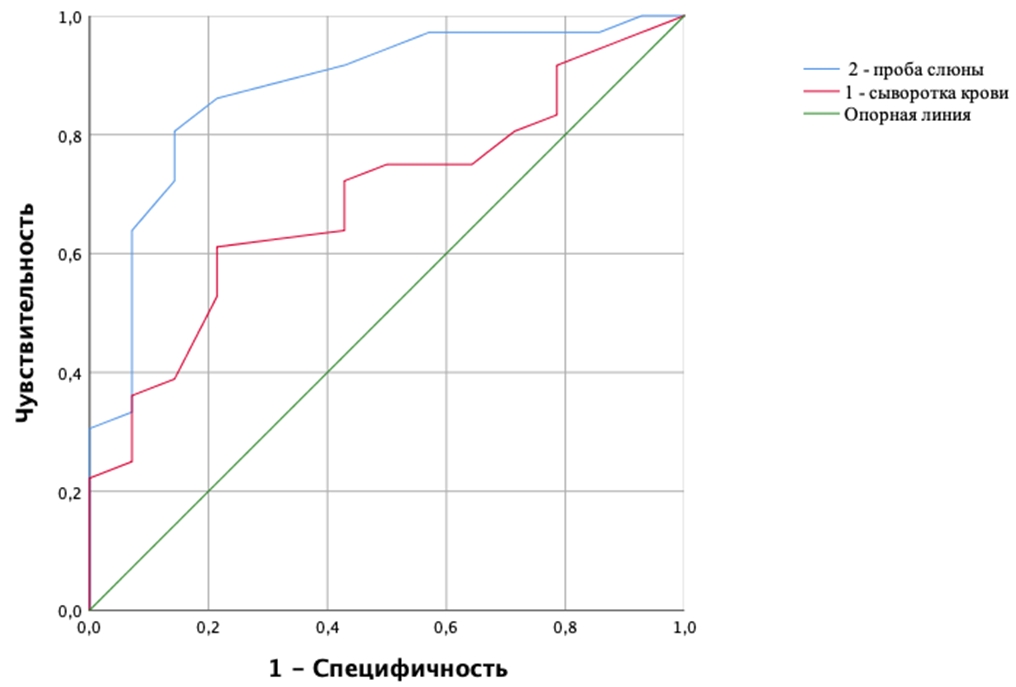
При оценке зависимости вероятности гиперандрогении у женщин репродуктивного возраста от содержания ДЭГА в сыворотки крови и утренней пробе слюны были получены следующие ROC-кривые (см. рисунок 4).
Рис. 4 – ROC-кривые, характеризующие зависимость вероятности гиперандрогении у женщин репродуктивного возраста от содержания ДЭГА в сыворотки крови и утренней пробе слюны
Полученная ROC-кривая 1 характеризовалась значением AUC = 0,68±0,78 (95% ДИ: 0,53-0,84), модель была статистически значима (p=0,05). Концентрация ДЭГА крови в точке cut-off была определена как 4,6нг/мл. У пациенток с концентрацией ДЭГА в сыворотке крови более 4,6 нг/мл отмечался повышенный риск гиперандрогении, в случае содержания ДЭГА до 4,6 нг/мл риск гиперандрогении предполагался на низком уровне. Чувствительность и специфичность модели составили 61,1% и 78,6%, соответственно.
Полученная ROC-кривая 2 характеризовалась значением AUC = 0,87±0,06 (95% ДИ: 0,76-0,98), модель была статистически значима (p=0,001). Концентрация ДЭГА в слюне в точке cut-off была определена как 0,26 нг/мл. У пациенток с концентрацией ДЭГА в слюне 0,26 нг/мл и более отмечался повышенный гиперандрогении, в случае концентрации ДЭГА в слюне менее 0,26 нг/мл риск гиперандрогении предполагался на низком уровне. Чувствительность и специфичность модели составили 86,15% и 79,4%, соответственно.
ЗаключениеТаким образом, для дифференциальной диагностики гиперандрогении у женщин репродуктивного возраста может использоваться альтернативный общепринятому метод диагностики гормонов стероидного профиля – саливадиагностика. Анализ ДЭГА утренней пробы слюны методом жидкостной хромотографии с масс-спектрометрией показал высокую чувствительность и специфичность метода, при этом специфичность оставалась на уровне определение ДЭГА в сыворотке крови, а чувствительность превышала результаты биохимического исследования крови. Следовательно, альтернативный вариант диагностики ДЭГА методом ВЖЭК-МС подтвердил свою валидность и целесообразность применения и может быть введен в рутинную практику врача-гинеколога.
Выводы1) Определение ДЭГА в сыворотке крови для дифференциальной диагностики гиперандрогении является высокоспецифичным методом у женщин репродуктивного возраста с гиперандрогенией, чувствительность метода составила - 61,1 %.
2) Диагностический метод - определения ДЭГА в утренней порции слюны наряду с высокой специфичностью, обладает более высокой чувствительностью (86,5%) в отличии от крови
3) Дополнительными преимуществами саливодиагностики являются неинвазивность, простота и доступность технологии, а также отсутствие стресса во время забора биоматериала, что может положительно влиять на приверженность пациентов к диагностике и лечению.
| Благодарности Авторы выражают благодарность ООО «Гранд Клиник, Екатеринбург». | Acknowledgement The authors are grateful to «Grand Clinic, Yekaterinburg». |
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Бугаевский К.А. К вопросу о неинвазивной диагностике уровня гормонов у спортсменов / К.А. Бугаевский // Актуальные научные исследования в современном мире. – 2017. – № 5-7 (25). – С.193–202.
- Вавилова Т.В. Возможности и перспективы исследования гормонов в слюне / Т.В. Вавилова, И.Г. Островская, А.Е. Медведев // Биомедицинская химия. – 2014. – Т 60, №3. – С.295–307.
- Дубкова Е.А. взаимосвязь патологии щитовидной железы и синдрома поликистозных яичников у женщин с бесплодием / Е. А. Дубкова, И. О. Маринкин, Т. М. Соколова и др. // Медицина и образование в Сибири. – 2013. – № 4. – С. 29–36.
- Ким Я.Е. Современные неинвазивные методы лабораторной диагностики нарушений репродуктивной функции / Я.Е. Ким, В.В. Жигулина, И.В. Наместникова // Молодежь, наука, медицина. – 2018. – С.564–569.
- Клинические рекомендации: Внутрипеченочный холестаз при беременности. – Москва, 2020. – 46 с.
- Клинические рекомендации (протокол лечения): Синдром поликистозных яичников в репродуктивном возрасте (современные подходы к диагностике и лечению). – Москва, 2015. – 19 с.
- Колесник О.В. Возможности использования биолюминесцентного биотеста в тестировании слюны : дис. … магистр биол. наук: 2019: защищена 2019 : утв. 2019 / Колесник Ольга Владиславовна. – Красноярск: СФУ, 2019. – 41 с.
- Кочурова Е.В. Диагностические возможности слюны / Е.В. Кочурова, С.В. Козлов // Клиническая лабораторная диагностика. – 2014. – №1. – С.13–15.
- Кузнецова Е.А. Диагностическое значение суточных колебаний свободных форм тестостерона и кортизола при ожирении и метаболическом синдроме у мужчин до 50 лет / Е.А. Кузнецова, А.С. Адамчик, Н.П. Гончаров и др. // Андрология и генитальная хирургия. – 2016. – Т 17. – С. 28–33.
- Мареева А.Н. Особенности обмена стероидных гормонов у пациенток с андрогенной алопецией / А.Н. Мареева, С.В. Ротанов, Г.Е. Чернуха // Вестник дерматологии и венерологии. – 2013. – № 3. – С. 27–32.
- Парахонский А.П. Информативность гормонов слюны о функциональном состоянии эндокринной системы / А.П. Парахонский // Заметки ученого. – 2019. – № 8 (42). – С.35–43.
- Фетисова Н.В. Проблемы информативности и достоверности оценки биомаркеров, входящих в гормональный профиль пациента / Н.В. Фетисова // Физическая и реабилитационная медицина, медицинская реабилитация. – 2019. – № 2(2). – С. 47–50.
- Чернуха Г.Е. Неиспользованные возможности коррекции эндокринно-метаболических нарушений при синдроме СПКЯ / Г.Е. Чернуха, Г.И. Табеева, М.А. Удовиченко // Акушерство и гинекология. – 2019. – № 10. – С. 140–147.
- Giacomello G. Current methods for stress marker detection in saliva / G. Giacomello, A. Scholten, M.C. Parr // Journal of Pharmaceutical and Biomedical Analysis. – 2020. – № 191. – P. 113604
- Han L. Noninvasive detection of human dehydroepiandrosterone, progesterone and testosterone using LC-MS/MS revealed effects of birth control pills/devices and body weight on ovulatory prediction / L. Han, S.E. Wemm, L. Shen et al. // Journal of Chromatography B. – 2021. – № 1174. – P. 122716
- Mezzullo M. Parallel diurnal fluctuation of testosterone, androstenedione, dehydroepiandrosterone and 17OHprogesterone as assessed in serum and saliva: validation of a novel liquid chromatography-tandem mass spectrometry method for salivary steroid profiling / M. Mezzullo, A. Fazzini, A. Gambineri et al. // Clinical Chemistry and Laboratory Medicine. – 2017. – № 55 (9). – P. 1315–1323
- Ney L.J. Reproducibility of saliva progesterone measured by immunoassay compared to liquid chromatography mass spectrometry / L. J. Ney, K.L. Felmingham, D. Nichols // Analytical Biochemistry. – 2020. – № 610. – P. 113984.
Список литературы на английском языке / References in English
- Bugaevsky K.A. K voprosu o neinvazivnoj diagnostike urovnja gormonov u sportsmenov [On the issue of non-invasive diagnostics of the level of hormones in athletes] / K.A. Bugaevsky // Aktual'nye nauchnye issledovanija v sovremennom mire [Actual scientific research in the modern world]. – 2017. – № 5-7 (25). - Р. 193–202. [in Russian]
- Vavilova T.V. Vozmozhnosti i perspektivy issledovanija gormonov v sljune [Opportunities and prospects for the study of hormones in saliva] / T.V. Vavilova, I. G. Ostrovskaya, A.E. Medvedev // Biomedicinskaja himija [Biomedical Chemistry]. – 2014. – T 60, № 3. – P.295-307. [in Russian]
- Dubkova E.A. Vzaimosvjaz' patologii shhitovidnoj zhelezy i sindroma polikistoznyh jaichnikov u zhenshhin s besplodiem [The relationship of thyroid pathology and polycystic ovary syndrome in women with infertility] / E. A. Dubkova, I. O. Marinkin, T. M. Sokolova et al. // Medicina i obrazovanie v Sibiri [Medicine and education in Siberia]. – 2013. – №4. – P. 29–36. [in Russian]
- Kim Ya.E. Sovremennye neinvazivnye metody laboratornoj diagnostiki narushenij reproduktivnoj funkcii [Modern non-invasive methods of laboratory diagnostics of reproductive disorders] / Ya.E. Kim, V.V. Zhigulina, I.V. Namestnikova // Molodezh', nauka, medicina [Youth, Science, Medicine]. – 2018. – P.564–569. [in Russian]
- Klinicheskie rekomendacii: Vnutripechenochnyj holestaz pri beremennosti [Clinical guidelines: Intrahepatic cholestasis during pregnancy]. – Moscow, 2020. – 46 p. [in Russian]
- Klinicheskie rekomendacii (protokol lechenija): Sindrom polikistoznyh jaichnikov v reproduktivnom vozraste (sovremennye podhody k diagnostike i lecheniju) [Clinical guidelines (treatment protocol): Polycystic ovary syndrome in reproductive age (modern approaches to diagnosis and treatment)]. - Moscow, 2015. – 19 p. [in Russian]
- Kolesnik O.V. Vozmozhnosti ispol'zovanija bioljuminescentnogo biotesta v testirovanii sljuny [Possibilities of using a bioluminescent biotest in saliva testing]: dis. … Master of biol.sciences: 2019: defense of thesis 2019: approved. 2019 / O.V. Kolesnik. - Krasnoyarsk: Siberian Federal University, 2019. – 41 p. [in Russian]
- Kochurova E.V. Diagnosticheskie vozmozhnosti sljuny [Diagnostic capabilities of saliva] / E.V. Kochurova, S.V. Kozlov // Klinicheskaja laboratornaja diagnostika [Clinical laboratory diagnostics]. – 2014. – № 1. – P. 13-15. [in Russian]
- Kuznetsova E.A. Diagnosticheskoe znachenie sutochnyh kolebanij svobodnyh form testosterona i kortizola pri ozhirenii i metabolicheskom sindrome u muzhchin do 50 let [Diagnostic value of daily fluctuations of free forms of testosterone and cortisol in obesity and metabolic syndrome in men under 50 years old] / Kuznetsova, A.S. Adamchik, N.P. Goncharov, et al. // Andrologija i genital'naja hirurgija [Andrology and Genital Surgery]. – 2016. – V 17. – P. 28–33. [in Russian]
- Mareeva A.N. Osobennosti obmena steroidnyh gormonov u pacientok s androgennoj alopeciej [Peculiarities of steroid hormone exchange in patients with androgenic alopecia] / A.N. Mareeva, S.V. Rotanov, G.E. Chernukha // Vestnik dermatologii i venerologii [Bulletin of Dermatology and Venereology]. – 2013. – № 3. – P. 27–32. [in Russian]
- Parakhonsky A.P. Informativnost' gormonov sljuny o funkcional'nom sostojanii jendokrinnoj sistemy [Informative value of saliva hormones on the functional state of the endocrine system] / A.P. Parakhonsky // Zametki uchenogo [Notes of a scientist]. – 2019. – № 8 (42). – P.35–43. [in Russian]
- Fetisova N.V. Problemy informativnosti i dostovernosti ocenki biomarkerov, vhodjashhih v gormonal'nyj profil' pacienta [Problems of the informativeness and reliability of the assessment of biomarkers included in the patient's hormonal profile] / N.V. Fetisova // Fizicheskaja i reabilitacionnaja medicina, medicinskaja reabilitacija [Physical and Rehabilitation Medicine, Medical Rehabilitation]. – 2019. – №. 2 (2). – P. 47-50. [in Russian]
- Chernukha G.E. Neispol'zovannye vozmozhnosti korrekcii jendokrinno-metabolicheskih narushenij pri sindrome SPKJa [Unused opportunities for the correction of endocrine-metabolic disorders in PCOS] / G.E. Chernukha, G.I. Tabeeva, M.A. Udovichenko // Akusherstvo i ginekologija [Obstetrics and gynecology]. – 2019. – № 10. – P. 140–147. [in Russian]
- Giacomello G. Current methods for stress marker detection in saliva / G. Giacomello, A. Scholten, M.C. Parr // Journal of Pharmaceutical and Biomedical Analysis. – 2020. – № 191. – P. 113604
- Han L. Noninvasive detection of human dehydroepiandrosterone, progesterone and testosterone using LC-MS/MS revealed effects of birth control pills/devices and body weight on ovulatory prediction / L. Han, S.E. Wemm, L. Shen et al. // Journal of Chromatography B. – 2021. – № 1174. – P. 122716
- Mezzullo M. Parallel diurnal fluctuation of testosterone, androstenedione, dehydroepiandrosterone and 17OHprogesterone as assessed in serum and saliva: validation of a novel liquid chromatography-tandem mass spectrometry method for salivary steroid profiling / M. Mezzullo, A. Fazzini, A. Gambineri et al. // Clinical Chemistry and Laboratory Medicine. – 2017. – № 55 (9). – P. 1315–1323
- Ney L.J. Reproducibility of saliva progesterone measured by immunoassay compared to liquid chromatography mass spectrometry / L. J. Ney, K.L. Felmingham, D. Nichols // Analytical Biochemistry. – 2020. – № 610. – P. 113984.