Enzymatic activity of cerium oxide nanoparticles in media with different acidity
Enzymatic activity of cerium oxide nanoparticles in media with different acidity
Abstract
Cerium dioxide nanoparticles are promising materials for biomedical applications due to their ability to perform the functions of various enzymes. The study on the peculiarities of different types of enzymatic activity helps one to explain the mechanisms of different reactions and the influence of the environment on them. In this work we studied the peroxidase and oxidase activities of cerium dioxide nanoparticles coated with stabilizing maltodextrin shells depending on the environmental conditions. The inhibition of the peroxidase-like reaction was found to be observed when the volume of the 3,3',5,5'-tetramethylbenzidine substrate is reduced. The value of the Michaelis constant for the peroxidase type of activity was assessed. The cerium dioxide nanoparticles were shown to exhibit an affinity for the chromogenic 3,3',5,5'-tetramethylbenzidine substrate, which is sufficient for their use along with horseradish peroxidase for immunological tests.
1. Введение
Проблема продления нормальной жизнедеятельности организма была актуальна во все времена. На биохимическом уровне секрет долголетия кроется в наличие антиоксидантной защиты организма, обеспечивающей контроль свободно-радикальных реакций. Ключевым фактором в поддержании достаточного уровня резистентности организма в условиях окислительного стресса, участвующего в патогенезе многих заболеваний, играют особые вещества – антиоксиданты .
Нанокристаллический диоксида церия проявляет химические свойства подобно энзимам, участвующим в реакциях нейтрализации экзогенных активных форм кислорода (АФК) в живых системах. С точки зрения физико-химических свойств данного соединения, эффект в системах in vitro и in vivo может быть обусловлен наличием кислородных вакансий в его структуре, а также двух стабильных степеней окисления . При переходе от макроразмерного к наноразмерному диоксиду церия параметр элементарной ячейки увеличивается, что связано с удаление протонированного кислорода в форме воды с поверхности решетки с образованием кислородных вакансий , . Происходит частичное восстановление атомов церия до степени окисления Се3+. Устойчивость наночастиц к внутренней среде организма и совместимость с ней обеспечивается наличием мальтодекстриновой оболочки . Механизм протекания реакций с участием наночастиц диоксида церия (НДЦ) в качестве энзима зависит от параметров среды, которую необходимо подобрать таким образом, чтобы ее показатели были оптимальны для более активного проявления ферментативной активности наночастиц.
Поэтому целью данной работы стало исследование физико-химических свойств наночастиц оксида церия, стабилизированных мальтодекстрином, путем оценки их ферментативной активности в средах различной кислотности. Для этого была исследована мультиферментативная активность НДЦ в зависимости от водородного показателя буферного раствора.
2. Детали эксперимента
Наночастицы диоксида церия были получены из раствора соли хлорида гептагидрата церия (III) путем химического осаждения. Для стабилизации НДЦ использовался мальтодекстрин, позволяющий получать устойчивые и нетоксичные золи . Далее проводилась диспергация водных золей наночастиц (концентрация наночастиц в золе – 200 мкг/мл) с помощью ультразвука в течение 40 минут .
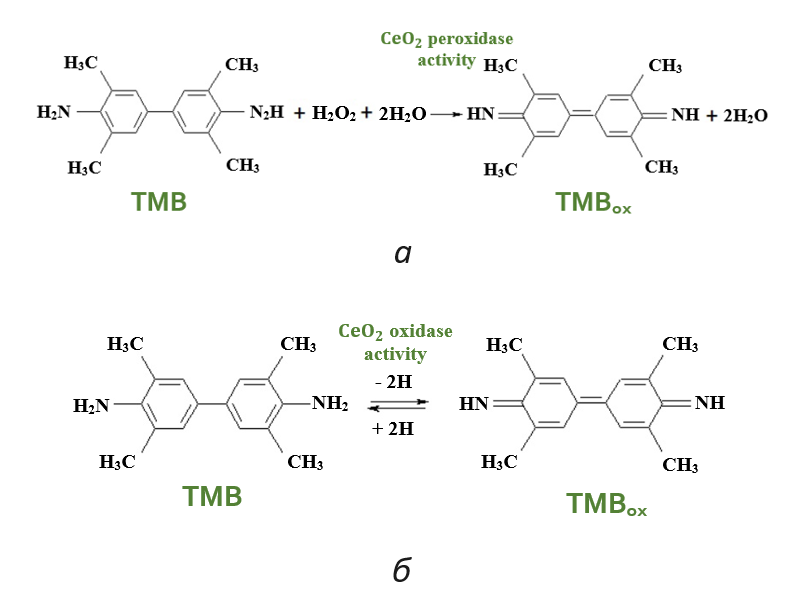
Рисунок 1 - Механизм действия пероксидазы (a) и оксидазы (б) на субстрат ТМБ
Для анализа пероксидазной активности наночастиц CeO2 были измерены временные зависимости оптической плотности субстрата ТМБ после добавления в кювету пероксида водорода Н2О2 . Для оценки оксидазной активности были получены зависимости оптической плотности ТМБ от времени в смеси без пероксида водорода, а затем с его добавлением. При этом происходит окисление молекул субстрата ТМБ супероксид-анионом, который образуется в результате взаимодействия кислорода с оксидом церия.
Регистрация кривых оптической плотности окисленного субстрата ТМБ проводилась в течение 10 минут с использованием спектрофотометра ПЭ-5400УФ («Экросхим»), состоящего из источников излучения, оптической системы, формирующей рабочие пучки, монохроматора, кюветного отделения, фотоприемника и электронно-регистрирующей микропроцессорной системы. Управление прибором производилось с внешнего компьютера. Измерения проводились на длине волны 652 нм.
По полученным данным были построены графики зависимостей концентрации продуктов окисления ТМБ от времени, пересчитанные по закону Бугера–Ламберта–Бера (1).
где А – оптическая плотность;
ε – коэффициент молярного поглощения;
L – толщина кюветы, равная 1 см.
Зависимости концентрации субстрата от скорости реакции, определенной по наклону касательной к графику концентрации продукта от времени, соответствуют модели Михаэлиса–Ментен (2).
Константа Михаэлиса, рассчитанная в ходе работы для оценки активности НДЦ, может быть определена по графику уравнения Лайнуивера–Берка (3), который получается путем линеаризации уравнения Михаэлиса–Ментен.
Пересечение прямой с осью 1/[С] в отрицательной области дает значение, равное -1/Кm, по которому определяется величина константы Михаэлиса.
3. Результаты эксперимента и их обсуждение
Химизм реакций, протекающих с участием НДЦ, и, как следствие, их роль в биологических процессах организма, а именно взаимодействия энзима с субстратом, зависит от параметров окружающей среды, в том числе и водородного показателя раствора, в котором протекает реакция. Анализ влияния pH среды на биологическую активность НДЦ был проведен на основе кривых оптической плотности продуктов реакции окисления 3,3’,5,5’-тетраметилбензидина (ТМБ) в дистиллированной воде (pH = 7,0) и ацетатном буферном растворе (pH = 5,1). В случае последнего оценка свойств велась посредством построения разностных графиков зависимостей оптической плотности от времени. Выбор данного буферного раствора обусловлен наибольшей степенью сходства его химического состава с внутренней средой биообъекта.
При увеличении доли ионов Се3+ свыше 40 % относительно валентного отношения Се3+/Се4+ НДЦ проявляют пероксидазную активность вследствие наличия на поверхности кристаллической решетки ионов Се3+. Для пероксидазы субстратом является не только пероксид водорода, но и неорганические или молекулы органического и неорганического происхождения, которые окисляются пероксидом водорода в его присутствии .
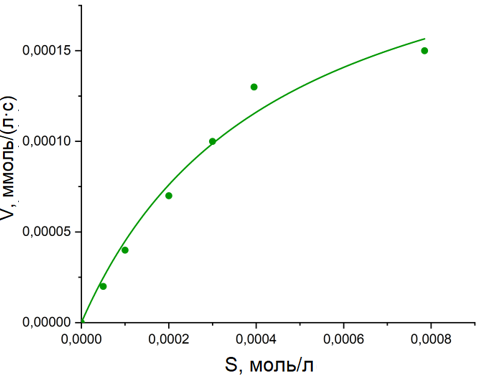
Рисунок 2 - Кривая зависимости концентрации субстрата ТМБ от скорости реакции, подчиняющаяся уравнению Михаэлиса-Ментен
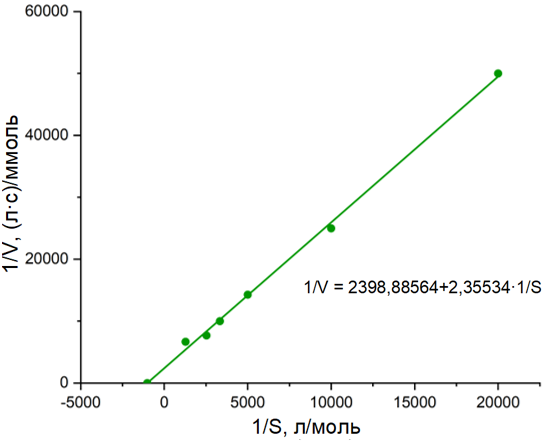
Рисунок 3 - Кривая субстратного насыщения в обратных координатах
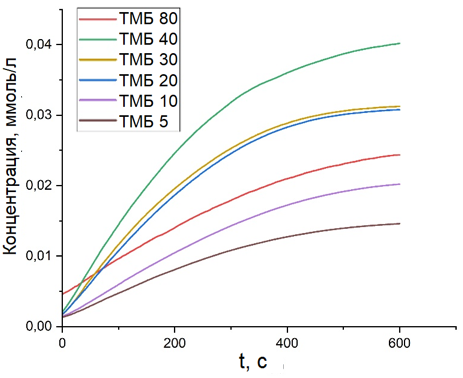
Рисунок 4 - Кинетические кривые зависимости окисленного ТМБ от времени при разных объемах вводимого субстрата
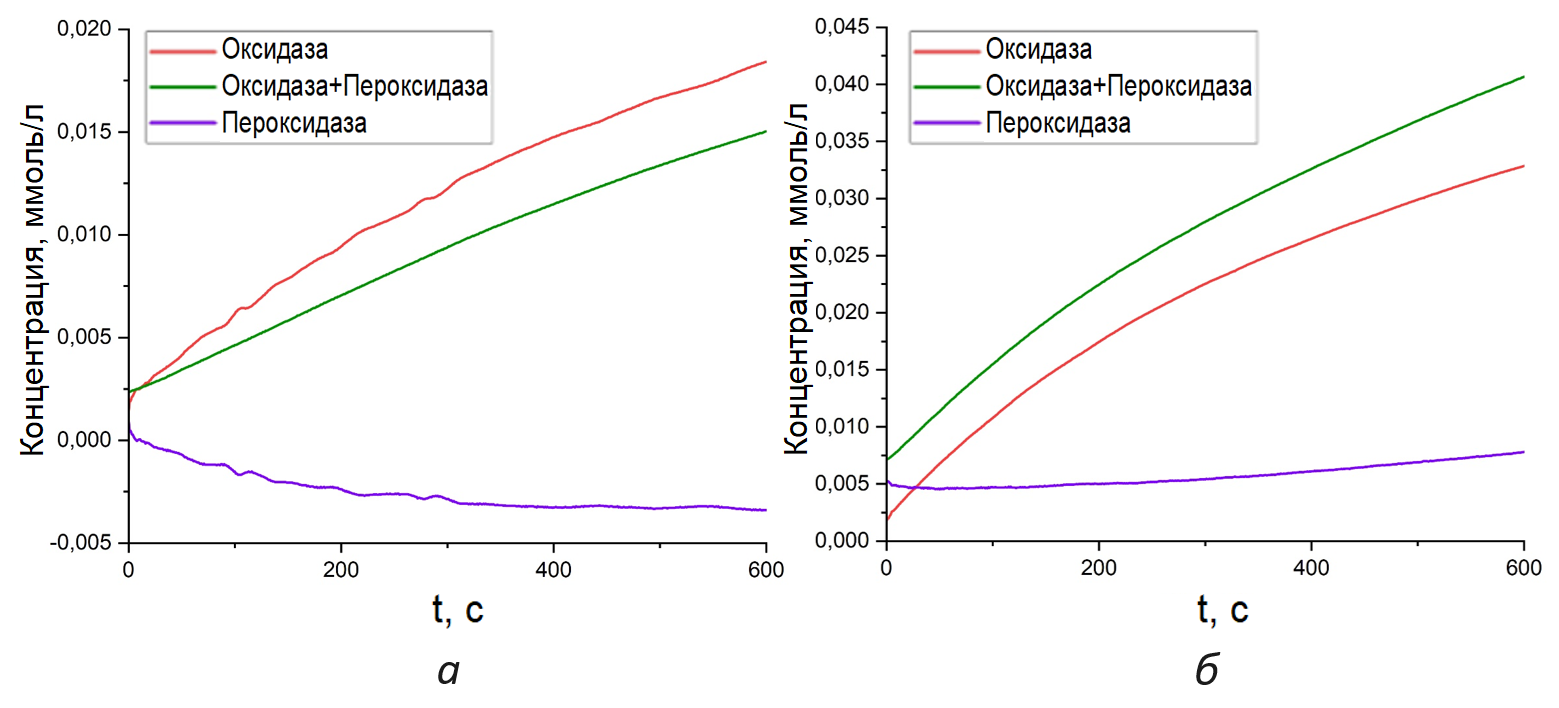
Рисунок 5 - Кривые оптической плотности продукта для конкурирующих реакций при добавлении субстрата:
а – 5 мкл ТМБ; б – 40 мкл ТМБ
4. Заключение
Результаты исследования показали, что наночастиц оксида церия способны выполнять функции ферментов пероксидазы и оксидазы. Проявление пероксидазного и оксидазного типов активностей сильно зависит от кислотности среды. Так, имитация поведения фермента пероксидазы наиболее активно происходит в среде с нейтральным рН, в то время как при снижении рН среды для наночастиц оксида церия характерны скорее оксидазоподобные свойства. В работе проанализированы особенности конкурирующих реакций, катализируемых наночастицами при имитации поведения ферментов оксидазы и пероксидазы. Обнаружено влияние объема субстрата на характер его окисления. Так, при уменьшении объема субстрата ТМБ обнаружено ингибирование реакции, катализируемой пероксидазой.
Проведена оценка значения константы Михаэлиса для пероксидазного типа активности и показано, что наночастицы диоксида церия проявляет сродство к хромогенному субстрату ТМБ, достаточное для их использования наряду с пероксидазой хрена в иммунологических тестах.
Полученные результаты могут являться основой для уточнения механизма механизмов мультиферментативной активности наночастиц оксида церия, особенно в условиях разной кислотности биологических сред.
