INFLUENCE OF TYPE OF FUEL DURING SYNTHESIS OF ELECTRODE MATERIAL PR1.6CA0.4NI0.6CU0.4O4 ON ITS ELECTROCHEMICAL CHARACTERISTICS
INFLUENCE OF TYPE OF FUEL DURING SYNTHESIS OF ELECTRODE MATERIAL PR1.6CA0.4NI0.6CU0.4O4 ON ITS ELECTROCHEMICAL CHARACTERISTICS
Abstract
In this work, a complex oxide of the composition Pr1.6Ca0.4Ni0.6Cu0.4O4 with a Raddlesden-Popper structure was synthesized by combustion of organo-nitrate precursors by varying the organic component (glycine, glycerol, citric acid and polyvinyl alcohol) used for their preparation. The influence of synthesis conditions on phase formation processes, final temperature of heat treatment, specific surface area and electrochemical characteristics of electrodes based on the obtained complex oxide on Ce0.8Sm0.2O1.9 electrolyte has been shown. Based on the results of measurements of polarization characteristics, the optimal synthesis parameters of Pr1.6Ca0.4Ni0.6Cu0.4O4 material were determined for its further use as a promising cathode material for medium-temperature solid oxide fuel cells.
1. Введение
Интерес исследователей-материаловедов к сложным оксидам, обладающим структурой фаз Раддлесдена-Поппера Ln2NiO4+δ (A2BO4+δ) вызван наличием у данных материалов ряда функциональных свойств, таких как высокая каталитическая активность в реакциях восстановления кислорода и термомеханическая совместимость с твердыми электролитами, а также приемлемая смешанная проводимость. Благодаря высокой функциональности, данные материалы могут быть успешно использованы как для создания электродов для среднетемпературных твердооксидных топливных элементов (ТОТЭ) , , , электролизеров , так и каталитических мембран.
Исследование электрохимической активности электродов ряда Ln2NiO4+δ (Ln=La, Pr, Nd) в контакте с электролитами YSZ , и Ce0.8Sm0.2O1.9 (SDC) показало, что наилучшими характеристиками обладают электроды на основе Pr2NiO4+δ. При долговременных испытаниях ячейки с электродом Pr2NiO4+δ в интервале температур 600–800℃ было установлено, что значение поляризационного сопротивления претерпевает незначительное изменение несмотря на то, что электрод разлагается на фазы Pr4Ni3O10+δ, PrNiO3-δ и Pr6O11 в течение месяца использования .
Для устранения твердофазной деструкции материала электрода Pr2NiO4+δ и повышения его стабильности при эксплуатации ячейки была применена стратегия замещения ионов, находящихся в А- и В- позициях. Авторы работ , , попытались стабилизировать основную фазу никелита частичным замещением ионов празеодима на ионы неодима. После проведения испытаний гомогенные материалы в ряду Pr2–xNdxNiO4+δ были зафиксированы для степени замещения 1.0≤x≤2.0 согласно и для 0,75≤x≤1,0 согласно . В работе состав PrNdNiO4+δ деградировал после отжига в течение 500 часов при 870 ℃, поэтому дополнительная стабилизация никелитной фазы была осуществлена при помощи со-допирования по В-позиции ионами меди. Изучение замещения ионов лантана на ионы празеодима в La2NiO4+δ, проведённое в работе , показало, что сложный оксид La1.5Pr0.5NiO4+δ не являлся однофазным после старения, но показал лучшие результаты в плане электрохимической активности и был признан авторами оптимальным составом для перспективного использования в ТОТЭ.
Согласно выводам работ , , ,
, для сохранения гомогенности после длительной термической обработки сложнооксидных фаз в случае замещения А-позиции в Ln2NiO4+δ ионами щелочноземельных металлов (Ca, Sr, Ba) требуется меньшая концентрация иона-допанта по сравнению с ионами редкоземельных элементов. Авторы работы минимальное значение поляризационного сопротивления Rp получили для состава Pr1.8Ba0.2NiO4+δ. В работе установлено, что Pr1.7Ca0.3NiO4+δ в сравнении с Pr2NiO4+δ характеризуется повышением электропроводности, однако при этом электрохимические характеристики электродов в контакте с электролитом SDC ухудшаются.Улучшение электрохимических характеристик электродов на основе Ln2NiO4+δ за счет снижения температуры припекания электрода к электролиту может быть достигнуто при частичном замещении ионов никеля на ионы меди , , ,
. В работе отмечено, что оптимальным составом при замещении ионов никеля на медь является состав Nd1.6Ca0.4Ni0.8Cu0.2O4+δ, так как именно для этого содержания меди наблюдается минимальное значение Rp на подложке SDC. Тогда как в для составов PrNdNi1-yCuyO4+δ (x=0.0–0.2) показано, что при использовании в качестве электролита YSZ с увеличением концентрации меди Rp увеличивается.В настоящей работе разработаны методы получения дисперсного сложнооксидного материала со структурой Раддлесдена-Поппера состава Pr1.6Ca0.4Ni0.6Cu0.4O4+δ с различным органическим топливом. Установлена взаимосвязь морфологии порошковых материалов и электрохимических свойства электродов на их основе. Выделен наиболее перспективный способ синтеза для получения широкого круга материалов на основе слоистых никелато-купратов.
2. Образцы и методика эксперимента
Для приготовления образцов Pr1.6Cа0.4Ni0.6Cu0.4O4 в качестве исходных реагентов использовали следующие: карбонат кальция CaCO3 (квалификация ос. ч.), оксид празеодима Pr6O11 (квалификация ч. д. а.), ацетат никеля Ni(CH3COO)2·4H2O (квалификация х. ч.) и оксид меди CuO (квалификация ч. д. а.). Для удаления адсорбированных газов и воды, карбонат кальция CaCO3, оксид празеодима Pr6O11 и оксид меди CuO предварительно прокаливали при 500, 600 и 400 °C, соответственно. Для растворения исходных оксидов и карбоната использовали азотную кислоту HNO3 (квалификация ос. ч.). В качестве комплексообразующего агента и органического топлива при удалении растворителя и горении реагирующей смеси применяли глицин, лимонную кислоту, глицерин и поливиниловый спирт (все квалификации ч. д. а.). Необходимые количества исходных неорганических веществ рассчитывали по уравнению реакции (1) с образованием сложного оксида, углекислого газа CO2 и воды H2O:
Стехиометрические количества CaCO3, Pr6O11 и CuO растворяли в разбавленной азотной кислоте, а Ni(CH3COO)2·4H2O – в дистиллированной воде. Полученные растворы смешивали и перемещали в фарфоровую чашку, куда затем добавляли органический компонент в соотношении 1:1 к количеству взятой для растворения исходных веществ азотной кислоты по стехиметрии реакции горения с образованием в качестве газообразных продуктов диоксида углерода, воды и азота
.Количество органического компонента (топлива) необходимое для горения, рассчитывали из формальной реакции взаимодействия органического компонента с нитрат-ионами с образованием, например:
Полученные нитрат-органические прекурсоры нагревали в фарфоровой чашке до полного испарения воды и образования аморфизированного сухого остатка после горения. Полученные в реакциях последующего горения порошки подвергали последовательному отжигу при температурах от 650 до 1100°C (шаг 100°C) в течение 12 часов с промежуточным перетиранием в среде этилового спирта. Скорость нагрева/охлаждения составляла 100 градусов в час. Окончательную температуру термообработки определяли рентгенографически (получение однофазного образца).
Материал электролита Ce0.8Sm0.2O2 был получен методом горения глицерин-нитратных композиций с использованием нитрата церия Ce(NO3)3·6H2O и оксида самария Sm2O3 (обе квалификации ч. д. а.) в качестве исходных реагентов. Оксид самария растворяли в азотной кислоте HNO3 (квалификация ос. ч.). В полученную смесь добавили нагретый для снижения вязкости глицерин, после чего полученную смесь нагревали на плитке при температуре ~300 °C до полного испарения воды и самовоспламенения. Окончательную термообработку проводили при температурах 950 и 1050 °C в течение 12 часов с промежуточным перетиранием в среде этилового спирта. Скорость нагрева/охлаждения составляла 100 градусов в час.
Рентгеновские данные необходимые для определения фазового состава образцов получали на воздухе при Т = 25 °C на дифрактометре Inel Equinox 3000 в Cu-Kα излучении. Идентификацию фаз осуществляли при помощи программных пакетов fpeak и MainMenu.
Для оценки величины удельной поверхности порошков Pr1.6Cа0.4Ni0.6Cu0.4O4 использовали метод низкотемпературной сорбции и тепловой десорбции азота на автоматическом анализаторе поверхности и пористости SoftSorbi-II ver.1.0.
Для исследования электрохимических характеристик электродов изготавливали ячейки с электролитом Ce0.8Sm0.2O2 толщиной около 1 мм с нанесенными симметрично с обеих сторон электродами методом окрашивания. Функциональный слой составов Pr1.6Cа0.4Ni0.6Cu0.4O4 наносили толщиной 30 мкм. Припекание слоев проводили при температуре 1000 °C с выдержкой 2 часа.
Поляризационное сопротивление электродов измеряли методом импедансной спектроскопии с помощью потенциостата SI 1260 и электрохимического интерфейса SI 1287 (Solartron Industries Inc.) в частотном диапазоне 0,01 Гц – 300 кГц при амплитуде возмущающего переменного напряжения 50 мВ. Регистрация каждого импедансного спектра завершалась измерением полного сопротивления электрохимической ячейки постоянному току. Исследования проводились в температурном диапазоне 500 – 850 ºС в воздушной среде.
Поляризационное сопротивление рассчитывали по следующей формуле (3):
где Rdc – сопротивление ячейки, измеренное на постоянном токе; Rhf – высокочастотное сопротивление; S – площадь электрода.
Погрешность определения удельного поляризационного сопротивления зависит, в основном, от точности определения сопротивления электролита из импедансных спектров и составляет примерно ± 3%.
3. Результаты и обсуждение
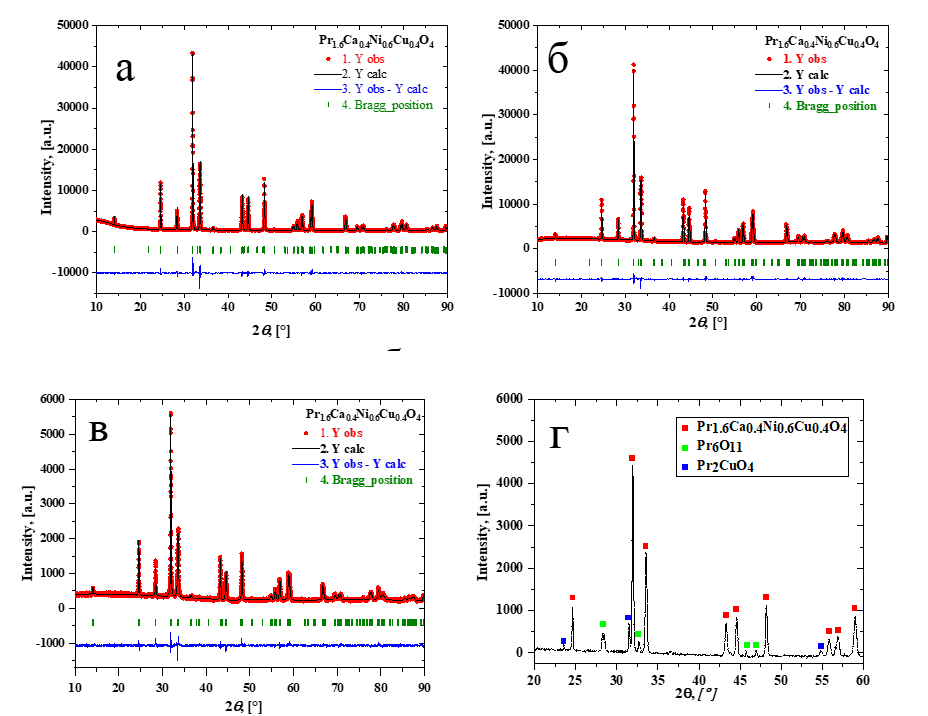
Рисунок 1 - Экспериментальные и расчетные профили рентгенограмм Pr1.6Cа0.4Ni0.6Cu0.4O4
Примечание: органический компонент: а – поливиниловый спирт; б – лимонная кислота; в – глицин; г – глицерин
Таким образом, при варьировании состава нитрат-органических прекурсоров при синтезе снижается требуемая температура отжига порошковых материалов Pr1.6Cа0.4Ni0.6Cu0.4O4, что, в свою очередь, влияет на гранулометрический состав и удельную поверхность
, , и, следовательно, может оказывать влияние на микроструктуру и электрохимическую активность электродов на их основе.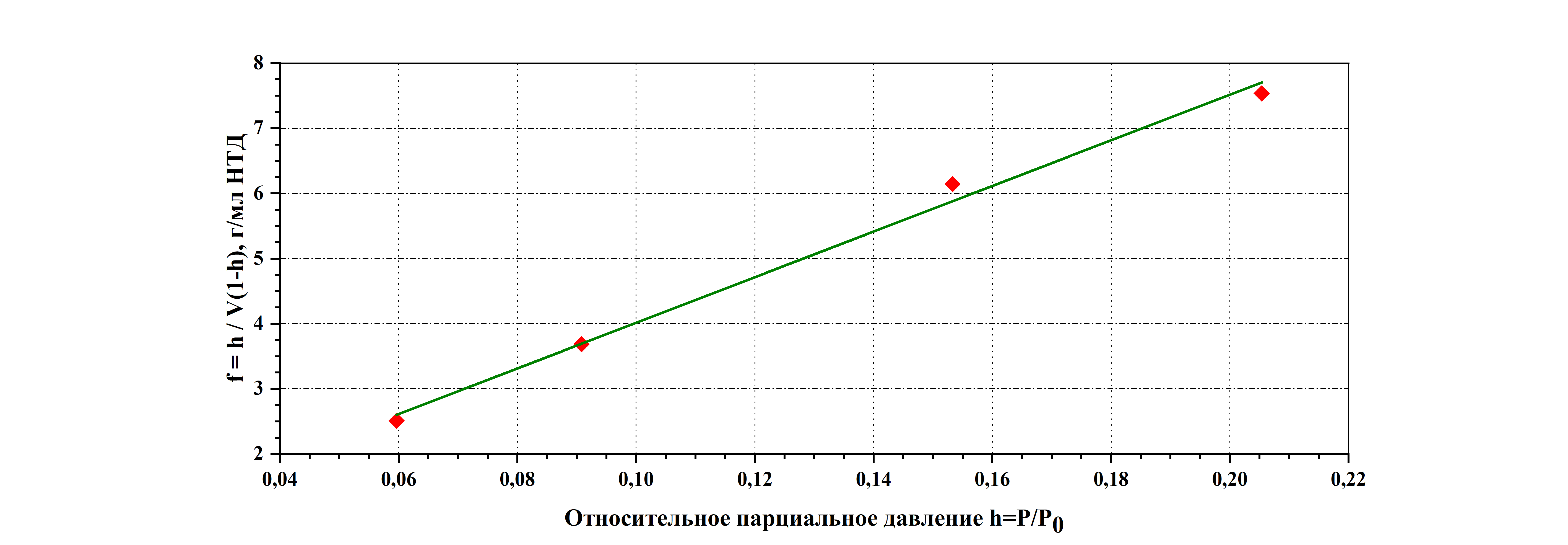
Рисунок 2 - Линейное уравнение БЭТ для образца Pr1.6Cа0.4Ni0.6Cu0.4O4
Для дальнейших исследований были выбраны образцы с наиболее высокими значениями удельной поверхности, так как являются наиболее перспективными для использования в качестве катодного материала.
На рисунке 3 и 4 представлены аррениусовские зависимости поляризационной проводимости (1/Rp, Oм·cм2) и контактной проводимости, рассчитанной из электрохимических спектров катодов Pr1.6Cа0.4Ni0.6Cu0.4O4, контактирующих с электролитом SDC, по формуле:
где L – толщина подложки SDC, S – площадь электрода. Значение Rhf получено из пересечения высокочастотной части спектра и включает в себя омическое сопротивление электролитной подложки, контакта электрод-электролит и электродов .
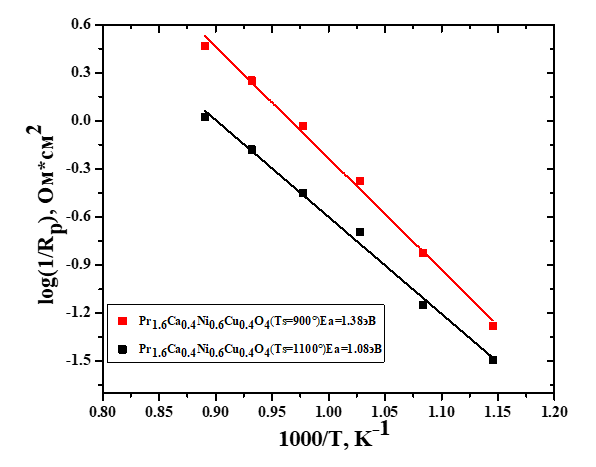
Рисунок 3 - Температурные зависимости поляризационной проводимости электродов Pr1.6Cа0.4Ni0.6Cu0.4O4, синтезированных из нитрат-органических прекурсоров, содержащих глицин (черные квадраты) или лимонную кислоту (красные квадраты)
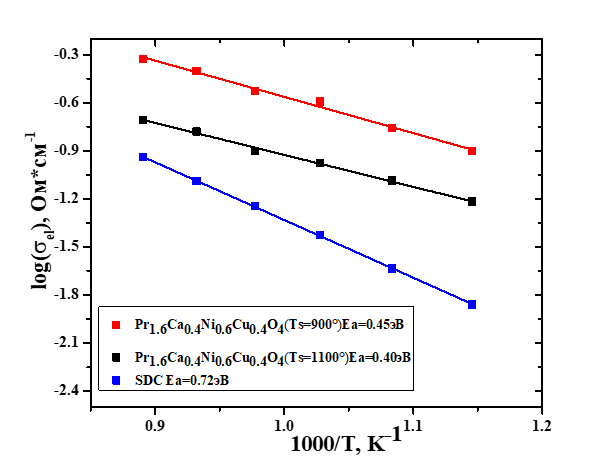
Рисунок 4 - Температурные зависимости электропроводности электролитной подложки SDC для электродов Pr1.6Cа0.4Ni0.6Cu0.4O4
Значения Rp и Еа для катодных материалов Pr1.6Cа0.4Ni0.6Cu0.4O4, синтезированных из композиций, содержащих лимонную кислоту или глицин, приведены в таблице 1. Также в таблице 1 приведены литературные данные, полученные для родственных материалов со структурой Раддлесдена-Поппера, таких как Nd1.6Cа0.4Ni0.6Cu0.4O4
и La1.7Cа0.3Ni0.6Cu0.4O4 . Сопротивление поляризации для катода, полученного из порошка, синтезированного в настоящей работе с лимонной кислотой в качестве органического компонента, принимает самые низкие значения среди подобных электродов. Следовательно, однослойные электроды Pr1.6Cа0.4Ni0.6Cu0.4O4, полученные из прекурсоров, содержащих лимонную кислоту, могут быть рекомендованы для применения в качестве перспективных катодов ТОТЭ.Таблица 1 - Параметры электродных слоев сложнооксидных материалов
Электрод | Температурный диапазон, ºС | Rp, Ом*см2 | Ea, эВ | Источник |
La1.7Cа0.3Ni0.6Cu0.4O4 | 700-850 | 8,10–1,95 | 1,38 | |
Nd1.6Cа0.4Ni0.6Cu0.4O4 | 700-850 | 5,70–1,28 | 1,17 | |
Pr1.6Cа0.4Ni0.6Cu0.4O4 (Ts=900ºС) | 700-850 | 2,37–0,34 | 1,38 | Настоящая работа |
Pr1.6Cа0.4Ni0.6Cu0.4O4 (Ts=1100ºС) | 700-850 | 4,93–0,95 | 1,08 |
4. Заключение
Было показано, что тип используемого при синтезе органического компонента, влияет как на конечную температуру синтеза, фазовый состав, удельную поверхность, так и на электрохимические характеристики сложного оксида Pr1.6Cа0.4Ni0.6Cu0.4O4. Увеличение удельной поверхности порошка приводит к снижению поляризационного сопротивления в ячейке. Наименьшее значение было получено для электрода, изготовленного из порошка Pr1.6Cа0.4Ni0.6Cu0.4O4, синтезированного путем сжигания цитрат-нитратного раствора (Rp = 0,34 Ом·см2 при 850 °C), что является оптимальным значением с точки зрения практического использования катодного материала в электрохимических устройствах, таких как ТОТЭ и электролизеры.
