FLUORIDE-IONS EFFECT ON ZIRCONIUM ELECTTROCHEMICAL BEHAVIOUR IN CHLROIDE MELTS
FLUORIDE-IONS EFFECT ON ZIRCONIUM ELECTTROCHEMICAL BEHAVIOUR IN CHLROIDE MELTS
Аннотация
The electrochemical behavior of zirconium was studied in melts based on binary eutectic (NaCl–2CsCl, LiCl–KCl) or equimolar (NaCl–KCl) mixtures of alkali metal chlorides, by cyclic, square-wave and differential pulse voltammetry. In particular, effects of fluoride-ions addition, temperature, zirconium concentration and influence of average cation radius of the solvent salt were investigated. Zirconium was added to the molten salt as K2ZrF6 (1-3 wt. %). Temperatures ranged from 550 to 750°C. All experiments were conducted in the atmosphere of high purity argon (99.998% Ar). It is shown that the reduction potentials of zirconium shift towards positive values with an increase in temperature, as well as a decrease in the concentration and average radius of the solvent salt cation.
1. Введение
Проблема переработки отработавшего ядерного топлива (ОЯТ) является одной из главных в дальнейшем развитии атомной энергетики. Цирконий является одним из основных конструкционных материалов ядерных реакторов типа РБМК. Циркониевые сплавы, легированные ниобием, используются при изготовлении топливных каналов и каналов системы управления защиты энергоблоков РБМК. При захоронении данных материалов около 99% от общей активности определяется активностью долгоживущего изотопа ниобия 94Nb, но при этом его объемная доля составляет лишь 2%.
Одним из вариантов переработки ОЯТ является пирохимический метод, подразумевающий использование в качестве рабочей среды расплавленной соли. Предпочтение, в основном, отдаётся смесям хлоридов щелочных металлов.
Электрохимическое поведение циркония в галогенидных расплавах исследовано достаточно широко , , , , и , , , , , но механизмы процессов восстановления ионов циркония, предлагаемые разными авторами, значительно отличаются.
Так, авторы утверждают, что в системе LiCl–KCl–ZrCl4 (1 мас. % ZrCl4) при 550 °C ионы Zr(IV) восстанавливаются до Zr(II). Затем эти две формы могут восстанавливаться до нерастворимого монохлорида циркония ZrCl, который в, свою очередь, восстанавливается до металлического циркония.
Полякова и Чен считают, что катодное восстановление Zr(IV) в хлоридных расплавах происходит по механзиму Zr4+ → Zr2+ → Zr с образованием растворимого дихлорида циркония.
Однако Базилье и соавторы предположили, что катодное восстановление циркония в хлоридных расплавах включает две реакции восстановления Zr4+ → Zr2+ → Zr с образованием нерастворимых дихлоридов циркония, а его диспропорция дает порошок металлического циркония и вновь образует комплекс М2ZrCl6.
Полякова и соавторы обнаружили, что в расплаве NaCl–KCl–ZrCl4 с добавлением фторида натрия, а также в NaCl–KCl–K2ZrF6, КСl–К2ZrF6 и KCl–KF–K2ZrF6, электрохимическое восстановление циркония происходит обратимо в одну стадию по четырехэлектронной реакции: Zr4++ 4е → Zr.
Чен с соавторами предположили, что электрохимическая реакция восстановления ионов циркония в хлоридно-фторидных расплавах с низким содержанием фторида представляет собой процесс двухстадийного двухэлектронного восстановления, но при более высокой концентрации фторида основные комплексные ионы циркония(IV) восстанавливаются в одну стадию до металлического циркония.
Таким образом, анализ литературы показывает, что единого мнения касательно процессов электрохимического восстановления ионов циркония нет. Целью данной работы являлось исследование влияния добавки фторид-ионов на процессы восстановления ионов циркония в хлоридных расплавах, а также изучение влияния температуры, концентрации циркония и среднего радиуса катиона соли-растворителя.
2. Методы и принципы исследования
Рабочие смеси хлоридов щелочных металлов необходимого состава готовили сплавлением соответствующих индивидуальных солей, которые предварительно сушили при вакуумировании в течение 1,5-2 часов. После получения эвтектических смесей в расплавленном виде через них барботировали хлороводород в течение 3 часов для удаления остаточной влаги и окисд-ионов.
Цирконий в рабочий электролит вводили непосредственно перед каждым экспериментом в виде гексафтороцирконата калия, K2ZrF6.
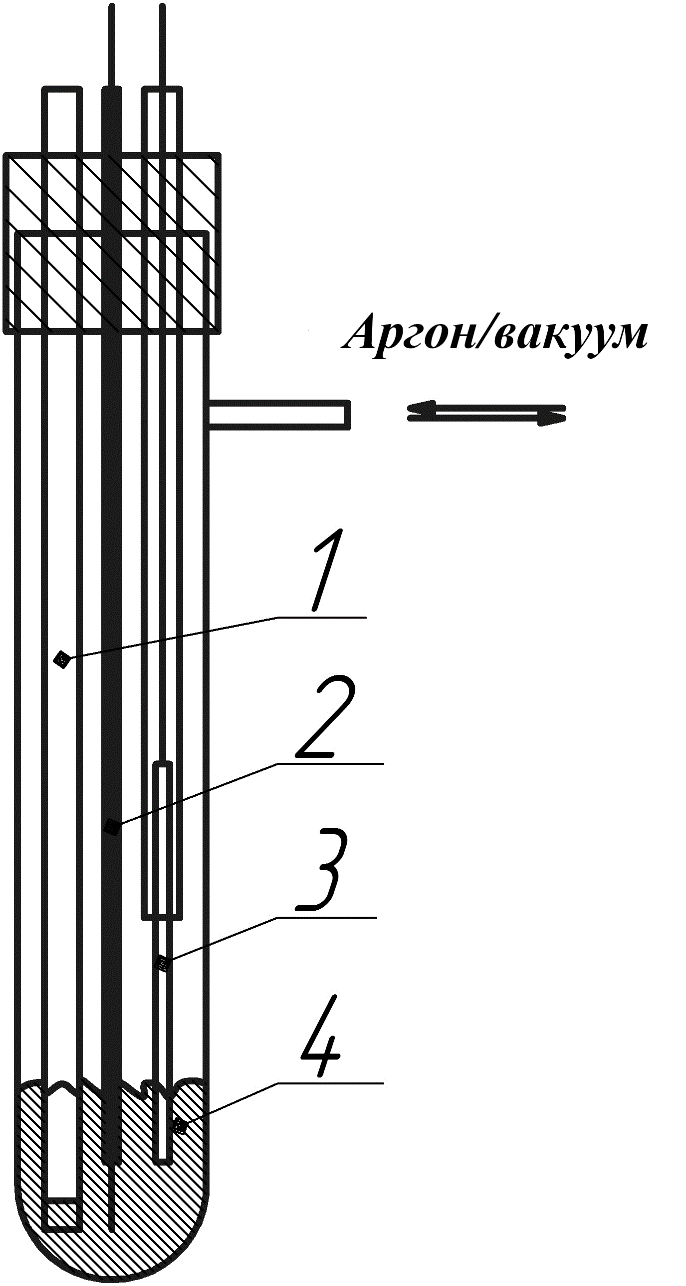
Рисунок 1 - Принципиальная схема электрохимической ячейки
Примечание: 1 – хлоридсеребряный электрод сравнения; 2 – вольфрамовый рабочий электрод; 3 – стеклоуглеродный противоэлектрод; 4 – рабочий расплав
3. Результаты и обсуждение
Чтобы оценить влияние фторид-ионов на электрохимическое поведение циркония в хлоридных расплавах, была проведена серия экспериментов, включавшая в себя опыты по исследованию систем на основе эвтектической смеси NaCl–2CsCl как с фторид-ионами, так и без них. Циклические вольтамперограммы, полученные в ходе данных экспериментов, приведены на рисунке 2.
На вольтамперограмме, зарегистрированной в расплаве чистой соли-растворителя NaCl–2CsCl при 550 ℃, наблюдается только одна пара пиков. Эти пики связаны с катодным восстановлением (нижний пик) и анодным окисением (верхний пик) щелочного металла. При введении в расплав циркония в виде тетрахлорида ZrCl4 на вольтамперограмме появляется катодный пик в области –1,3 В, который можно связать с процессом восстановления Zr(IV)/Zr(0). В случае, если в расплав цирконий вводили в виде гексафтороцирконата калия K2ZrF6, катодный пик, соответствующий восстановлению Zr(IV)/Zr(0) значительно смещался в область отрицательных значений.
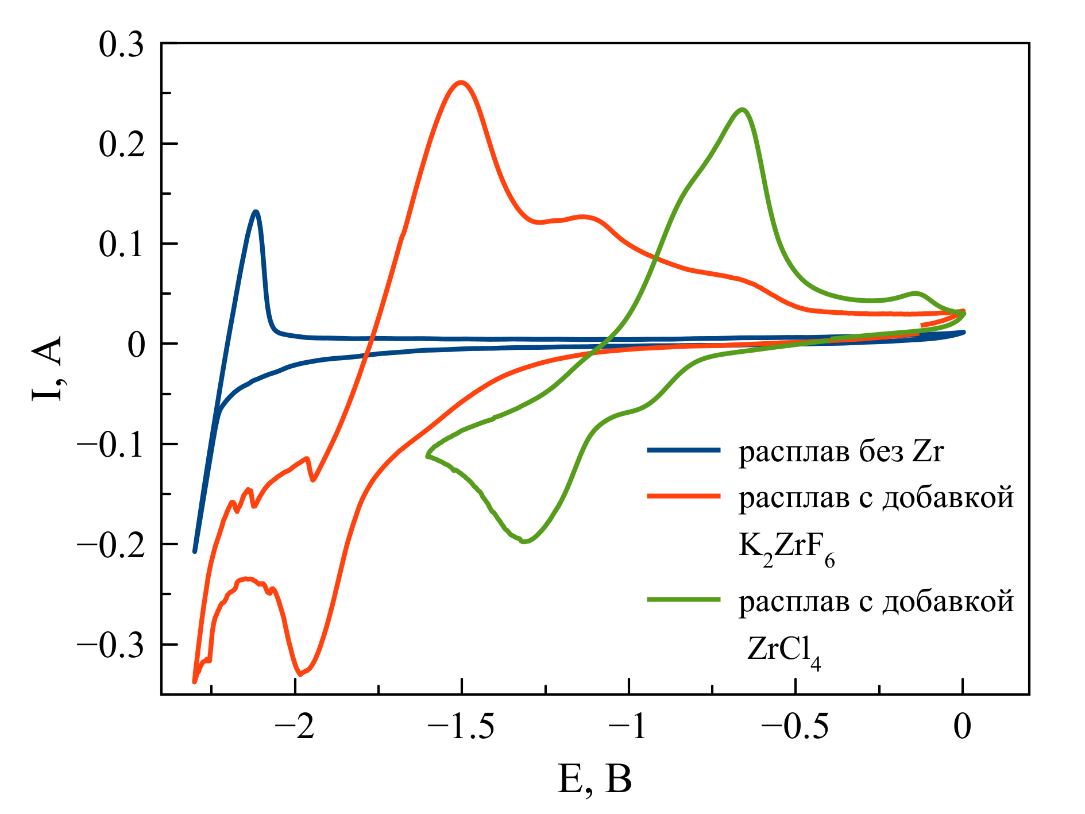
Рисунок 2 - Циклические вольтамперограммы, зарегистрированные в расплавах на основе эвтектической смеси NaCl–2CsCl, при 550 ℃
Циклические, дифференциально-импульсные и квадратно-волновые вольтамперограммы (ЦВА, ДИВА и КВВА), зарегистрированные в данной серии опытов приведены на рисунках 3-5, соответственно. Анализ вольтамперограмм, полученных разными методами, позволяет отметить, что повышение температуры приводит к смещению потенциала процесса катодного восстановления Zr(IV)/Zr(0) в область положительных значений. Следует отметить, что при 550 ℃ на циклических вольтамперограммах наблюдается два анодных пика, однако при 650 и 750 ℃ эти пики, вероятно, перекрываются и на экспериментальных кривых присутствует один широкий пик, являющийся суперпозицией двух близкорасположенных анодных волн.
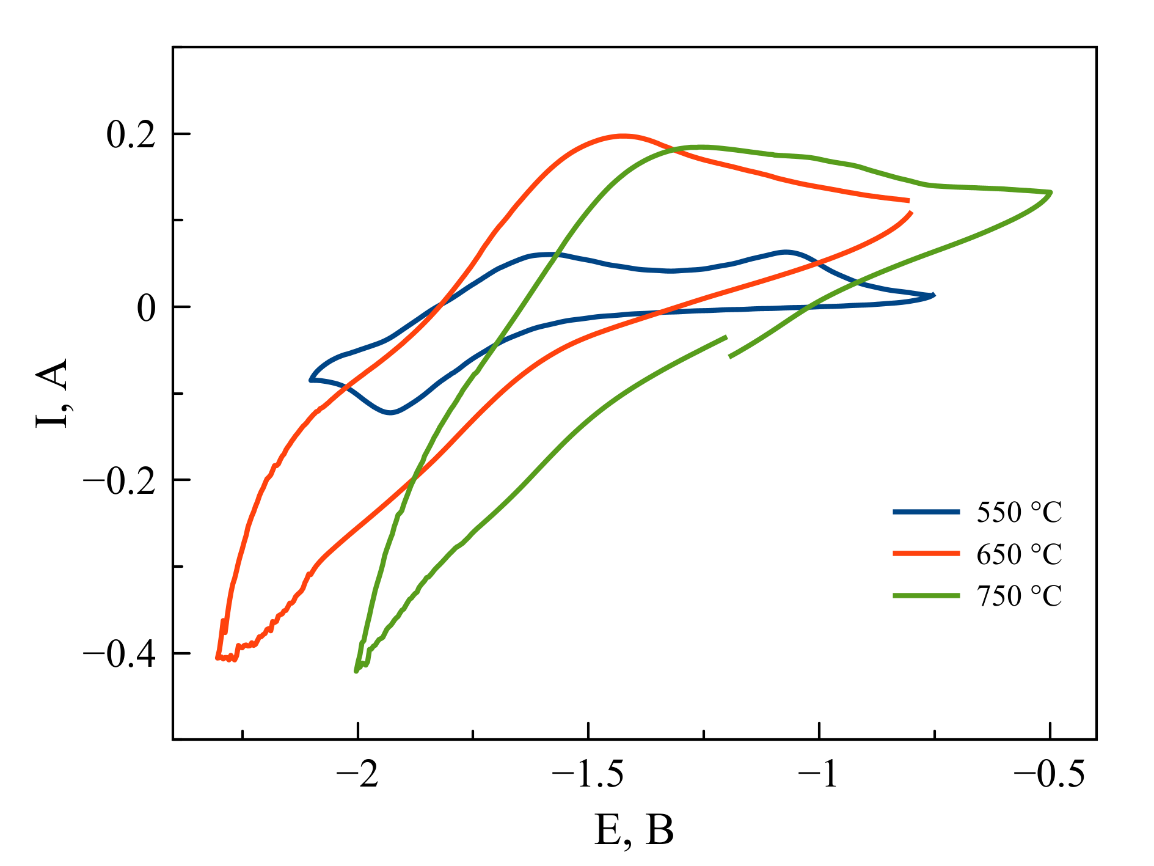
Рисунок 3 - Циклические вольтамперограммы, зарегистрированные в расплаве на основе NaCl–2CsCl с концентрацией K2ZrF6 2 масс. %. T = 550, 650, 750 ℃
Примечание: скорость развёртки потенциала 100 мВ/сек
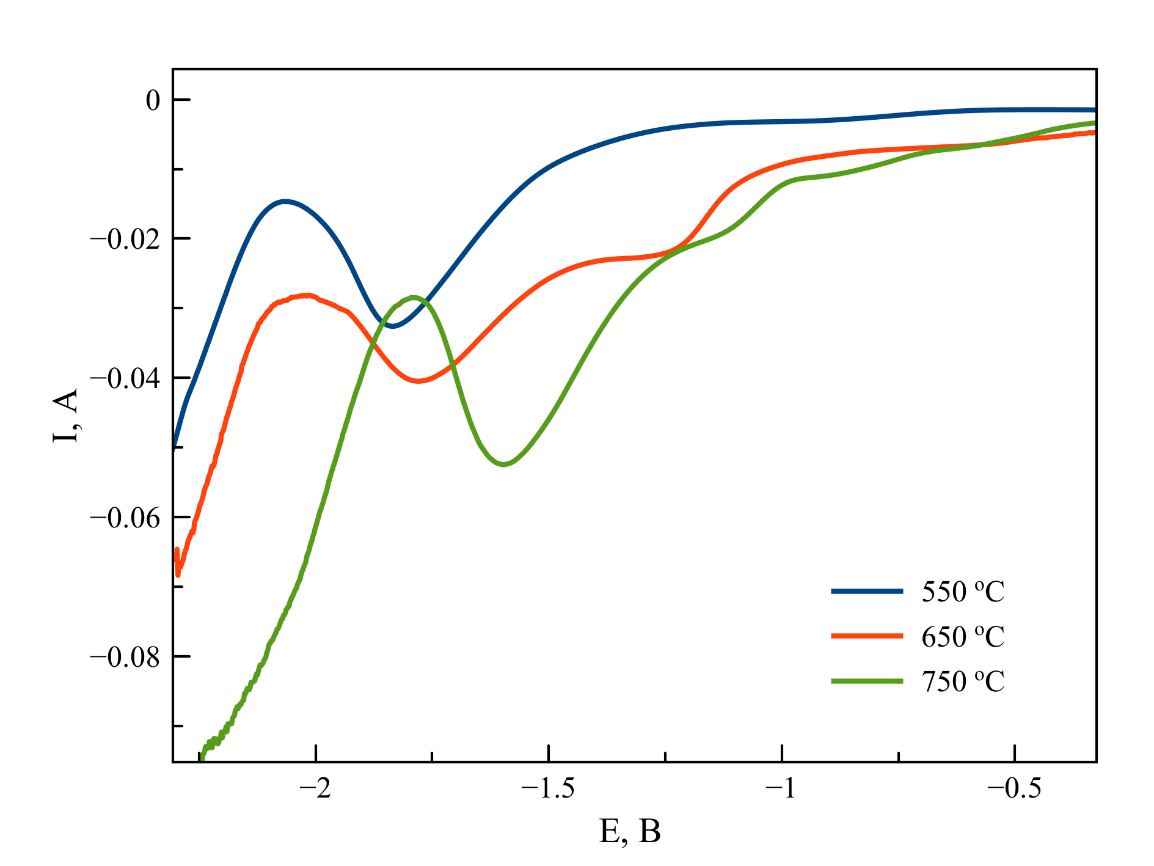
Рисунок 4 - Дифференциально-импульсные вольтамперограммы, зарегистрированные в расплаве на основе NaCl–2CsCl с концентрацией K2ZrF6 2 масс. %. T = 550, 650, 750 ℃
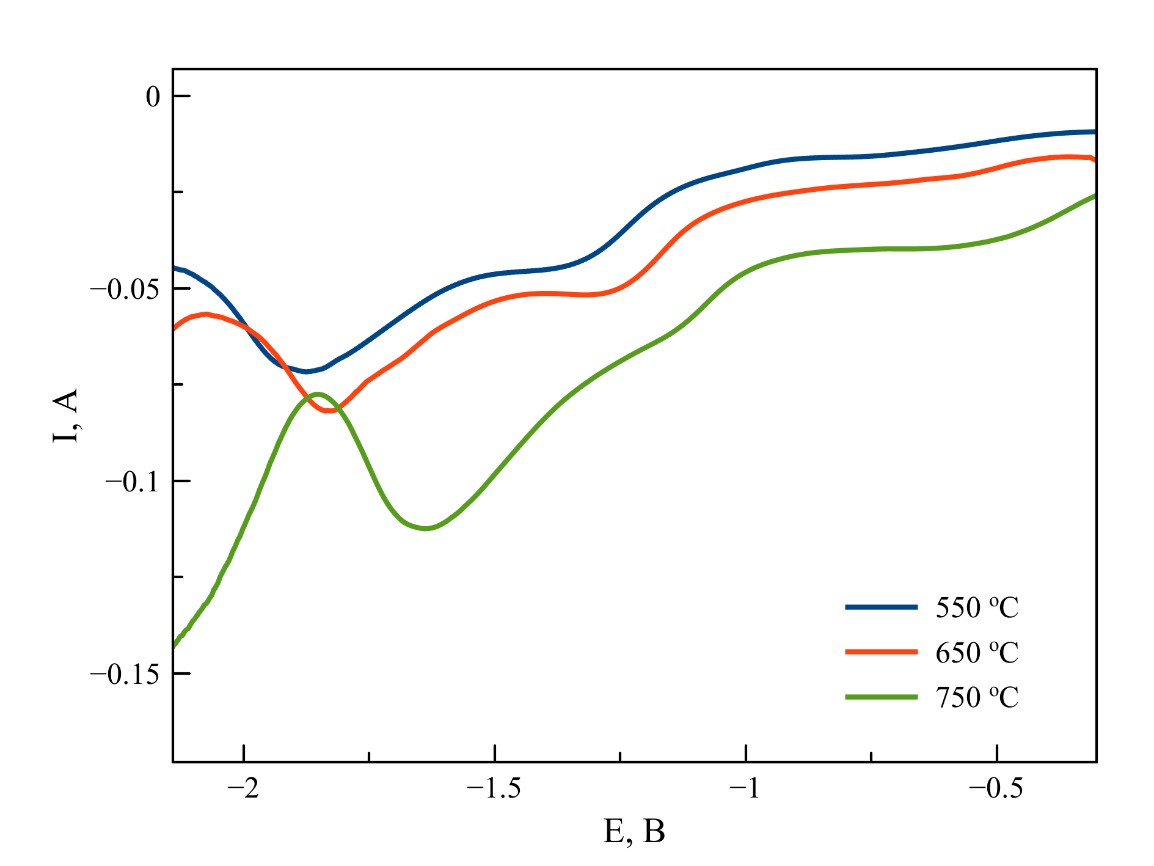
Рисунок 5 - Квадратно-волновые вольтамперограммы, зарегистрированные в расплаве на основе NaCl–2CsCl с концентрацией K2ZrF6 2 масс. %. T = 550, 650, 750 ℃
Примечание: частота импульсов при поляризации рабочего электрода 60 Гц
Таблица 1 - Влияние температуры на потенциал катодного пика восстановления ионов циркония в расплавах на основе эвтектической смеси NaCl–2CsCl
T, ℃ | Ep по ЦВА, В | Ep по ДИВА, В | Ep по КВВА, В |
550 | –1,92 | –1,83 | –1,87 |
650 | –1,69 | –1,78 | –1,83 |
750 | –1,54 | –1,59 | –1,64 |
После оценки влияния температуры было исследовано влияние концентрации гексафтороцирконата калия на электрохимическое поведение циркония в расплаве NaCl–2CsCl. Были зарегистрированы вольтамперограммы в расплавах на основе эвтектической смеси NaCl–2CsCl с концентрацией гексафтороцирконата калия равной 1, 2 и 3 масс. % при 550 ℃ (см. рис. 6, рис. 7, рис. 8).
По полученным циклическим вольтамперограммам (рисунок 6) можно сделать вывод, что повышение концентрации ионов циркония приводит к закономерному увеличению пикового значения силы тока процессов восстановления и окисления, что согласуется с уравнением Рэндлса-Шевчика:
где n – число электронов, F – постоянная Фарадея, C0 – концентрация электроактивной формы, S – площадь поверхности рабочего электрода, D – коэффициент диффузии электроактивной формы, v – скорость поляризации рабочего электрода, R – универсальная газовая постоянная, T – абсолютная температура.
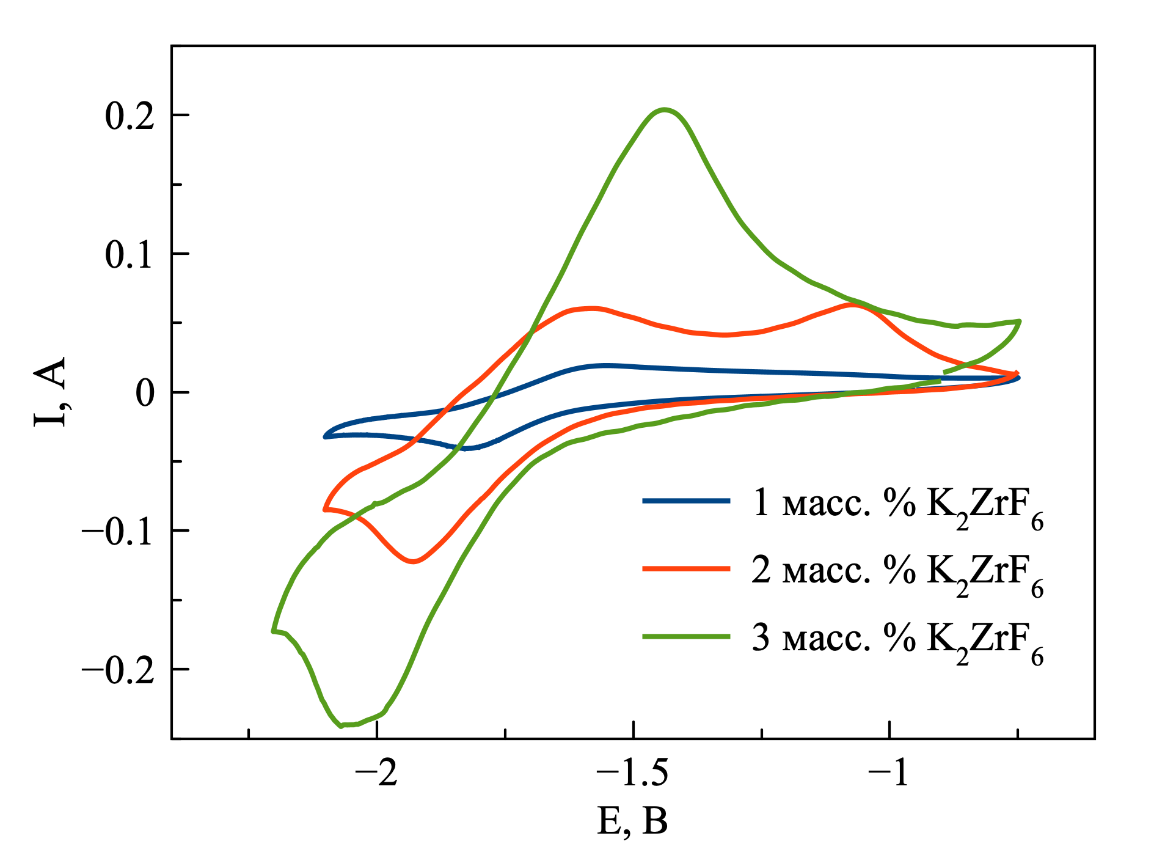
Рисунок 6 - ЦВА, зарегистрированные в расплаве на основе NaCl–2CsCl с различной концентрацией K2ZrF6, T = 550 ℃
Примечание: скорость развёртки потенциала100 мВ/сек
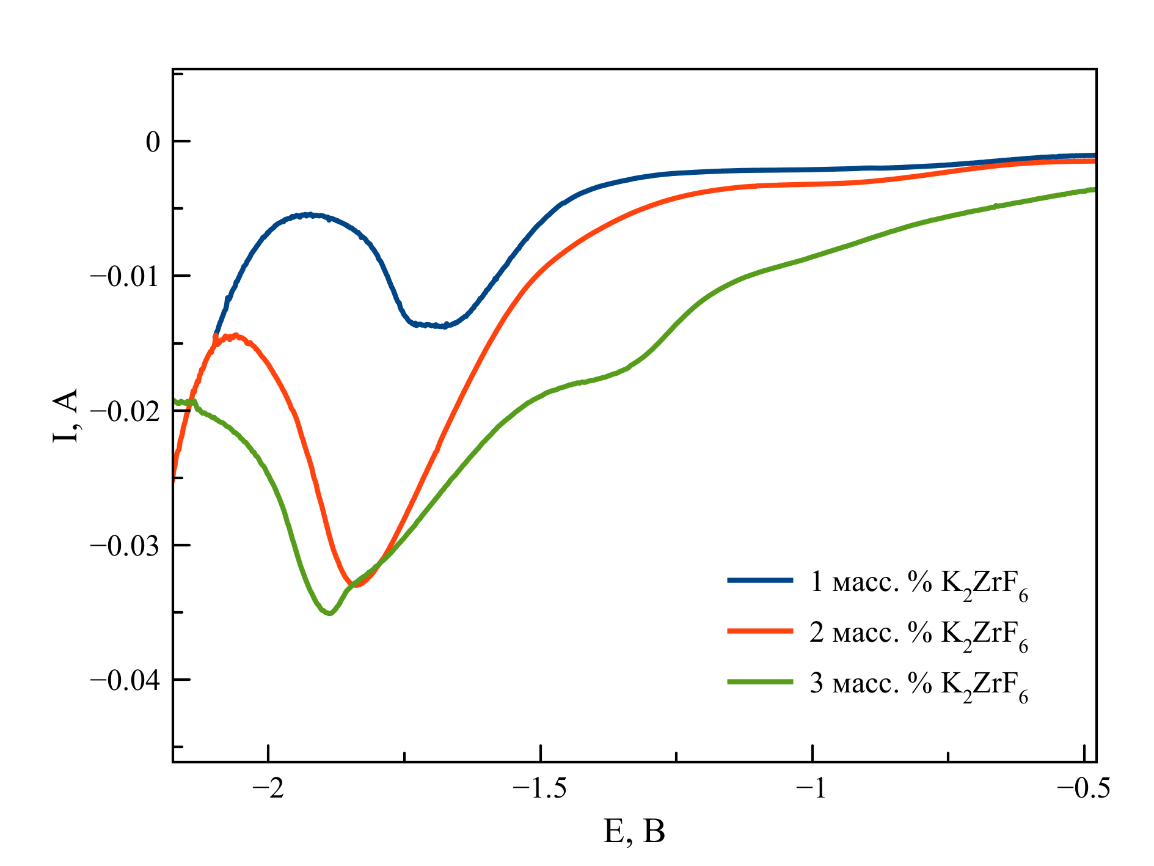
Рисунок 7 - ДИВА, зарегистрированные в расплаве на основе NaCl–2CsCl с различной концентрацией K2ZrF6
Примечание: T = 550 ℃
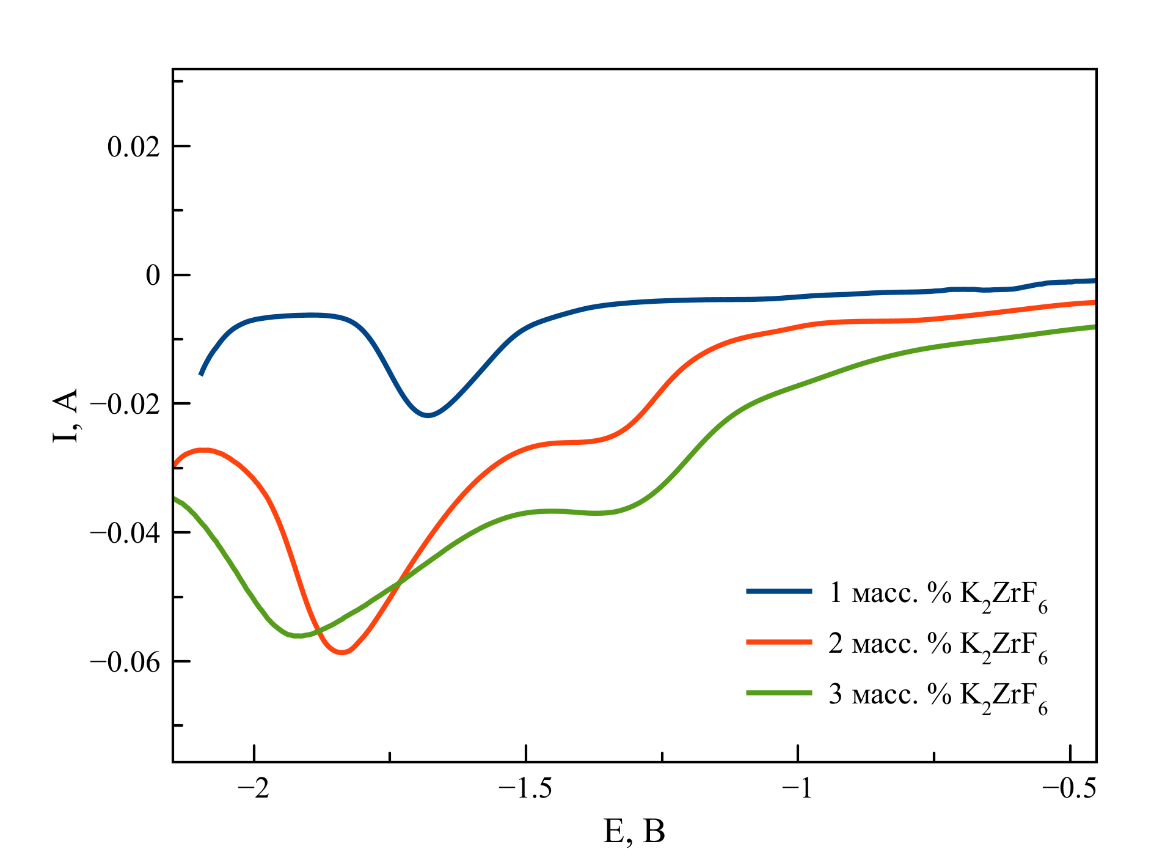
Рисунок 8 - КВВА, зарегистрированные в расплаве на основе NaCl–2CsCl с различной концентрацией K2ZrF6
Примечание: T = 550 ℃
Таблица 2 - Влияние концентрации фтороцирконата калия на Значения потенциала процессов восстановления в расплавах на основе эвтектической смеси NaCl–2CsCl
С (K2ZrF6), масс. % | Ep по ЦВА, В | Ep по ДИВА, В | Ep по КВВА, В |
1 | –1,82 | –1,69 | –1,68 |
2 | –1,92 | –1,83 | –1,84 |
3 | –1,99 | –1,89 | –1,92 |
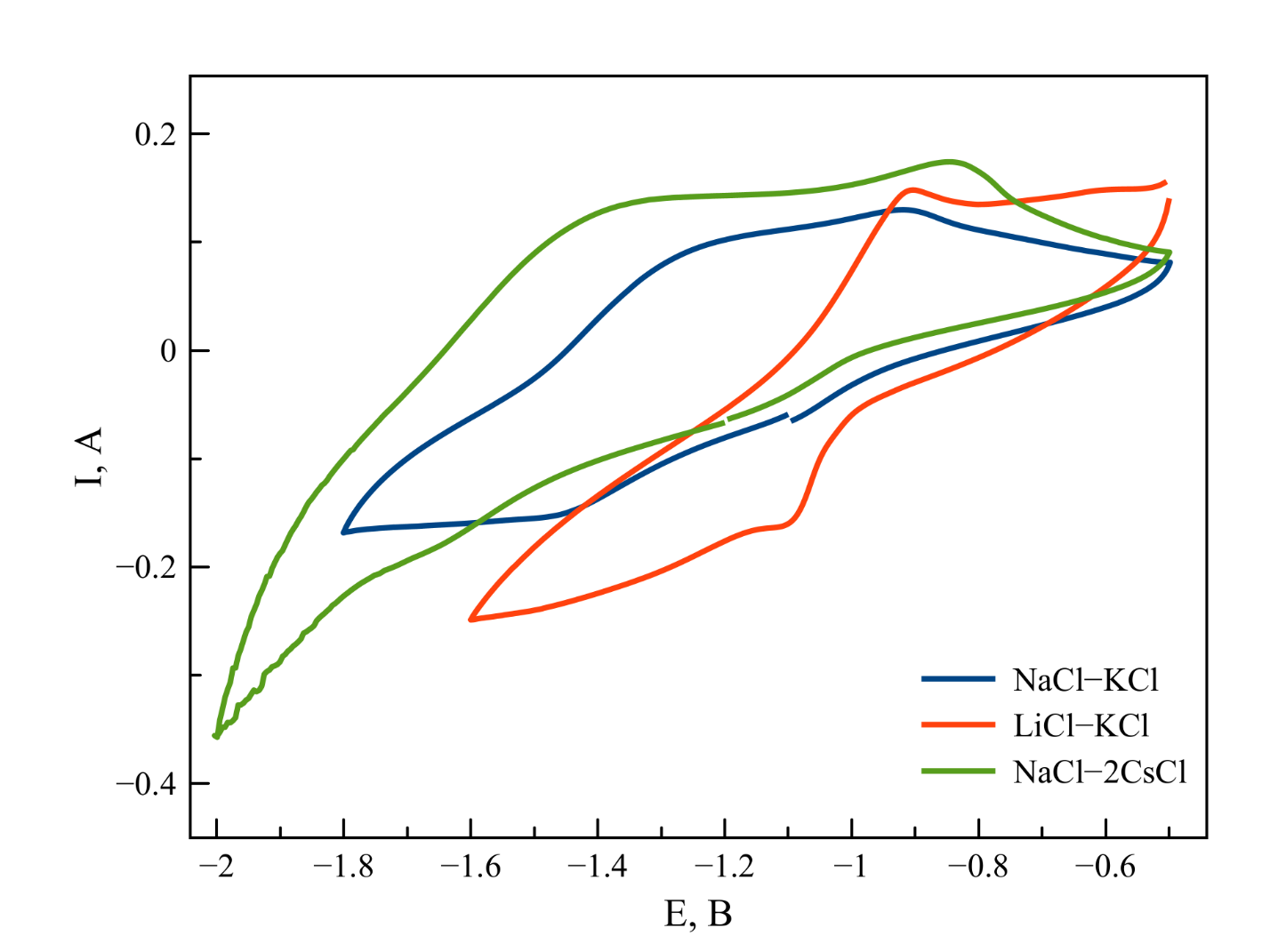
Рисунок 9 - ЦВА, зарегистрированные в хлоридных расплавах, содержащих фтороцирконат калия при 750 ℃
Примечание: скорость развертки потенциала 60 мВ/с
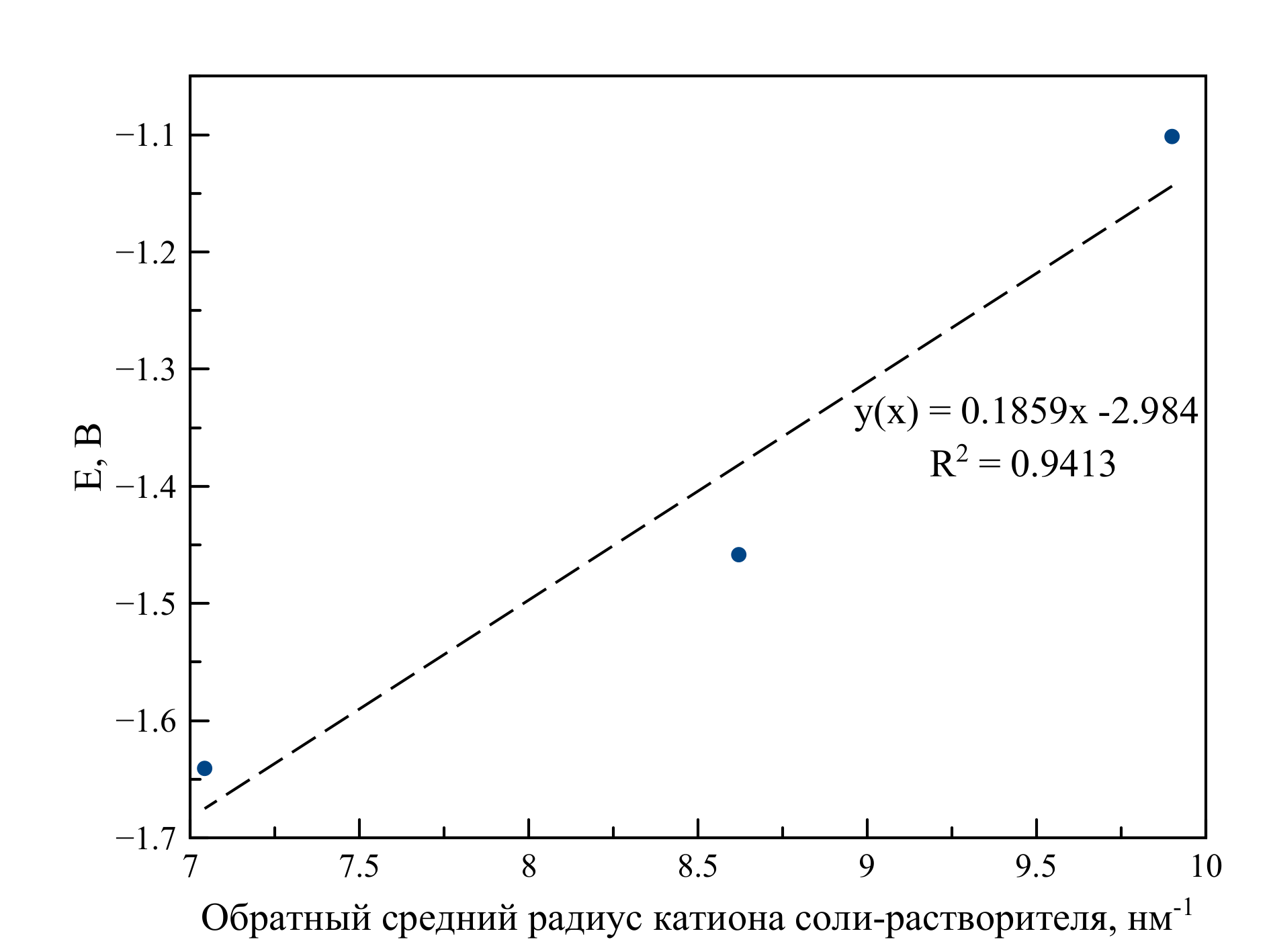
Рисунок 10 - Зависимость значения максимума потенциала пика, соответствующего процессу восстановления Zr(IV)/Zr(0), от обратного среднего радиуса катиона соли-растворителя при 750 ℃
Таблица 3 - Радиусы ионов щелочных металлов по Гольдшмиту и значения Ep для процессов восстановления Zr(IV)/Zr(0) в различных хлоридных расплавах при температуре 750 ℃
Ион | Радиус* катиона по Гольдшмиту, нм | Обратный радиус, нм-1 | Ep, В |
Индивидуальные соли | |||
LiCl | 0,078 | 12,82 | – |
NaCl | 0,098 | 10,20 | – |
KCl | 0,133 | 7,52 | – |
CsCl | 0,165 | 6,06 | – |
Эвтектические смеси | |||
LiCl–KCl | 0,101 | 9,89 | –1,1015 |
NaCl–KCl | 0,116 | 8,66 | –1,4584 |
NaCl–CsCl | 0,142 | 7,03 | –1,6408 |
Примечание: средний радиус катиона для эвтектических смесей
4. Заключение
В ходе работы было оценено влияние добавки фторид-ионов на электрохимическое поведение циркония в хлоридных расплавах. Установлено, что введение ионов циркония в систему в виде гексафтороцирконата калия приводит к значительному смещению потенциала восстановления циркония в отрицательную область.
Исследовано влияние температуры, концентрации и среднего радиуса катиона соли-растворителя на значение потенциала восстановления ионов циркония. При повышении температуры потенциалы восстановления циркония смещаются в область положительных значений. В случае повышения концентрации данные потенциалы смещаются в область отрицательных значений. При увеличении среднего радиуса катиона соли-растворителя происходит смещения потенциалов восстановления в область отрицательных значений.
