Complex Rehabilitation of Patients with Chronic Generalized Periodontitis Associated with Comorbid Pathology
Complex Rehabilitation of Patients with Chronic Generalized Periodontitis Associated with Comorbid Pathology
Abstract
Chronic generalized periodontitis is still quite a prevalent pathology (at 12 years – 48.2%; 44 years – 86.2%; 60–65 years – 100%) and takes a leading place in the structure of dental morbidity and is a symptom of comorbid pathology. The aim of the study was a clinical and laboratory substantiation of multistrain synbiotic in the algorithm of the complex treatment of moderately severe chronic generalized periodontitis, associated with the pathology of the gastrointestinal tract. Complex examination of 69 patients of both genders in the age category from 18 to 65 years (35 women and 34 men) with moderately severe chronic generalized periodontitis (CGP) was carried out. All patients were divided into three groups depending on somatic pathology and treatment regimen: Group 1 (control) – 32 patients of both genders (15 women and 17 men), Group 1 – 35 patients of both genders (18–65 years old), Group 1 – 35 patients (18–65 years old and 34 men), Group 2 – 35 patients (19 women and 36 men), Group 3 – 35 patients (19 women and 36 men). Both men and women (15 women and 17 men) – with chronic generalized parodontitis of medium severity, without general somatic pathology, receiving standard therapy according to the clinical guidelines; Group 2 – 18 people of both genders (11 women and 7 men), patients with GIT pathology, CGP of medium severity, receiving standard therapy; Group 3 – 19 patients of both genders (9 women and 10 men), patients with gastrointestinal pathology, CGP of moderate degree of severity who received in addition to standard treatment orally and locally the author's immobilized multistrain synbiotic. All patients underwent standard periodontal examination before, immediately after and 6 months after treatment. Additionally, the determination of qualitative and quantitative composition of the colonic microbiome (unified method fecal examination, 138 samples) and periodontal pockets (138 samples) was carried out in dynamics twice before and after the treatment at an interval of 6 months. The results obtained confirm the efficacy of complementing the standard scheme of treatment of patients with chronic generalized periodontitis, with concomitant diseases of the GIT, with systemic application of the author's immobilized synbiotic "LB-complex L", to achieve a stable remission.
1. Введение
Несмотря на усилия мирового медицинского сообщества в борьбе за соматическое здоровье, в настоящее время наблюдается тенденция к росту коморбидной патологии, течение которой усугубляет, в том числе, и стоматологическая патология. В частности, большим количеством клинических исследований доказано наличие взаимосвязи между патологией пародонта и заболеваниями ЖКТ . Системные нарушения внутренней среды организма играют важную роль в патогенезе генерализованного пародонтита. Доказано, что морфологическая близость в строении тканей пародонта и пищеварительной системы, особенности иннервации и гуморальной регуляции, нарушения баланса микробиома способствуют вовлечению тканей пародонта в патоформологический процесс при заболеваниях ЖКТ. При этом отмечается, что тяжесть течения пародонтита напрямую зависит от тяжести патологического процесса со стороны желудочно-кишечной системы, и наоборот. Хронической патологии ЖКТ, как правило, сопутствует развитие дисбиозов различной степени тяжести, что сопровождается метаболическими и иммунными нарушениями, дефицитом витаминов, минеральных элементов, белков и т.д., и способствует поддержанию воспалительных процессов в пародонте и усугубляет тяжесть его течения , . При лечении патологических процессов желудочно-кишечного тракта в современных условиях стандартные методы купирования воспаления не всегда эффективны, периоды ремиссии носят краткосрочный характер и имеют тенденцию к утяжелению процесса. Новые перспективы в достижении стойкого результата при лечении пародонтитов, ассоциированных с ЖКТ-патологий открывает использование препаратов с пробиотическим механизмом действия, являясь наиболее физиологичными и эффективными в лечении дисбиозов. Поэтому поиск методов патогенетической терапии ХГП у данной группы пациентов является обоснованным и требует дальнейшего изучения.
Цель исследования: клинико-лабораторное обоснование применения мультиштаммового симбиотика в алгоритме комплексного лечения хронического генерализованного пародонтита средней степени тяжести на фоне патологии желудочно-кишечного тракта.
2. Методы и принципы исследования
В нашем исследовании проводилось комплексное обследование и лечение 69 пациентов обоего пола в возрастной категории от 18 до 65 лет (35 женщин и 34 мужчин) с хроническим генерализованным пародонтитом (ХГП) средней степени тяжести. В зависимости от наличия патологии желудочно-кишечного тракта и разных схем лечения заболеваний пародонта они были разделены на три группы:
1 группа – 32 чел обоего пола (15 женщин и 17 мужчин) – с хроническим генерализованным пародонтитом средней степени тяжести, без общесоматической патологии (контроль);
2 группа – 18 человек (11 женщин и 7 мужчин) – с патологией ЖКТ, ХГП средней степени тяжести, получающие стандартную терапию;
3 группа – 19 человек (9 женщин и 10 мужчин) – с патологией ЖКТ, ХГП средней степени тяжести, получающие дополнительно к стандартной терапии перорально и местно авторский иммобилизированный мультиштаммовый синбиотик «LB – комплекс Л» (патент №2441907, приоритет от 29.07.2010, СГР RU.77.99.88.003.Е.002.522.06.18), по разработанной нами технологии (патент «Способ лечения хронического генерализованного пародонтита средней степени тяжести у пациентов с коморбидной патологией» Заявка № 2022105563, 01.03.2022). (Рис. 1)
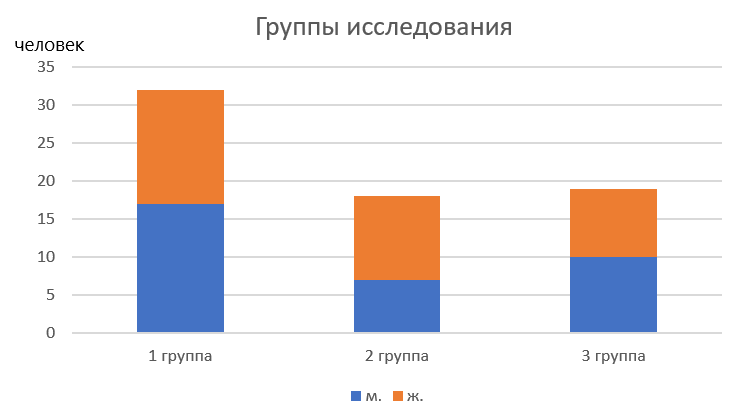
Рисунок 1 - Группы исследования
Кроме того, объектом нашего внимания с целью визуализации микробиома, его качественного и количественного состава, явились пробы с содержимым пародонтальных карманов (138) и оценка состояния микробиоты толстой кишки, которая определялась при исследовании кала по унифицированной методике (138). Оценка проб проводилась в динамике дважды до и после лечения через 25 дней.
Амбулаторное обследование, лечение и реабилитация пациентов проводилась на базе кафедры стоматологии ФДПО ФГБОУ ВО ПИМУ МЗ РФ. Исследование качественного и количественного состава микробиоты ЖКТ и пародонтального кармана проводилось на базе лаборатории микробиома человека и средств его коррекции ФБУН ННИИЭМ им. академика И.Н. Блохиной Роспотребнадзора (Соловьева И.В.).
Стоматологическое обследование и лечение пациентов проводилось в соответствии с клиническими рекомендациями (протоколами лечения) при диагнозе пародонтит (Утверждены Решением Совета Ассоциации общественных объединений «Стоматологическая Ассоциация России» 23 апреля 2013 года с изменениями и дополнениями на основании Постановления № 18 Совета Ассоциации общественных объединений «Стоматологическая Ассоциация России» от 30 сентября 2014 года, актуализированы 02 августа 2018 года). Для индексной оценки гигиенического статуса определялся суммарный упрощенный индекс гигиены Грина-Вермиллиона (OHI-S), для определения состояния пародонта использовали авторский ассоциированный пародонтальный индекс (АПИ – Архангельская Е.П., 2020), основанный на одновременном определении нескольких факторов, характеризующих тяжесть течения: воспаление, кровоточивость, глубина пародонтального кармана, степень подвижности зубов, рецессия десны.
Оценка состояния пародонта проводилась на этапе обследования, сразу после проведенного амбулаторного этапа лечения и через 6 мес.
Разработанная методика забора содержимого пародонтального кармана реализовывалась с помощью одноразовой стерильной бактериологической петли, введенной в пародонтальный карман после полного обследования и установки диагноза (до проведения профессиональной гигиены). Полученный материал помещался в пробирки Eppendorf с 0,09 мл буферного раствора по Хенелю (для разведения 10-2), затем петлю помещали в стерильную пробирку с анаэробной средой для транспортировки и доставляли в лабораторию в течении 2-х часов. Разведение материала 10-2 высевали на пластинчатые среды (Шоколадный агар, агар Эндо ГРМ, Энтерококк агар, питательную среду №2 (Сабуро) производства ФБУН ГНЦ МПБ Роспотребнадзора, г. Оболенск) и проводили инкубацию в аэробных условиях при температуре 37+10С в течение 24-48 часов. Также производили высев на пластинчатые среды Шедлера (BBLTM Schaedler agar, производства Becton Dickison, USA), Сlostridial agar (M497 HiMedia Laboratories Pvt. Limited, Индия) и агар МРС-4 (НИЦФ, Санкт-Петербург).
С анаэробной среды делали посев тампоном с селективной добавкой для анаэробов на пластинчатую питательную среду с желчью и эскулином– Bacteroides Bile Esculin Agar (M805; FD062 HiMedia Laboratories Pvt. Limited, Индия), среду Шедлера, Клостридиум агар и МРС-4. Инокуляты инкубировали в анаэробных условиях при температуре 37+10С в течение 72-96 часов. Инкубацию проводили в анаэробоксах с системами GasPak Anaerobe Gas Generation Pouch System with Indicator (Becton Dickinson, USA).
После проведения инкубации отдельно на секторах подсчитывались и идентифицировались выросшие колонии, опознавание выросших культур проводилось методом масс-спектрометрии (масс-спектрометр Autoflex speed Bruker, программный комплекс Biotyper). Метод позволяет идентифицировать в исследуемых образцах специфические маркеры, жировые компоненты микробной стенки, являясь высоко чувствительным, экспрессным, универсальным, с широким спектром диагностических возможностей. По видоспецифичности сходен с генетическим анализом.
Местное лечение ХГП заключалось в проведении профессиональной гигиены полости рта и зубов, обучении и контроле индивидуальной гигиены полости рта, удалении над- и поддесневых зубных отложений, закрытом кюретаже пародонтальных карманов с последующей медикаментозной обработкой (0,05% раствором хлоргексидина, пленка «Диплен дента» с солкосерилом), избирательном пришлифовывании зубов. Медикаментозная терапия включала в себя применение местных анестетиков, антигистаминных препаратов, нестероидных противовоспалительных и общеукрепляющих лекарственных средств.
3-я группа пациентов дополнительно к стандартной, утвержденной методике лечения в качестве системной и местной терапии пародонтальных карманов получала «LB – комплекс Л», который является пробиотиком 4-го поколения и представляет собой консорциум живых антогонистических активных штаммов бифидо- (3 штамм) и лактобактерий (3 штамма), иммобилизированных на энтеросорбенте цеолите.
Курс перорального применения «LB – комплекса Л» включает 25 дней по 10 мл в сутки на 1 или 2 приема, местно применение в амбулаторных условиях осуществлялось путем введения препарата в пародонтальный карман при помощи шприца в объеме 0,1 – 0,2 мл, с последующим заклеиванием пленкой «Диплен дента», курсом 14 дней.
Методы исследования: клинический, микробиологический, аналитический и статистический.
3. Результаты и обсуждение
Результаты осмотра и первичного клинического обследования всех пациентов свидетельствуют о неудовлетворительном уровне гигиены полости рта: суммарный индекс гигиены составил в 1 гр. – 3,8±0,03; 2 гр. – 4,2±0,06; 3 гр. – 4,3±0,04.
Сразу после проведенного пародонтологического лечения определялись следующие показатели суммарного индекса гигиены: 1 гр. – 0,75±0,07; 2 гр. – 0,8±0,08; 3 гр. – 0,85±0,08, что соответствует хорошему уровню гигиены полости рта.
Через 6 месяцев определяется следующие уровни гигиены: 1 гр. – 1,5±0,06; 2 гр. – 1,8±0,07; 3 гр. - 1,2±0,03, что соответствует удовлетворительному уровню гигиены, при этом можно отметить сохранение лучшего уровня гигиены в группе пациентов с ХГП средней степени тяжести после применения «LB – комплекс Л».
Авторский ассоциированный пародонтальный индекс (АПИ) до начала лечения в контрольной группе составил 8,9±0,12 баллов, во второй 8,7±0,09 и 9,2±0,13 в третьей группах, что соответствует средней степени тяжести патологического процесса в пародонте с выраженным воспалительным элементом. Непосредственно после проведенного клинического этапа лечения отмечается снижение индекса во всех группах: 1 гр. – 7,5±0,07; 2 гр. - 7,6±0,05 и 3 гр. - 7,3±0,12, при этом субъективно можно отметить, что в группе с применением «LB – комплекс Л» при терапии пародонтальных карманов, воспалительные явления нивелируются раньше, чем в других группах при стандартной методике лечения. Через 6 мес. после проведенного лечения АПИ составил: в первой группе 6,8±0,09, во 2 группе– 7,1±0,05, в то время как в группе пациентов, принимающих «LB – комплекс Л» выраженное снижение показателей до 6,6±0,09 баллов, приближаясь к нижней границе показателя для пародонтита средней степени тяжести, что может являться признаком отсутствия, либо незначительно выраженного воспаления (Таб. 1).
Таблица 1 - Индексная оценка состояния тканей пародонта
| 1 группа | 2 группа | 3 группа | ||||||
до | после | 6 мес. | до | после | 6 мес. | до | после | 6 мес | |
ИГ | 3,8±0,03 | 0,75±0,07 | 1,5±0,06 | 4,2±0,06 | 0,8±0,08 | 1,8±0,07 | 4,3±0,04 | 0,85±0,08 | 1,2±0,03 |
АПИ | 8,9±0,012 | 7,5±0,07 | 6,8±0,09 | 8,7±0,09 | 7,6±0,05 | 7,1±0,05 | 9,2±0,13 | 7,3±0,12 | 6,6±0,09 |
До начала терапии во второй и третьей группах при исследовании микрофлоры толстого кишечника у 93,75% обследованных обнаружен дисбиоз: 1 степени – 43,75%; 2 степени – 37,5%; 3 степени – 12,5%; у пациентов 1 группы единичные случаи дисбиоза 1 степени.
В 100% случаев у пациентов всех трех групп в микробиоте фекалий обнаруживаются бифидобактерии, но у пациентов с патологией ЖКТ и ХГП в 79% случаев отмечается снижение их количества до 106-107КОЕ/мл. Чаще всего определялись B.longum (75,6%), B.adolescentis (62,1%), B.bifidum (33,6%). Редко в посевах определялись B.dentium, B.pseudocatenulatum, B.animalis, B.catenulatum, B.angulatum.
Лактобактерии определены у 71% пациентов, при этом в 37% случаев их количество меньше 107КОЕ/мл, при том что в 29% случает лактобактерии не определялись, что соответствует дисбиозу 3-4 степени. Чаще всего встречаются L.gasseri (45,8%), L.paracasei и L. vaginalis (29,1%) L.oris (25%), L.crispatus и L.salivarius (20,8%).
Бактероиды высевались у 92, % пациентов в сниженных количествах. С наибольшей частотой выделялись B. uniformis и B.ovatus (33,3%), B.vulgatus и B.thetaiotaomicron (25%).
У пациентов всех трех групп обнаруживается E.coli, при этом во второй и третьей группа с патологией ЖКТ отмечается снижение количества до 106 КОЕ/мл и менее в 48% случаев. Отмечаются единичные случаи выявления лактозонегативных кишечных палочек.
Энтерококки обнаруживались у пациентов в 50% случаев (105-108КОЕ/мл). Чаще всего из фекалий выделялись E.faecalis (33,3%) и Е.faecium (16,6%). У 52,6% обследованных пациентов были выделены различные виды клостридий, количество которых не превышало 10 КОЕ/мл, что также соответствовало показателям нормы. В единичных случаях обнаружены в повышенных количествах C.innocuum (106 КОЕ/мл) и C.perfringens (107 КОЕ/мл). У 12,5% пациентов обнаруживался S.aureus. У 41,2% были выделены коагулазонегативные стафилококки, причем у 12,5% в значимых количествах – более 105 КОЕ/мл. Условно-патогенные микроорганизмы порядка Enterobacterales в значимых количествах (>105 КОЕ/мл) обнаруживались у 45,8% пациентов 2 и 3 групп, с наибольшей частотой выделялись Enterobacter cloaceae (16,6%) и Klebsiella pneumoniae (12,5%). В меньших количествах и с меньшей частотой выделялись Proteus mirabilis, M.morganii, Raoultella ornithinolytica, Citrobacter freundii. Дрожжеподобные грибы рода Candida обнаруживались в микробиоте просвета толстой кишки у 70,8% обследованных. В наибольших количествах (105-107 КОЕ/мл) выделялись C.kefyr, C.lusitaniae. C.albicans обнаруживались с большей частотой – в 54,2%, — но в меньшем количестве: 102-104 КОЕ/мл. В значительном количестве (106-107КОЕ/мл) обнаруживались стрептококки различных видов: S.lutetiensis, S.pleomorphus, S.salivarius, S.sanguinis, S.gallolyticus, S.vestibularis, S.parasanguinis, а также Collinsella aerofaciens, Eggerthella lenta, Streptomyces lavendulae.
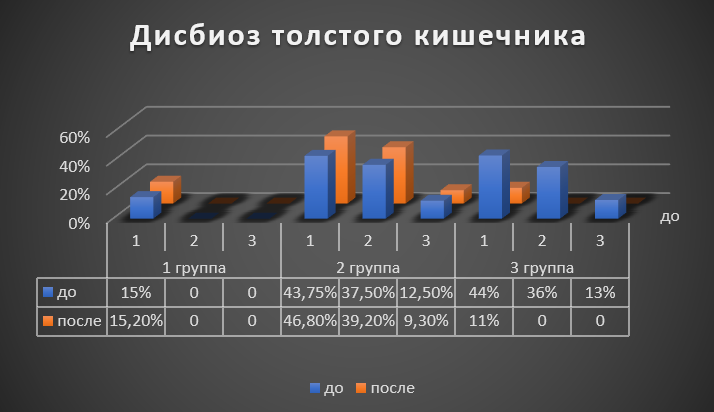
Рисунок 2 - Дисбиоз толстого кишечника
Нейссерии выделялись у 89% пациентов в количестве 103-106 КОЕ/мл., чаще всего N.mucosa (33,3%), N.flavescens и N.elongata (29,1%), N.macacae (25%). Идентифицирован 21 вид рода Streptococcus: S.oralis (83,3%), S.sanguinis (66,6%), S.vestibularis (62,5%), S.pneumoniae (58,3%), S.anginosus (54,1%), S.salivarius (50%). В количестве 107 КОЕ/мл обнаруживались S.sanguinis, S.cristatus, S.psudopneumoniae, S.gordonii. Лактобактерии (17 видов) выделялись в количестве 103 КОЕ/мл., чаще встречались L.gasseri (25%), L.paracasei (16,6%), L.oris (12,5%). Дрожжеподобные грибы рода Candida выделялись у 25% обследованных в количествах 105-107 КОЕ/мл. Veillonella обнаруживались у 96% пациентов. Из микроорганизмов рода Actinomyces преимущественно выделялись A.naeslundii (37,5%), A.odontolyticus (29,2%), A.oris (25%), количество которых определялось в диапазоне – от 10 до 107 КОЕ/мл. В 45,8% случаев из отобранных образцов были выделены Fusobacterium nucleatum в количестве 103-105 КОЕ/мл.
Общее состояние микробиоты пародонтального кармана до лечения во всех группах в 100% случаев определялись нарушения микробного состава, которые характеризовались дисбиозом 1 степени в 28,6%, 2 степени – 28,6%, 3 степени – 42,8%.
Через 25 дней после начала наблюдений в первой и второй группах наблюдения нормализация микробиоциноза лишь у 14,5% пациентов, в остальных случаях отмечалось улучшение состояния микрофлоры до 1 (62%) и 2 (23,5%) степеней, дисбиоз 3 степени не обнаруживался.
В третьей группе пациентов, получавших в процессе терапии «LB – комплекс Л» дисбиотические нарушения содержимого зубо-десневого кармана 1 степени выявлены лишь у 24% пациентов (имеющих ранее 3 степень дисбиоза), а в 76% случаев показатели соответствовали норме. Так, отмечалось существенное снижение содержания стафолококков: S.aureus обнаруживался в 10,5% случаев в количестве не превышающем 104 КОЕ/мл; коагулазонегативные стафилококки S.capitis и S.epidermidis в количестве 103 -104 КОЕ/мл. В видовой структуре нейссерий преобладающими по частоте выделения стали N.flavescens (42,1%), N.mucosa (26,3%), N.elongata (26,3%). Частота выделения стрептококков незначительно уменьшилась: S.oralis выделялся у 73,6% пациентов, S.pneumoniae – у 68,4%, S.salivarius и S.vestibularis – у 63,1%, S.anginosus – у 47,3%, S.sanguinis - у 42,1%. Количество выделяемых стрептококков колебалось от 10 до 106 КОЕ/мл. В отделяемом зубодесневого кармана возросла численность видов лактобацилл, выделяемых в количестве 105-106 КОЕ/мл. После проведенного лечения только у 5,2% пациентов в исследуемом субстрате обнаруживались единичные клетки C.albicans. Другие представители рода Candida не выявлялись. Количество выделяемых актиномицет не превышало 106 КОЕ/мл. Selenomonas spp. после лечения обнаруживался в 42,1% случаев в количестве 105-107 КОЕ/мл. После лечения снизилась частота и количество выделения Capnocytophaga spp.
До начала лечения во второй и третьей группах пациентов с хроническим генерализованным пародонтитом средней степени тяжести при наличии патологии желудочно-кишечного тракта сочетанный дисбиоз содержимого зубо-десневого кармана и кишечника выявлен у 83,3% пациентов, у 16,6% обнаружен дисбиоз зубодесневого кармана на фоне нормальной микробиоты кишечника. После проведенного лечения во второй группе общий микробиоциноз нормализовался только у 14,5% обследованных, про этом в третьей группе наблюдений полное восстановление отмечалось у 73,6% при наличии общей положительной динамики восстановления микрофлоры (Рис. 3).
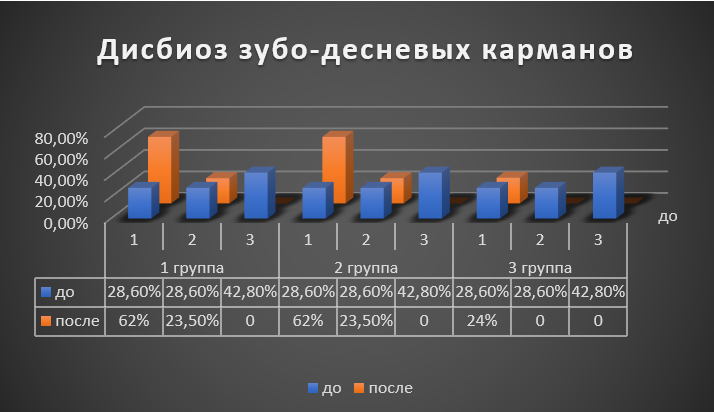
Рисунок 3 - Дисбиоз пародонтальных карманов
4. Заключение
Дополнение стандартной схемы лечения пациентов с хроническим генерализованным пародонтитом, сочетанным с заболеваниями ЖКТ, системным применением авторского иммобилизованного синбиотика «LB-комплекс Л» позволяет добиться стойкой ремиссии, снижения воспалительного компонента при нивелировании влияния микрофлоры на течение пародонтита.
