DEVELOPMENT AND VALIDATION OF HPLC-MS / MS METHODS FOR QUANTITATION OF PROSTANIT AND ITS METABOLITES IN RAT BLOOD PLASMA
РАЗРАБОТКА И ВАЛИДАЦИЯ ВЭЖХ-МС/МС МЕТОДИКИ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ПРОСТАНИТА И ЕГО МЕТАБОЛИТОВ В ПЛАЗМЕ КРОВИ КРЫС
Научная статья
Шестакова К.М.1, *, Москалева Н.Е.2, Месонжник Н.В.3, Апполонова С.А.4, Пятигорская Н.В.5
1-5 Первый Московский государственный медицинский университет им. И.М. Сеченова, Москва, Россия
* Корреспондирующий автор (ksenia.shestakova[at]labworks.ru)
АннотацияПростанит является новым лекарственным средством, направленным на лечение заболеваний периферических артерий. По химической структуре он представляет собой простагландин Е1, модифицированный динитроглицероловым эфиром. Целью данной работы являлось создание и валидация методики количественного определения простанита и его основных метаболитов в плазме крови крыс и ее дальнейшее применение для установления основных фармакокинетических параметров исследуемого лекарственного средства.
Методика количественного определения простанита и его метаболитов выполнялась с использованием высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией. Оценка пригодности методики проводилась по следующим валидационным характеристикам: селективность, нижний предел количественного определения, линейность, правильность, прецизионность, эффекты матрицы, степень извлечения, перенос пробы, стабильность в биологической матрице на протяжении всего периода хранения и в условиях обработки. Фармакокинетическое исследование простанита выполняли на шести крысах, которым внутрибрюшинно вводили раствор исследуемого лекарственного средства в дозе 100 мкг/кг. Разработанная методика полностью удовлетворяла требованиям валидации. Были выявлены основные фармакокинетические параметры продуктов биодеградации простанита, 1,3-динитроглицерола и 13,14-дигидро-15кето-ПГЕ1. Полученные результаты являются актуальными для их использования в процессе доклинического исследования нового лекарственного средства простанит.
Ключевые слова: Простагландины, мультитаргетные лекарственные средства, валидация, масс-спектрометрия, фармакокинетика.
DEVELOPMENT AND VALIDATION OF HPLC-MS / MS METHODS FOR QUANTITATION OF PROSTANIT AND ITS METABOLITES IN RAT BLOOD PLASMA
Research article
Shestakova K.M.1, *, Moskaleva N.E.2, Mesonzhnik N.V.3, Appolonova S.A.4, Pyatigorskaya N.V.5
1-5 I.M. Sechenov First Moscow State Medical University, Moscow, Russia
* Corresponding author (ksenia.shestakova[at]labworks.ru)
AbstractProstanit is a new drug aimed at treating diseases of peripheral arteries. According to its chemical structure, it is prostaglandin E1 modified with dinitroglycerol ether. The aim of the study was to create and validate a method for the quantitation of prostanit and its main metabolites in rat blood plasma and its further application to establish the main pharmacokinetic parameters of the drug under study.
The method of quantitation of prostanit and its metabolites was performed using high-performance liquid chromatography in combination with tandem mass spectrometry. The suitability of the method was evaluated according to the following validation characteristics: selectivity, lower level of quantification, linearity, correctness, precision, matrix effects, recovery rate, sample transfer, stability in the biological matrix throughout the entire storage period, and under processing conditions. The pharmacokinetic study of prostanit was performed on six rats, which were intraperitoneally injected with a solution of the drug at a 100 mcg/kg dose. The developed method fully met the requirements of validation. The main pharmacokinetic parameters of prostanit, 1,3-dinitroglycerol and 13,14-dihydro-15-keto-PGE1 biodegradation products were identified in the course of the research. The results obtained are relevant for use in the process of preclinical research of prostanit.
Keywords: Prostaglandins, multi-target drugs, validation, mass spectrometry, pharmacokinetics
ВведениеРазрабатываемое лекарственное средство простанит является новым лекарственным веществом (ЛВ), направленным на лечение заболеваний периферических артерий [1]. Являясь мультифункциональным ЛВ, простанит одновременно воздействует на несколько патогенных мишеней в области одной патологии при условии, что данная синхронизация обладает единой направленностью [2].
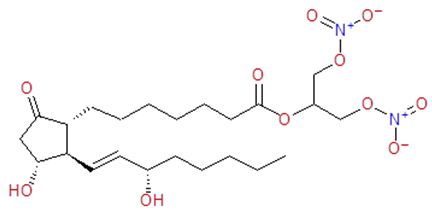
По химической структуре простанит состоит из простагландина Е1 (ПГЕ1), модифицированного динитроглицероловым эфиром (см. рисунок 1). Оба компонента простанита оказывают плейотропное действие, воздействуя на патологические процессы в периферических артериях. Таким образом, простанит является про-лекарством одновременно для ПГЕ1 и оксида азота.
Рис.1 − Химическая структура простанита
На сегодняшний день лекарственные препараты, содержащие ПГЕ1 (альпростадил и его аналоги), повсеместно используются для лечения заболеваний периферических артерий [3], [4]. ПГЕ1 оказывает вазодилатирующий эффект, тем самым улучшая ток крови в ишемических тканях и увеличивая доставку кислорода к ним [5], [6]. Тем не менее, ранее были получены данные о побочных эффектах применения лекарственных препаратов на основе ПГЕ1, преимущественно связанных с тяжелыми ишемическими поражениями конечностей, что значительно ограничивало их применение [7].
Ранее было показано, что простанит способствует образованию оксида азота в клетках гладкой мускулатуры одновременно за счет активации NO-ситазы и действия высвобождающегося оксида азота [8]. Таким образом, за счет образования оксида азота в стенках сосудов простанит может применяться для лечения и профилактики хронических облитерирующих заболеваний периферических сосудов, чаще всего ассоциированных с повреждением эндотелия сосудов, стенозом и облитерацией.
Разработка точных и чувствительных методик количественного определения лекарственных веществ является неотъемлемой частью различных этапов их внедрения в практику как в доклинических, так и в клинических исследованиях [9]. В настоящее время, среди большого разнообразия биоаналитических методов масс-спектрометрические подходы являются наиболее предпочтительными, предоставляя возможность в проведении высокоточных, селективных и воспроизводимых анализов [10].
Целью данного исследования являлась разработка и валидация методики количественного определения простанита в плазме крыс и ее дальнейшее применение для установления основных фармакокинетических параметров разрабатываемого лекарственного средства.
Методы и принципы исследования
В работе использовали бычий сывороточный альбумин (БСА) степени очистки >96% (Sigma Aldrich, Германия), фосфатный буфер с рН 7,4 (Sigma Aldrich, Германия), ацетонитрил степени очистки «Для ВЭЖХ» (Merck, Германия), этилацетат безводный 99,8% (Sigma Aldrich, Германия), муравьиную кислоту (Sigma Aldrich, Германия), хлорид натрия (Sigma Aldrich, Германия). Деионизированную воду получали с использованием установки Milli-Q (Millipore Corporation, США).
Пробоподготовку образцов проводили методом жидкость-жидкостной экстракции. К 300 мкл плазмы добавляли 30 мкл рабочего раствора внутреннего стандарта (С=20 нг/мл) и 2 мл этилацетата. Экстракция проводилась при постоянном встряхивании в течение 10 минут. Далее смесь центрифугировали в течение 5 минут при 3000 об/мин и отбирали органический слой, который упаривали досуха при температуре 37 ºС. Сухой остаток перерастворяли в 100 мкл ацетонитрила.
Инструментальный анализ выполняли с использованием тандемного масс-спектрометра LCMS-8050 (Shimadzu Corporation, Япония). Хроматографическое разделение проводили на колонке Shim-pack FC-ODS 2мкм ×150мм (Shimadzu Corporation, Япония). Подвижная фаза А представляла собой 0,1 % раствор муравьиной кислоты, а фаза Б - 100 % ацетонитрил. Масс-спектрометрическое детектирование проводили в условиях отрицательной элекектроспрей ионизации. Температура нагревательного блока составляла 400 ºС, газа десольватации - 250 ºС, интерфейса - 300 ºС. Скорость потока газа распылителя составляла 3л/мин, а газа-осушителя – 10 л/мин.
Фармакокинетическое исследование простанита проводилось на шести здоровых крысах линии Wistar. Простанит вводили внутрибрюшинно в дозе 100 мг/кг, после чего отбирали кровь на одиннадцати временных точках. Первая временная точка отбиралась до введения препарата, и далее через 2, 4, 6, 8, 12, 18, 24, 32, 40, 48 и 60 минут. Полученные образцы крови центрифугировали (4000 об./мин, 10 мин, Т = -4°C) для выделения плазмы и далее убирали на хранение при минус 80ºС непосредственно до начала анализа.
Основные результатыВ соответствии с литературными данными и химической структурой простанита можно сделать вывод, что одним из предполагаемых путей его биотрансформации является гидролиз глицероэфирной связи, приводящий к образованию 1,3-ДНГ и ПГЕ1. ПГЕ1 в свою очередь под действием фермента 15-гидроксидегидроггеназы катаболизируется до образования 15кето метаболитов, конечным из которых является 13,14-дигидро-15-кето-ПГЕ1. В связи с этим, ранее было установлено, что основными продуктами биодеградации Простанита являются – ПГЕ1, 1,3-ДНГ и 13,14-дигидро-15-кето-ПГЕ1.
Пригодность методики количественного определения простанита в биологических жидкостях проводили по следующим валидационным характеристикам: селективность, линейность, нижний предел количественного определения, эффект переноса, правильность и прецизионность, эффект матрицы, степень извлечения и стабильнсть. Валидация проводилась в соответствии с рекомендациями руководств по валидации биоаналитических методик Управления по контролю за качеством пищевых продуктов и лекарственных средств (Food and Drug Administration, FDA) и Европейского агентства лекарственных средств (European Medicines Agency, EMA).
Селективность методики оценивали с использованием шести холостых образцов с добавлением внутреннего стандарта. Допускалось проявление незначительной интерференции, составляющей не более 20% от нижнего предела количественного определения. В результате анализа селективности образцов не было обнаружено каких-либо интерферирующих пиков с временами удерживания, соответствующими исследуемым аналитам (простаниту, ПГЕ1, д4-ПГЕ2, 1,3-ДНГ, 13,14-дигидро-15-кето-ПГЕ1).
Построение калибровочных кривых проводилось для описания зависимости отклика прибора от концентраций исследуемых аналитов. Линейный диапазон для простанита, ПГЕ1 и 13,14-дигидро-15кето-ПГЕ1 составлял 0,05-10 нг/мл, а для 1,3-ДНГ – 0,05 – 100 нг/мл. Методика считалась пригодной, если коэффициент корреляции Пирсона линейной калибровочной функции (R2) был выше 0,99, а также более 75% обратно рассчитанных концентраций калибраторов находились в пределах 15% от номинального значения (за исключением НПКО, для которого данное значение должно было находится в пределах 20%.
Нижний предел количественного определения (НПКО) определялся как наименьшая концентрация исследуемого аналита в биологической матрице, которая может быть надежно определена с приемлемой прецизионностью и точностью. В результате оценки НПКО простанита и его основных метаболитов нижний предел количественного определения для всех аналитов составил 0,05 нг/мл.
Эффект переноса определяли при введении холостого образца после образца калибровочного стандарта с концентрацией, соответствующей верхнему пределу количественного определения. Методика считалась пригодной, если перенос исследуемого аналита в холостом образце был ниже 20% от уровня НПКО. В результате анализа было установлено отсутствие исследуемого аналита или его следовых количеств в холостом образце.
Для оценки правильности и прецизионности методики проводили анализ образцов контроля качества внутри одного цикла (внутрисерийная правильность и прецизионность) и между циклами (межсерийная правильность и прецизионность). Методика считалась пригодной, если отклонение средней полученной концентрации аналита в образцах QC не превышало 15%, а для концентрации на уровне НПКО – 20%, и значения внутри- и межсерийных коэффициентов вариации для образцов QC не превышали 15%, а для QC на уровне НПКО – 20%. Результаты оценки правильности и прецизионности методики для простанита, ПГЕ1, 13,14-дигидро-15- кето-ПГЕ1 и 1,3-ДНГ представлены в таблице 1.
Таблица 1 − Данные по правильности и прецизионности разработанной методики для Простанита
| Аналит | Образец QC | Номинальная конц., нг/мл | Измеренная конц. (n = 18) | CV, % внутри серии | CV, % между сериями |
| Простанит | НПКО | 0,05 | 0,051 | 5,13 | 3,11 |
| Низкий | 0,15 | 0,152 | 3,4 | 1,6 | |
| Средний | 4,5 | 4,51 | 3,86 | 5,62 | |
| Высокий | 7,5 | 7,45 | 3,67 | 7,40 | |
| ПГЕ1 | НПКО | 0,05 | 0,05 | 4,89 | 8,53 |
| Низкий | 0,15 | 0,152 | 1,9 | 7,1 | |
| Средний | 4,5 | 4,56 | 3,04 | 6,78 | |
| Высокий | 7,5 | 7,58 | 2,74 | 3,22 | |
| 13,14-дигидро-15-кето-ПГЕ1 | НПКО | 0,05 | 0,051 | 6,91 | 5,12 |
| Низкий | 0,15 | 0,153 | 1,5 | 3,4 | |
| Средний | 4,5 | 4,50 | 1,71 | 6,10 | |
| Высокий | 7,5 | 7,23 | 1,59 | 4,60 | |
| 1,3-ДНГ | НПКО | 0,05 | 0,05 | 4,30 | 12,66 |
| Низкий | 0,15 | 0,148 | 2,3 | 3,2 | |
| Средний | 45 | 45.6 | 2,47 | 4,89 | |
| Высокий | 75 | 74.8 | 2,33 | 3,70 |
Матричный эффект оценивался в холостых образцах при расчете отношения площади хроматографического пика аналита в присутствии матрицы к площади чистого раствора исследуемого аналита. Матричный эффект и степень извлечения методики считались пригодными, если средний коэффициент вариации для каждой концентрации не превышал 15%. Результаты оценки матричного эффекта и степени извлечения простанита и его основных метаболитов представлены в таблице 2.
Таблица 2 – Эффект матрицы и степень извлечения
| Аналит | Эффект матрицы (ME, %) | Степень извлечения (REC, %) | ||
| Простанит | 98,41 ± 1,85 | 1,88 | 99,82 ± 0,16 | 0,16 |
| ПГЕ1 | 99,58 ± 0,42 | 0,42 | 100,1 ± 0,46 | 0,46 |
| 13,14-дигидро-15-кето-ПГЕ1 | 98,94 ± 0,61 | 0,61 | 99,6 ± 0,49 | 0,49 |
| 1,3-ДНГ | 96,75 ± 1,12 | 1,12 | 97,32 ± 0,78 | 0,80 |
| Норма | 85,00 - 115,0 | ± 15 % | 85,00 - 115,0 | ± 15 |
Оценка стабильности проводилась для приготовленных образцов, после их хранения при комнатной температуре в течение 10 часов, образцов хранящихся в автосамплере прибора при температуре 10ºС и образцов после пяти циклов замораживания-размораживания. Методика считалась пригодной в случае, если усредненная концентрация исследуемого аналита на каждом уровне была в пределах 20% от номинальной концентрации. Результаты оценки стабильности исследуемых аналитов свидетельствовали о валидности разрабатываемой методики.
Изучение фармакокинетики простанита и его производных
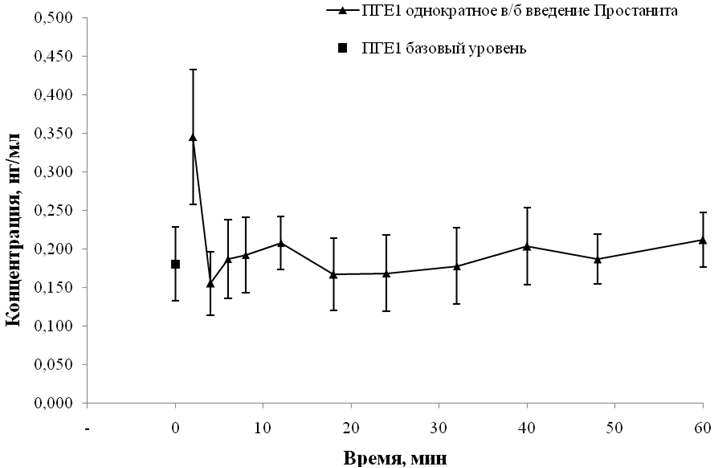
Основной метаболит простонита – ПГЕ1 был количественно определен во всех образцах плазмы крови крыс. В первой временной точке после введения лекарственного средства наблюдался статистически значимый рост уровня ПГЕ1 отнсоительно группы контроля. Фармакокинетическая кривая ПГЕ1 представлена на рисунке 2.
Рис. 2 − Фармакокинетическая кривая ПГЕ1 в плазме крови крыс
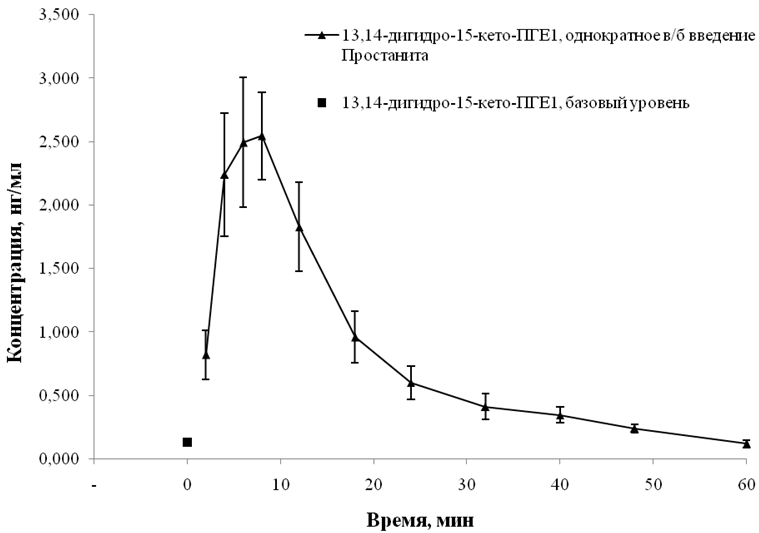
Уже в первой временной точке после введения простанита наблюдалось значимое повышение концентрационного уровня 13,14-дигидро-15кето-ПГЕ1, в то время как к поледней экспериментальной точке концентрация опускалась до базового значения (см. рисунок 3).
Рис. 3 − Фармакокинетическая кривая 13,14-дигидро-15-кето-ПГЕ1 в плазме крови крыс
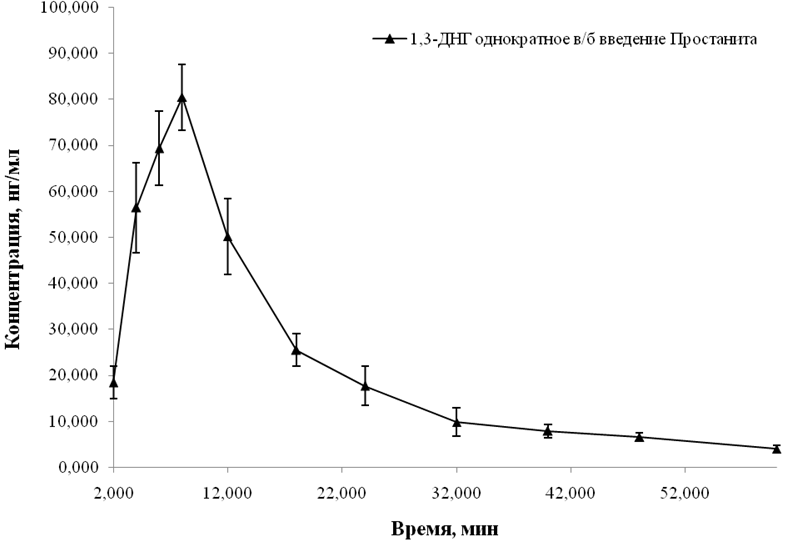
1,3-ДНГ представлял собой другой активный метаболит простанита, также характеризующийся высокой скоростью биодеградации в условиях in vivo. Образование метаболита происходит уже в первой временной точке после введения простанита и достигает максимума через восемь минут после внутривенного введения препарата (см. рисунок 4).
Рис. 4 − Фармакокинетическая кривая 1,3-ДНГ в плазме крови крыс
Фармакокинетические параметры основных метаболитов простанита –13,14-дигидро-15кето-ПГЕ1 и 1,3-ДНГ представлены в таблице 3.
Таблица 3 − Основные фармакокинетические параметры рассчитанные для метаболитов 13,14-дигидро-15-кето-ПГЕ1 и 1,3-ДНГ после введения Простанита крысам в дозе 100 мкг/кг
| Параметр | 13,14-дигидро-15-кето-ПГЕ1 | 1,3-ДНГ |
| Λz, мин-1 | 0.0632 | 0.0320 |
| t1/2, мин | 10.97 | 21.64 |
| Tmax, мин | 8 | 8 |
| Cmax, нг/мл | 2.413 | 80.399 |
| C0, нг/мл | 0.690 | 18.401 |
| AUC 0-60, нг/мл×мин | 39.376 | 1305.979 |
| AUC 0-∞, нг/мл×мин | 41.1095 | 1429.799 |
| AUC 0-60/0-∞, нг/мл×мин | 0.958 | 0.913 |
| MRT 0-∞, мин | 15.76 | 23.02 |
| Vz, л/кг | 38.508 | 2.183 |
| Cl, л/мин×кг | 2.4325 | 0.070 |
| Vss, л/кг | 38.344 | 1.610 |
Полученные результаты фармакокинетического исследования продемонстрировали невозможность проведения доклинического изучения фармакокинетики простанита из-за высокой скорости биотрансформации простанита. Определение основных фармакокинетических параметров было возможно только для наиболее стабильных метаболитов простанита 13,14-дигидро-15-кето-ПГЕ1 и 1,3-ДНГ.
ЗаключениеВ представленной работе была проведена разработка и валидация методики количественного определения простанита и его основных метаболитов в плазме крови крыс методом ВЭЖХ-МС/МС. Разаработанная методика была апробирована при установлении фармакокинетики простанита в плазме крыс после внутрибрюшного введения препарата в дозе 100 мкг/кг. В результате исследования была установлена невозможность определения простанита в плазме крови крыс из-за высокой скорости биодеградации исследуемого аналита.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Serkov I. V. 1,3-Dinitrates of cyclooxygenase metabolites of endocannabinoid 2-arachidonoylglycerol. Synthesis and properties / I. V. Serkov, V. V. Bezuglov // Russian Journal of Bioorganic Chemistry. — 2009. — V. 35(2). — P. 225-232.
- Shestakova K.M. In Vivo Targeted Metabolomic Profiling of Prostanit, a Novel Anti-PAD NO-Donating Alprostadil-Based Drug / K.M. Shestakova, N.E. Moskaleva, N.V. Mesonzhnik and others. // Molecules. — 2020. — V. 25(24) — 5896.
- Heymann M.A. Evaluation of alprostadil (prostaglandin E1) in the management of congenital heart disease in infancy / M.A. Heymann, R.I. Clyman // Pharmacotherapy. — 1982. — V. 2(3). — P. 148-155.
- Makino H. Increase in peripheral blood flow by intravenous administration of prostaglandin E1 in patients with peripheral arterial disease, accompanied by up-regulation of hepatocyte growth factor / H. Makino, M. Aoki, N. Hashiya et al. // Hypertens Res. — 2004. — V. 27(2). — P. 85-91.
- Çevirme D. Comparison between iloprost and alprostadil for protection against ischemia/reperfusion injury in a rat model / D. Çevirme, T. Adademir, E. Kafal Başaran et al. // Turk J Med Sci. — 2018. — V. 48(3). — P. 661-669.
- Tesloianu D.N. Comparison Between Alprostadil and Iloprost in Intravenous Treatment of Patients With Chronic Peripheral Arterial Disease / D.N.Tesloianu, C. Morosanu, E.C. Roata, L. Sorodoc. // Maedica (Bucur). — 2016. — 11(3). — P. 186-190
- Wahlberg E. Vascular and Endovascular Surgery: A Companion to Specialist Surgical Practice / E. Wahlberg // European Journal of Vascular and Endovascular Surgery, — 2010. — V. 40(5), — P. 681.
- Gaynullina D.K. Changes in Endothelial Nitric Oxide Production in Systemic Vessels during Early Ontogenesis-A Key Mechanism for the Perinatal Adaptation of the Circulatory System / D.K. Gaynullina, R. Schubert, O.S.Tarasova // Int J Mol Sci. — 2019. — V. 20(6). — P. 1421.
- Marzo A. Tandem mass spectrometry (LC-MS-MS): a predominant role in bioassays for pharmacokinetic studies / A. Marzo, L.D. Bo. // Arzneimittelforschung. — 2007. — V. 57(2). — P.122-128.
- Ponnayyan Sulochana S. Review of the validated HPLC and LC-MS/MS methods for determination of drugs used in clinical practice for Alzheimer's disease / S. Ponnayyan Sulochana, K. Sharma, R. Mullangi et al. // Biomed Chromatogr. — 2014. — V. 28(11). — P.1431-1490.