THE LEVEL OF AMMONIUM SALTS (AMMONIA) IN THE WATER OF VOLGOGRAD AND ITS SUBURBS
Гиззатова Г.Л.1, Сон В.В.2, Шипаева Т.А.3
1 Кандидат технических наук, 2 Кандидат химических наук, 3 Кандидат химических наук, Волгоградский Государственный Аграрный Университет
УРОВЕНЬ АММОНИЙНЫХ СОЛЕЙ (АММИАКА) В ВОДЕ Г.ВОЛГОГРАДА И ПРИГОРОДА
Аннотация
В данной статье говорится о методиках определения аммонийных солей в гидросфере. Результаты исследования природной воды на содержание аммиака показали, что уровень его в водоемах колеблется в следующих пределах от 28 до 104 мкмоль/л.
Ключевые слова: аммонийные соли, гидросфера.
Gizzatova G.L.1, Son V.V.2, Shipaeva T.A.3
1 PhD in Engineering, 2 PhD in Chemistry, 3 PhD in Chemistry, Volgograd State Agrarian University
THE LEVEL OF AMMONIUM SALTS (AMMONIA) IN THE WATER OF VOLGOGRAD AND ITS SUBURBS
Abstract
This article refers to the methods of determination of ammonium salts in the hydrosphere. The results of the study of natural water on the ammonia content showed that the level in the reservoirs fluctuates in the range from 28 to 104 mmol/l.
Keywords: ammonium salt, hydrosphere
Для определения аммонийных солей первоначально использовали процедуру, основанную на известной реакции Несслера, в частности она рекомендуется для анализа воды [1].Однако из-за часто возникающего помутнения проб (образуется коллоидный раствор желтого цвета) данный метод нас не удовлетворил, хотя предварительно была предпринята попытка стабилизировать полученный золь раствором гуммиарабика, но в этом случае результаты были завышены и нестабильны. В вышеупомянутом руководстве указано, что «определению аммиака мешают амины, хлорамины, ацетон, альдегиды, спирты и некоторые органические соединения, реагирующие с реактивом Несслера», другими словами реакция Несслера явно не специфична.
В свое время эта реакция использовалась для определения полиаминов. Оказалось, что более воспроизводимые и надежные результаты достигаются в случае применения индофенольной реакции Бертло, в которой образуется синий хромоген молекулярной структуры (индофенол). Широкое применение этой реакции для определения аммонийных солей в различных объектах привело к тому, что еще в 70-е годы прошлого века было описано, пожалуй, около сотни вариантов модификаций этого метода [2] например, индофенольная реакция рекомендована для определения NH3 в воздухе [3]. В своей работе мы использовали модификацию Chaney и Marbach, которая отличается простотой и хорошей восприимчивостью [4]. Узким местом индофенольной реакции является то обстоятельство, что развитие и интенсивность окраски проб существенно зависит от концентрации активного хлора в щелочном гипохлорите, а также от pH. Последний должен быть в пределах 11,0-11,6. Решить эту проблему можно, если параллельно с серией опытных проб ставить пробы с 1 ммолярным раствором NH4Cl (стандарт) и находить концентрацию аммония в опытных пробах по правилу пропорций. В исследуемых нами образцах природной воды уровень аммонийных солей (аммиака) колеблется в пределах от 28 до 104 мкмоль/л. При норме 118 мкмоль/л.
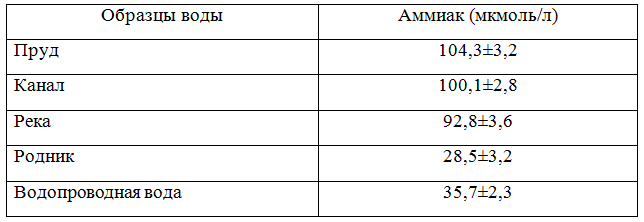
Таблица 1 - Концентрация аммиака в исследуемых образцах воды (август, 2015)
Как видно из табл. 1 наиболее высокий уровень аммонийных солей обнаружен в пруду с. Червленое, что, по-видимому, связано с поступлением в водоем сельскохозяйственных стоков и отсутствием циркуляции воды.
В сообщении профессора В.В. Чапуркина за 1994 отмечено, что уровень аммиака в атмосфере южной окраины Волгограда (Дубовый Овраг) превышал ПДК в 8,9 раз [5]. Автор объясняет это воздействием прудов испарителей в районе Светлого Яра (160 км2).
Полученные нами результаты по водоемам в 2015 г., представленные в табл. 1, заметно ниже, что можно интерпретировать как улучшение экологической обстановки в этом регионе в последние годы. Изучены сезонные колебания аммонийных солей в различных водоемах (рис. 1).
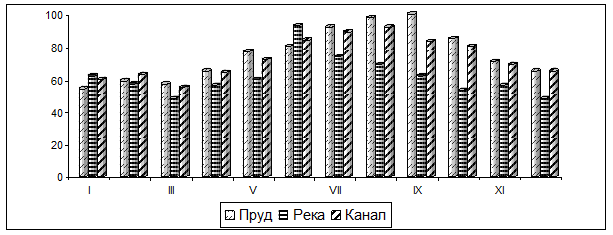
Рис. 1. Содержание аммиака в образцах воды
абсцисса: месяца года
ордината: концентрация мочевины (мкмоль/л)
Из представленного на рис. 1 временного графика видно, что
1) уровень аммонийных солей в исследуемых водоемах (река, канал) сравнительно мало отличается, особенно в отношении проточных систем;
2) имеются сезонные подъемы уровня аммиака: для воды пруда. Такой подъем отмечается на конец лета и осени, что можно объяснить усиленным развитием планктона. Сезонные колебания уровня NH3 в реке и канале были монотонными;
3) минимальное содержание аммиака (≈50 мкмоль/л) приходится на зимние месяцы.
Наконец, в зимний период исследовалось содержание аммиака в снеговом покрове 38,7 мкмоль/л.
Характер колебаний уровня аммиака в природных водах заставляет предположить естественное биотическое происхождение этого поллютанта и то, что колебания связаны с биотрансформацией азотистого органического материала водной микрофлорой. Взаимосвязь между содержанием аммиака и уровнем мочевины в водной среде мы планируем рассмотреть в следующей статье, посвященной мочевине.
Следует заметить, что изменение уровня аммонийных солей в природных водах имеет важное значение для технической ихтиологии и рыборазведения. В интересном обзоре A. Van Waarde сообщается, что в отличие от наземных животных рыбы используют кормовой белок преимущественно как источник энергии (в среднем, около половины кормового протеина используется для этой цели). При этом в качестве конечного продукта выделяется аммиак. В результате при нарушении технологических условий выращивания молоди вдвое инкубатора могут накапливаться значительные количества аммиака, что, несомненно, должно привести к аммиачному токсикозу рыб [6]. Предложенный здесь метод определения аммиака в воде может быть весьма полезен для контроля качества воды в инкубаторах для рыб.
Что касается биологического значения аммиака в гидросфере и, вообще, в окружающей среде, то рассматривать его как токсичный поллютант следует в случае локальных залповых выбросов техногенного происхождения. В этих случаях его концентрация в воде может во много раз превышать допустимые нормы (Тинсли, 1982).
Естественно образующийся в природе биотический аммиак скорее надо рассматривать со знаком плюс. Можно выделить по крайне мере две положительных функции биогенного аммиака. Во-первых, он является легко усвояемым азотистым нутриентом для автотрофных организмов водной среды; микробных видов, обитающих в водной среде и активно утилизирующих аммонийные соли достаточно много [7].
Вторая функция природного аммиака состоит в нейтрализации образующихся в атмосфере и гидросфере кислотных эквивалентов, т.е. в нейтрализации кислотной седиментации в воздухе и кислотной среды водоемов. На эту функцию аммиака указывает венгерский специалист по мониторингу окружающей среды Ласло Хорват [8]. Этот автор, в частности, сообщает, что обычная концентрация аммония в водных осадках в Венгрии находится на уровне 81 мкг/л (около 5 мкмоль/л) и что атмосферный и водный аммиак активно взаимодействует с оксидами серы, азота, хлоридом водорода и другими протонодонорами согласно следующим примерным реакциям:
- SO3 + NH3 → (NH4)2SO4 (атмосфере)
- HNO3 + NH3 → NH4NO3 (гидросфере)
Практически бесконечное растворение атмосферного аммиака в воде способствует нейтрализации кислотных эквивалентов в гидросфере.
Литература
- Руководство по химическому анализу поверхностных вод суши / Под ред. А.Д. Семенова. - Л.: Гидрометеоиздат, 1997. - 541 с.
- Храмов В.А. Определение азота в биологических объектах с помощью реакции Бертло // Лабораторное дело. - 1965. - №7.- с. 396 - 399.
- Муравьева С.И., Казнина Н.И., Прохоров Е.К. Справочник по контролю вредных веществ в воздухе. М.: «Химия». 1988. с. 32
- Chaney A. L. Marbach E. P., Clin. 1962, vol. 8, p. 131.
- Чапуркин В.В.Химические проблемы экологии Волгограда. Бюллетень №1 Волгоградского клуба докторов наук. Экологические проблемы и суждение. Волгоград, 25 марта 1994. с.19.
- Waarde A.V. Aerobic and anaerobic ammonia production be fish//Comp. Biochim. Phesiol. 1983. Vol. 74 B. P.673-684.
- Готтшаляк Т. Метаболизм бактерий. — М.: Мир, 1982. – 310 с.
- Хорват Л. Кислотный дождь/Пер. с венг.В.В. Крымского; Под. Ред. Ю.Н. Михайловского. – М.: Стройиздат.1990. с.
References
- Rukovodstvo po himicheskomu analizu poverhnostnyh vod sushi / Pod red. A.D. Semenova. - L.: Gidrometeoizdat, 1997. - 541 s.
- Hramov V.A. Opredelenie azota v biologicheskih ob#ektah s pomoshh'ju reakcii Bertlo // Laboratornoe delo. - 1965. - №7.- s. 396 - 399.
- Murav'eva S.I., Kaznina N.I., Prohorov E.K. Spravochnik po kontrolju vrednyh veshhestv v vozduhe. M.: «Himija». 1988. s. 320.
- Chaney A. L. Marbach E. P., Clin. Chem. 1962, vol. 8, p. 131.
- Chapurkin V.V.Himicheskie problemy jekologii Volgograda. Bjulleten' №1 Volgogradskogo kluba doktorov nauk. Jekologicheskie problemy i suzhdenie. Volgograd, 25 marta 1994. s.19.
- Waarde A.V. Aerobic and anaerobic ammonia production be fish//Comp. Biochim. Phesiol. 1983. Vol. 74 B. P.673-684.
- Gottshaljak T. Metabolizm bakterij. — M.: Mir, 1982. – 310 s.
- Horvat L. Kislotnyj dozhd'/Per. s veng.V.V. Krymskogo; Pod. Red. Ju.N. Mihajlovskogo. – M.: Strojizdat.1990. s.